不同蛋白质和碳水化合物饲料来源对牛瘤胃洗涤纤维降解和瘤胃液产物的定量研究
2010-06-07王星凌赵红波黄德建王秀芹孙家林
王星凌 赵红波 黄德建 王秀芹 孙家林
反刍动物瘤胃微生物正常代谢以日粮碳水合化物和氮来源为基础,瘤胃微生物对饲料碳水合化物代谢依赖于日粮中淀粉和纤维来源。大量研究集中在日粮不同蛋白质和碳水化合物来源影响饲料消化率、瘤胃液产物和动物生产性能(Hoover和Stokes,1991;Hussein 等,1991;López等,2003;Nombekala 和 Murphy,1995;Rotger等,2006;Shabi等,1998)。这些研究多采用点取样或指示剂标记法,尤其是瘤胃取样,研究内容多为定性测定。本试验采用瘤胃掏空技术测定不同蛋白质和碳水化合物饲料对瘤胃内洗涤纤维降解和瘤胃液产物的定量影响,准确研究瘤胃微生物对日粮洗涤纤维的瘤胃降解和瘤胃微生物发酵的相关产物。
1 材料与方法
1.1 试验动物
试验动物为3头体重相近的青年母牛,试验之前按欧洲两步骤外科手术瘘管安装法安装大口径瘤胃瘘管(王星凌等,1999),手术后3头母牛恢复正常,瘤胃密闭性良好。试验地点为山东省农科院畜牧兽医研究所奶牛场。
1.2 试验方法
1.2.1 试验设计
试验设计为3×3拉丁方,用3头安装永久性大口径瘤胃瘘管的青年黄母牛饲喂3种不同精饲料的日粮,三种精饲料配方及营养水平见表1,分别为豆粕(SBM)+玉米(日粮 1),猪血粉(BM)+玉米(日粮 2)和豆粕+小麦(日粮3),精料日喂量按活牛体重的1%喂给,即三个周期依次为3、3.6和4 kg,干玉米秸等量配给,实行精粗料混合饲喂。饲喂时间分别为7:30和17:30,自由饮水。
1.2.2 试验程序
试验为3个试验周期,每一周期为37 d,其中适应期26 d。在每一周期的第27 d,对三头瘤胃瘘管牛同时实施瘤胃掏空技术。在早晨采食后2、4、8、16和24 h,分别5次掏空瘤胃内容物,其中2、4、8和24 h分别用2 d间隔,16 h用3 d间隔,内容物液体和固体分别放置称取总重,然后按相同比例取液体和固体重量测定瘤胃内容物干物质(DM)重量。液体分离后,用尼龙布过滤置于两个塑料瓶中,测定pH值、液体氨氮、挥发性脂肪酸(VFAs)。取固体内容物测定洗涤纤维(NDF和ADF)。
1.2.3 化学分析
将瘤胃固体内容物收集、烘干,测定干物质、洗涤纤维(AOAC,1990)。瘤胃液体测定NH3-N(Crook和Simpson,1977)和 VFA(Fussel和 McCalley,1987)。用电子pH仪测定液体pH值。所有测定数据用PROC GLM程序进行方差分析(ANOVA),处理各组平均值用最小显著差异法比较(LSD)(SAS,2000)。
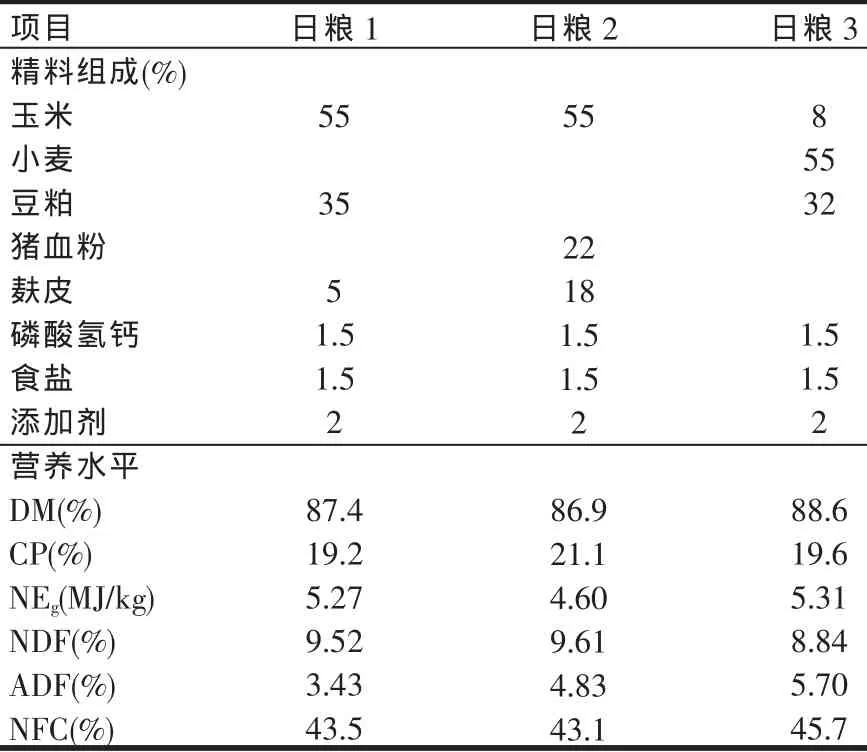
表1 瘤胃瘘管牛精料配方及营养水平
2 结果与讨论
2.1 不同日粮瘤胃干物质和瘤胃液在采食后不同时间的瘤胃存留量
瘤胃内容物包括瘤胃固体和液体两部分,瘤胃内容物存留量变化见表2。本文讨论的瘤胃洗涤纤维降解存在于瘤胃固体内容物,瘤胃液氨氮和挥发性脂肪酸则存在于瘤胃液体内容物。在采食量相同的条件下,日粮1在采食后2~8 h瘤胃干物质和瘤胃液总存留量最低,与其他两种日粮相比差异显著(P<0.05)。日粮1维持瘤胃内容物最低的存留量,这可能是由于日粮1形成这样稳定的瘤胃环境,即促进瘤胃内容物降解和利用,提高纤维降解速率以及瘤胃内固相食糜和液相食糜的消失速率。
王星凌等(2002)测定了豆粕、血粉、小麦和玉米4种蛋白质和碳水化合物单一饲料不同培养时间的瘤胃消失率,结果是血粉消失率最低,豆粕和玉米在瘤胃内培养16 h消失率达到高峰,而小麦在瘤胃内培养8 h消失率达到高峰。豆粕和玉米相似的消失速率可能维持瘤胃微生物的最大降解和合成。由此,豆粕和玉米相似的消失速率导致日粮1内容物存留总量在采食后 2~8 h较低(P<0.05),直到 16 h才与其它日粮没有显著差异。
2.2 不同日粮洗涤纤维在采食后不同时间的瘤胃存留量
瘤胃洗涤纤维存留量变化见表3。日粮1的瘤胃中性洗涤纤维(NDF)存留量在采食后2~16 h均低于其它两种日粮(P<0.05);日粮1的瘤胃酸性洗涤纤维(ADF)存留量在采食后2~4 h与其它两种日粮差异不显著(P>0.05),在采食后8~16 h均低于其它两种日粮(P<0.05)。这意味着日粮中性洗涤纤维(NDF)降解速率比日粮酸性洗涤纤维(ADF)快,酸性洗涤纤维可能受日粮组合的影响较小;而日粮2和日粮3对日粮洗涤纤维没有影响(P>0.05)。
采食后2 h和8 h相比,瘤胃中性洗涤纤维(NDF)存留量下降幅度最大的是日粮1,下降0.40 kg,而日粮2下降0.03 kg,日粮3下降0.32 kg。日粮3中性洗涤纤维(NDF)存留量下降幅度受到采食后2 h的存留量影响。采食后2和4 h相比,瘤胃酸性洗涤纤维(ADF)存留量下降幅度最大的是日粮1,下降0.09 kg;而日粮2下降0.03 kg,日粮3下降0.03 kg。

表2 不同日粮瘤胃干物质和瘤胃液在采食后不同时间的瘤胃存留量
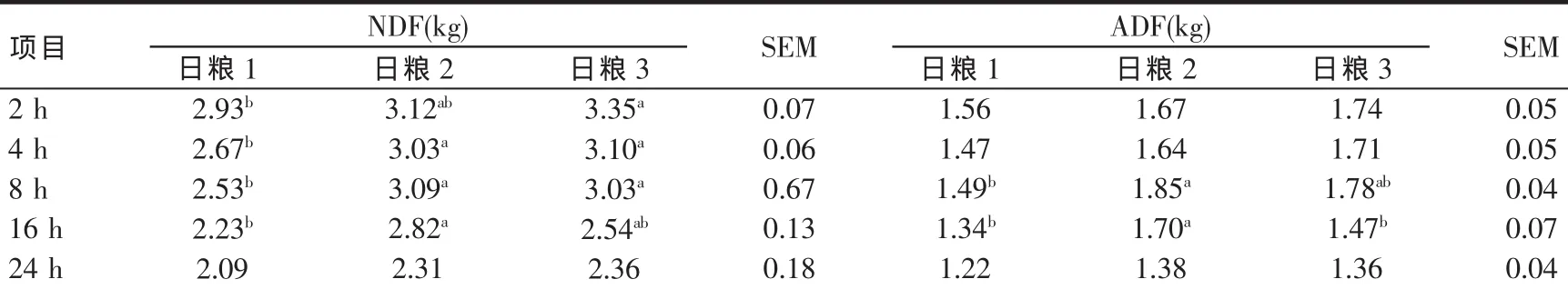
表3 不同日粮洗涤纤维在采食后不同时间的瘤胃存留量
2.3 不同日粮瘤胃液pH值、氨氮和总VFA在采食后不同时间的瘤胃存留量
瘤胃液pH值、氨氮和总挥发性脂肪酸存留量变化见表4。瘤胃pH值是评价瘤胃发酵状况的基本指标,反映瘤胃微生物对底物的发酵利用程度(Calsamiglia 等,2008)。NRC(2001)指出,瘤胃 pH 值<6.2时微生物降解和合成效率下降。本试验牛瘤胃pH值维持在6.6~7.3,不影响瘤胃微生物的正常代谢(Roger等,2006)。本试验中日粮3导致采食后2 h瘤胃液pH值下降,4 h降到最低点,8 h回升;日粮1在采食后2 h的pH值为最低,之后缓慢呈线性回升,这种缓慢回升可能为瘤胃微生物活动提供缓冲能力;日粮2瘤胃液pH值在采食后2~8 h基本无变化。三种日粮在不同采食时间pH值无显著差异(P>0.05)。
瘤胃液氨氮浓度反映了瘤胃微生物对日粮蛋白质在瘤胃的降解程度(Devant等,2000)。日粮1和日粮3在采食后2 h瘤胃液氨氮总量达最高点(P<0.05)。日粮1至采食后16 h开始下降,而日粮3在采食4 h瘤胃液氨氮开始下降,日粮2在采食2 h和4 h,氨氮显著减少,到8 h上升,氨氮总量直到采食后24 h,与其它两个日粮的氨氮量相同。可能由于日粮2中猪血粉蛋白质的瘤胃降解率偏低导致不能满足瘤胃微生物合成所需的氮来源,只在采食后8 h日粮2的氨氮总量升高。日粮1瘤胃液氨氮数量采食后2~8 h处于高峰状态,说明瘤胃微生物在瘤胃环境长时间一直保持稳定的降解能力。
VFA瘤胃存留量反映VFA在瘤胃产生和移除的平衡(López等,2003)。三种日粮的总挥发性脂肪酸在采食后2~4 h差异不显著(P>0.05),日粮1和日粮3处于较高的瘤胃存留量,日粮1在采食后8~16 h瘤胃存留量降低,与日粮2和日粮3相比差异显著(P<0.05)。日粮1对瘤胃VFA移除速度较快,日粮2则较慢。日粮1对瘤胃VFA的快速移除,意味着瘤胃液的快速流出以及可能解释瘤胃固体内容物的快速移除。
2.4 不同日粮瘤胃液VFAs在采食后不同时间的瘤胃存留量(见表5)
瘤胃液中VFA的瘤胃存留量各组间差异不显著(P>0.05)。日粮1中乙酸的瘤胃存留量在采食后2~4 h,处于较高的水平,采食后8 h开始下降,16~24 h处于稳定状态。丙酸和丁酸的变化趋势与乙酸相同。
日粮2中乙酸和丙酸的瘤胃存留量在采食后2~4 h没有变化,到8 h才略有上升,之后开始下降;丁酸在采食后2~8 h变化不大,之后开始下降。日粮3中乙酸的瘤胃存留量在采食后4 h,处于较高的水平,采食后8 h开始下降;丙酸和丁酸的变化趋势同乙酸。
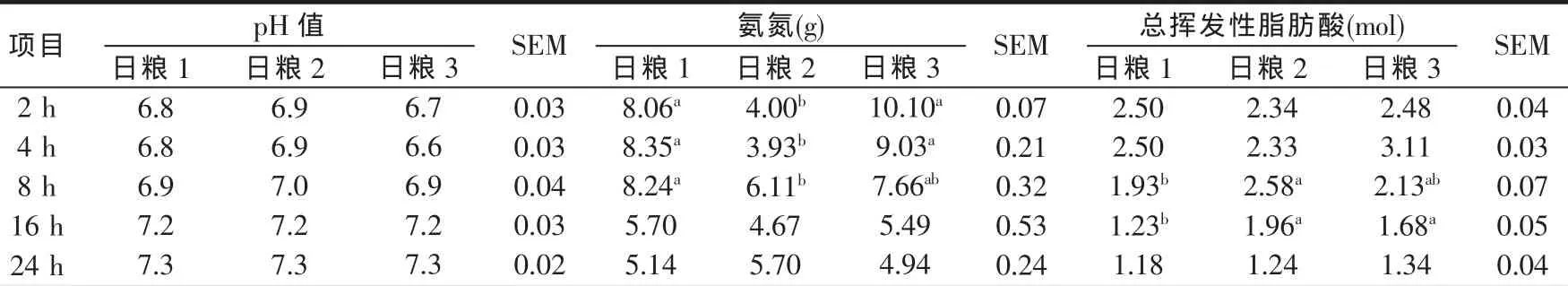
表4 不同日粮瘤胃液pH值、氨氮和总VFA在采食后不同时间的瘤胃存留量
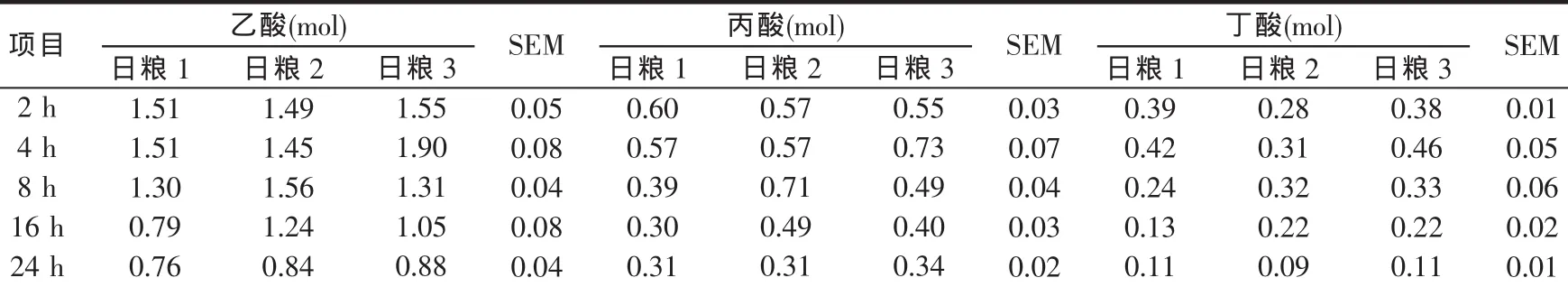
表5 不同日粮瘤胃液VFAs在采食后不同时间的瘤胃存留量
3 结论
从测定不同瘤胃培养时间的pH值、VFA、内容物存留量的变化指标看出,由豆粕+玉米组成的日粮1提供降解秸秆理想的瘤胃环境,有助于促进DM、NDF、ADF和VFA在瘤胃的消失数量。由豆粕+小麦组成的日粮3虽不能改变瘤胃固体内容物和洗涤纤维的存留量,但在采食后短时间内,也有助于瘤胃液氨氮和挥发性脂肪酸产量;由猪血粉+小麦组成的日粮2缺乏瘤胃所需的降解蛋白质,导致瘤胃代谢各项指标最差。
[1]AOAC.Official Methods of Analysis[M].13th ed.Association of Official Analytical Chemists,Washington,DC.1990.
[2]Calsamiglia S,P.W.Cardozo,A.Ferret et al.Changes in rumen microbial fermentation are due to a combined effect of type of diet and pH[J].J.Anim.Sci.,2008,86:702-711.
[3]Crook W M,Simpson W E.Determination of ammonium in Kjeldahl digests of crops by an automated procedure[J].J.Sci.Food A-gric.,1971,22:9-10.
[4]Devant M,Ferret A,Gasa J,et al.Effects of protein concentration and degradability on performance,ruminal fermentation,and nitrogen metabolism in rapidly growing heifers fed high concentrate diets from 100 to 230 kg body weight[J].J.Anim.Sci.,2000,78:1667-1676.
[5]Fussell R J,McCalley D V.Determination of volatile fatty acids(C2-C5)and lactic acid in silage by gas chromatography[J].Analyst,1987,112:1213-1216.
[6]Hoover W H and S.R.Stokes.Balancing carbohydrate and protein for optimum rumen microbial yield[J].J.Dairy Sci.,1991,74:3630-3644.
[7]Hussein H S,Stern M D,Jordan R J.Influence of dietary protein and carbohydrate sources on nitrogen metabolism and carbohydrate fermentation by ruminal microbes in continuous culture[J].J.Anim.Sci.,1991,69:2123-2133.
[8]López S,F.D.D.Hovell,J.Dijkstra et al.Effects of volatile fatty acid supply on their absorption and on water kinetics in the rumen of sheep sustained by intragastric infusions[J].J.Anim.Sci.,2003,81:2609-2616.
[9]Nombekela S W,M R Mushy.Sucrose supplementation and feed intake of dairy cows in early lactation[J].J.Dairy Sci.,1995,78:880-885.
[10]NRC.Nutrient requirements of dairy cattle(7th)[M].Washington DC:National Academy Press,2001:13,34,184-282.
[11]RotgerA,Ferret A,Manteca X,et al.Effects of dietary nonstructural carbohydrates and protein sources on feeding behavior of tethered heifers fed high-concentrate diets[J].J.Anim Sci.,2006,84:1197-1204.
[12]Shabi Z,Arieli A,Bruckental I,et al.Effect of the synchronization of the degradation of dietary crude protein and organic matter and feeding frequency on ruminal fermentation and flow of digesta in the abomasum of dairy cows[J].J.Dairy Sci.,1998,81:1991-2000.
[13]SAS Institute Inc.Sas,Version 8.0 [M].SAS Institute Inc,Cary NC.USA.2000.
[14]王星凌,李兴光,宋恩亮.大口径牛瘤胃瘘管的安装和应用[J].山东农业科学,1999,(1):48-49.
[15]朱承满,王星凌,秦延年等.同步降解精饲料对奶牛生产性能的影响[J].山东农业科学,2002,(3):37-39.
