草珊瑚总黄酮的微波提取研究
2010-06-04,
,
(三明学院化学与生物工程系,福建 三明 365004)
草珊瑚(Sarcandraeglabra)又名肿节风、九节茶、竹节草、鸭脚节、牛膝头等,属于金粟兰科草珊瑚属,其味苦、辛、性温、有小毒,有驱风通络、活血祛淤、止血止痛、接骨续筋之功效,民间常用来治疗风湿痹症、跌打损伤等[1~4],多为全草入药。临床上草珊瑚主要用于治疗肿瘤、胃溃疡、细菌性痢疾、骨折及各种口腔疾病。草珊瑚主要分布在四川、云南、贵州、安徽、福建、江西等地,资源丰富。草珊瑚中含量最多、最主要的药用成分是黄酮类化合物[4~9]。草珊瑚总黄酮具有抗菌消炎、清热解毒、抗肿瘤、促进骨折愈合等多种生物活性[6~10]。毒理学研究表明,草珊瑚及其提取物具有较好的安全性[11]。因此,近年来,草珊瑚活性成分的高效提取一直是国内外研究的重要课题。
目前,黄酮类化合物的常规提取方法主要有冷浸法、渗漉法、煎煮法、回流提取法、稀醇提取法和微波法。其中微波法具有选择性高、操作时间短、溶剂消耗少、提取率高、不产生噪音等优点,适用于热不稳定生物质药材的提取[12~31]。
本研究采用单因素实验和正交实验对三明地区基因工程选育的草珊瑚总黄酮进行提取,得出最佳的工艺条件,拟为三明地区基因工程选育的草珊瑚的开发利用提供有益的参考。
1 实验
1.1 原料、试剂与仪器
草珊瑚叶片采自福建三明市吉口天然药物种植基地。
芦丁标准品,中国药品生物制品检定所;95%乙醇、亚硝酸钠、硝酸铝、氢氧化钠、磷酸,分析纯;甲醇,色谱纯;水为超纯水。
LWMC-205型可调功率微波化学反应器,南京陵江科技开发有限责任公司;722S型可见分光光度计、FA1604N型电子天平,上海精密科学仪器有限公司;UV-1100型紫外可见分光光度计,北京瑞利;SHB-3型循环水式多用真空泵,郑州杜甫仪器厂;800型离心沉淀器(4000 r·min-1),上海手术器械厂;360型FTIR红外光谱仪,美国Nicolet公司;1200型高效液相色谱仪,美国安捷伦公司。
1.2 方法
1.2.1 草珊瑚总黄酮的提取
精确称取0.5 g草珊瑚叶片粉末(过120目筛)于锥形瓶中,加入一定量不同质量分数的乙醇摇匀,将瓶口用保鲜膜覆盖,浸泡1 h,在一定功率下微波提取一定时间,抽滤,滤液加水定容。
1.2.2 草珊瑚总黄酮的测定
1.2.2.1 标准溶液的配制
精密称取10.4 mg已烘干至恒重的芦丁标准品,置100 mL容量瓶中,用60%乙醇溶解并定容至刻度,摇匀,得到浓度为0.104 mg·mL-1的标准溶液。
1.2.2.2 标准曲线的绘制
取芦丁标准溶液显色后在400~600 nm波长范围内扫描,确定最大吸收波长为510 nm。精密量取芦丁标准溶液0.0 mL、0.5 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL分别置于10 mL容量瓶中,各加60%乙醇至5 mL;各加5%亚硝酸钠溶液0.3 mL,摇匀,放置6 min;再各加10%硝酸铝溶液0.3 mL,摇匀,放置6 min;最后各加4%氢氧化钠溶液4 mL,并用60%乙醇稀释至刻度,摇匀,静置15 min;在510 nm处测定吸光度。以芦丁浓度(x)为横坐标、吸光度(y)为纵坐标绘制标准曲线,见图1。拟合线性回归方程为:y=1.6894×10-4+0.013175x;R=0.9999。

图1 芦丁标准曲线
1.2.2.3 样品含量的测定
精密吸取提取液1 mL,置于10 mL容量瓶中,按1.2.2.2方法测定吸光度。总黄酮提取率依下式计算:
1.3 表征
1.3.1 红外光谱分析
取芦丁标准品和草珊瑚总黄酮提取物适量,制样,测定红外光谱。
1.3.2 显色反应
(1)三氯化铁反应:取1 mL提取液于试管中,加1%三氯化铁乙醇溶液数滴,振荡,观察颜色变化。
(2)三氯化铝反应:取提取液点在滤纸上,吹干,滴加1%三氯化铝乙醇溶液,再吹干,观察颜色变化。
(3)氢氧化钠反应:取1 mL提取液于试管中,加4 mol·L-1氢氧化钠溶液数滴,观察颜色变化,静置一段时间,再观察颜色变化。
(4)浓氨水反应:取提取液点在滤纸上,吹干,将滤纸在浓氨水上方熏0.5 min左右,观察颜色变化。
1.3.3 高效液相色谱分析
1.3.3.1 色谱条件
色谱柱采用Agilent Zorbax Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相为甲醇-0.04%磷酸溶液(50∶50,体积比);检测波长280 nm;流速0.8 mL·min-1;进样量5 μL;柱温35℃。
1.3.3.2 样品测定
准确称取0.1018 g芦丁标准品或0.1018 g草珊瑚总黄酮提取物,用甲醇溶解定容至10 mL,用微量进样器吸取5 μL进样分析,记录色谱峰。
2 结果与讨论
2.1 单因素实验
2.1.1 乙醇体积分数对总黄酮提取率的影响
在固液比为1∶20(g∶ mL)、微波功率为320 W的条件下,分别选用30%、40%、50%、60%、70%、80%的乙醇浸泡1 h,微波间歇提取3次,每次30 s。考察乙醇体积分数对草珊瑚总黄酮提取率的影响,结果见图2。

图2 乙醇体积分数对总黄酮提取率的影响
由图2可知,随着乙醇体积分数的增大,总黄酮提取率上升;当乙醇体积分数为60%时,总黄酮提取率最高;但乙醇的体积分数再增大时,总黄酮提取率反而降低。其原因可能与黄酮类化合物的极性有关,提高乙醇体积分数可以增强溶剂对物料的渗透性,加大黄酮类化合物的溶解度。当乙醇体积分数大于60%时,提取液中会带入色素及脂溶性物质,使得提取率降低。另外,微波加热时主要是物料中的极性分子尤其是水分子吸收微波能,产生大量的热量,使物料升温,乙醇体积分数过大会减少料液中水的比例,造成料液升温减慢,从而影响提取率。
2.1.2 微波功率对总黄酮提取率的影响
乙醇体积分数为60%,其它条件不变,考察微波功率对草珊瑚总黄酮提取率的影响,结果见图3。
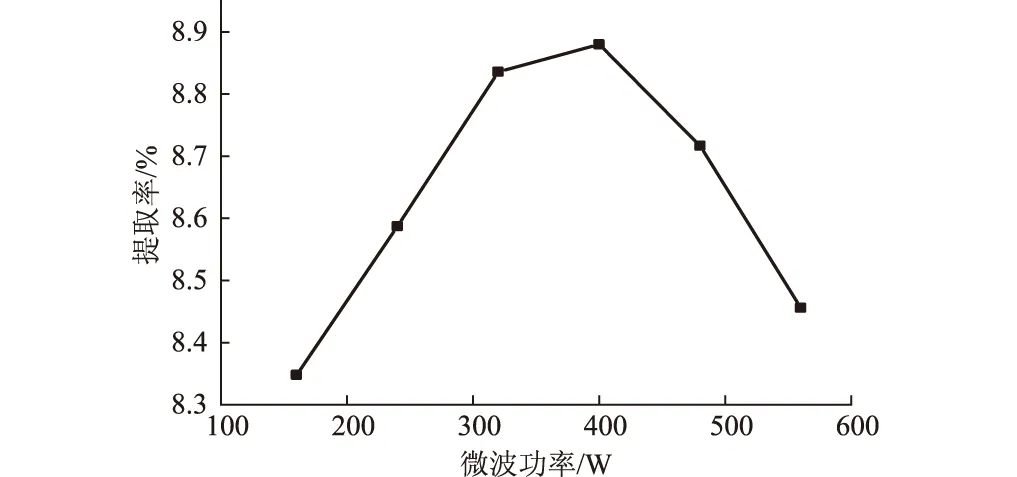
图3 微波功率对总黄酮提取率的影响
由图3可知,当微波功率小于400 W时,总黄酮提取率随微波功率的增大而增大,这是由于微波功率增大,加热效果更好,分子运动加剧,浸出的总黄酮就越多;当微波功率超过400 W后,提取液中总黄酮的含量开始下降,这可能是因为大功率产生的强热效应对提取率造成了影响。
2.1.3 固液比对总黄酮提取率的影响
乙醇体积分数为60%,其它条件不变,考察固液比对草珊瑚总黄酮提取率的影响,结果见图4。

图4 固液比对总黄酮提取率的影响
由图4可知,草珊瑚总黄酮的提取率随固液比的减小相应提高,但当固液比减小到1∶30时,继续增加溶剂的量对总黄酮提取率影响不大。
2.1.4 微波时间对总黄酮提取率的影响
在固液比为1∶20(g∶mL)、乙醇体积分数为60%、微波功率为320 W的条件下,分别选用10 s×3、20 s×3、30 s×3、40 s×3、50 s×3的微波加热时间,考察其对草珊瑚总黄酮提取率的影响,结果见图5。

图5 微波加热时间对总黄酮提取率的影响
由图5可知,随着微波加热时间的延长,总黄酮提取率不断增大,但超过30 s×3后提取率开始下降。这可能是由于短时间的微波作用对细胞膜的破碎作用较大,浸出的总黄酮较多,提取率上升较快;但长时间的微波作用会使提取液温度过高,可能对总黄酮产生破坏。
2.2 正交实验
在单因素实验的基础上,选择乙醇体积分数、微波功率、固液比和微波加热时间作为考察因素,进行L9(34)正交实验,实验因素和水平见表1,结果与分析见表2。

表1 正交实验因素和水平

表2 正交实验结果与分析
由表2可以看出,各因素对微波法提取草珊瑚总黄酮提取率的影响大小依次为:乙醇体积分数>微波加热时间>固液比>微波功率。根据单因素实验和正交实验结果,综合考虑,确定最佳工艺条件为:60%乙醇、固液比1∶40(g∶ mL)、微波功率400 W、微波加热时间30 s、间歇加热3次,此时草珊瑚叶片中总黄酮的提取率为9.394%。
2.3 微波法提取与传统乙醇浸提法比较(表3)

表3 微波提取与传统乙醇浸提法的比较
从表3可以看出,采用微波法提取草珊瑚总黄酮不但提高了提取率,还大幅缩短了提取时间。
2.4 不同生长期的草珊瑚总黄酮提取率比较
分别选取1年生、2年生、3年生的草珊瑚叶片在最佳条件下提取总黄酮,其提取率分别为9.390%、7.929%、6.023%,草珊瑚中总黄酮含量随着草珊瑚生长时间的增长而降低,1年生嫩叶片的含量最高。
2.5 提取物的定性分析
2.5.1 红外光谱(图6)

图6 芦丁标准品(a)和草珊瑚总黄酮(b)的红外光谱图
图6中,3427.38 cm-1处为-OH的伸缩振动吸收峰,峰较强,1619.77 cm-1、1443 cm-1处为苯环的吸收峰。图6a和图6b的特征峰基本相似,说明从草珊瑚中提取的总黄酮的成分与芦丁相似。
2.5.2 显色反应结果(表4)

表4 显色反应鉴定结果
2.5.3 高效液相色谱(图7)

图7 芦丁标准品(a)和草珊瑚总黄酮(b)的高效液相色谱图
由图7可知,草珊瑚样品中的1#峰与芦丁标准品的1#峰保留时间基本一致,可推知1#峰为黄酮类化合物。
3 结论
(1)通过单因素实验和正交实验确定微波法提取草珊瑚总黄酮的最佳条件如下:乙醇体积分数60%、固液比1∶40(g∶mL)、微波功率400 W、微波加热时间30 s、间歇作用3次,此时草珊瑚总黄酮的提取率达到9.394%。
(2)微波法提取与传统乙醇浸提法相比,省时、高效、节能。
(3)草珊瑚中总黄酮含量随着草珊瑚生长时间的增长而降低,1年生嫩叶片的含量最高。
参考文献:
[1] 胡晓茹,许旭东,杨峻山.草珊瑚的研究概况[J].中国药学杂志,2008,43(10):721-723.
[2] 刘爱华,罗永明,林燕华.草珊瑚及同种植物的研究进展[J].中医药通报,2002,1(4):50-53.
[3] Dong Z G,Ma W Y,Huang C S,et al.Inhibition of tumor promoterinduced activator protein 1 activation and cell transformation by tea polyphenols,(-)-epigallocatechin gallate, and theaflavins[J].Cancer Res,1997,57(19):4414-4419.
[4] Yang C S,Chen L,Lee M J,et al.Blood and urine levels of tea catechins after ingestion of different amounts of green tea by human volunteers[J].Cancer Epidemiol Biomarkers Prev,1998,7(4):351-354.
[5] Naasani Imad,Seimiya Hiroyudi,Tsuruo Takashi.Telomerasae inhibition, telomere shortening, and senescence of cancer cells by tea catechins[J].Biochemical and Biophysical Research Communications,1998,249(2):391-396.
[6] 郁建生,罗显华.草珊瑚总黄酮稳定性研究[J].食品科学,2007,28(4):44-47.
[7] 郁建生,郁建平.草珊瑚总黄酮提取工艺及其含量动态变化[J].中国中药杂志,2007,32(4):307-309.
[8] 王浴生,邓文龙,薛春生.中药药理与应用[M].北京:人民卫生出版社,2000:714-718.
[9] 蒋伟哲,孔晓龙,梁钢,等.肿节风片对恶性肿瘤和免疫功能的影响[J].广西医科大学学报,2001,18(1):39-41.
[10] 夏勇,傅剑云,徐彩菊.草珊瑚浸膏的急性毒性和致突变性探讨[J].浙江中医学院学报,1996,20(5):36-37.
[11] 孙建琴,孙晓红.草珊瑚的毒性研究[J].贵州医学院学报,1998,23(1):43-44.
[12] 张岩,曹国杰,张燕,等.黄酮类化合物的提取以及检测方法的研究进展[J].食品研究与开发,2008,29(1):154-158.
[13] 张纪宁,欧阳艳.黄酮类化合物的提取工艺研究进展[J].伊犁师范学院学报(自然科学版),2008,(2):27-30.
[14] 郁建生,李英伦.草珊瑚总黄酮提取工艺比较研究[J].江苏农业科学,2006,(5):136-138.
[15] 陈双,史俊燕,钟洁,等.小麦麸皮中总黄酮微波辅助提取技术研究[J].粮食与饲料工业,2008,(9):26-28.
[16] 李莹,周剑忠,王功,等.超声波和微波联合提取银杏叶黄酮的研究[J].食品科技,2008,33(6):153-155.
[17] 王海宁,谢印芝,樊飞跃,等.微波辅助提取竹叶柴胡总黄酮的正交实验筛选[J].解放军药学学报,2008,24(4):311-313.
[18] 蔡玲,陈晓青,余俊,等.微波法提取水蓼中总黄酮的工艺研究[J].广州化学,2007,32(4):25-29.
[19] 薛长晖.微波法提取党参黄酮的最佳提取工艺研究[J].粮油加工,2008,(11):124-126.
[20] 孟志芬,谷永庆,张伟刚.香椿叶总黄酮的微波提取工艺[J].光谱实验室,2008, 25(6):1095-1098.
[21] 黄敏参,刘剑秋.咸草中总黄酮微波提取的研究[J].福建师范大学学报(自然科学版),2008,24(2):71-74.
[22] 高孟祥,张佳兰,王江明.微波浸提竹叶中黄酮的工艺研究[J].西北农林科技大学学报(自然科学版),2005, 33(7):147-154.
[23] 罗永明,刘爱华,余邦伟,等.中药草珊瑚的化学成分研究[J].中国医药杂志,2005,40(17):1296-1298.
[24] Li Y, Zhang D M, Yu S S, et al.A novel phenylpropanoid-substituted catechin glycoside and a new dihydrochalcone fromSarcandraglabra[J].Chin Chem Let,2006,17(2):207-210.
[25] 张益娜,谢琼,李敏,等.新疆沙棘叶总黄酮的微波辅助提取和鉴定[J].新疆农业科学,2007,44(6):761-764.
[26] 张福娣,李清禄,黄玉梓,等.马尾松针中黄酮类物质的提取研究[J].江西农业大学学报,2006,28(2):249-253.
[27] 宋立华,郑远荣,孙向军,等.超声法提取仙人掌总黄酮工艺条件的研究[J].上海交通大学学报(农业科学版), 2008, 26(1):70-73.
[28] 张廷之,侯镜德,徐秀珠.反相高效液相色谱法测定毛竹叶中总黄酮[J].理化检验·化学分册,2001, 37(3):117-118.
[29] 侯镜德,张廷志,肖军.高效液相色谱法测定苦竹叶中总黄酮[J].宁波高等专科学校学报, 2001, 13(增):89-91.
[30] 徐宝才,丁霄霖.苦荞黄酮的测定方法[J].无锡轻工大学学报,2003,22(2):98-101.
[31] 丁玲,姚丹,谢成国.高效液相色谱法测定二丁颗粒中总黄酮的含量[J].时珍国医国药, 2008, 19(7):1745-1746.
