Ca2+-Lys螯合物的合成与表征
2010-06-04李群,刘飞飞,于岚
钙是人体必需的矿物元素之一,它参与生命体的多种生理活动,被誉为“生命之本”[1,2]。缺钙容易诱发多种疾病,如何合理补钙已成为医药界、营养界和食品界极为关注的热点课题[3,4]。与传统的钙营养强化剂相比,赖氨酸钙的五元环螯合结构[5],使其具有水溶性好、吸收率高、毒副作用小、生物利用度高等优点,在补钙的同时也为机体补充必需氨基酸[6,7],因而是一种理想的钙源[8,9],可用作食品添加剂和营养强化剂,有治疗和营养的双重功效。
作者在此以L-赖氨酸盐酸盐(L-Lys)和氢氧化钙为原料合成了L-赖氨酸钙螯合物,通过正交实验研究了螯合物的最佳合成工艺,并通过元素分析、红外光谱分析、X-射线粉末衍射分析等对其结构进行了表征。
1 实验
1.1 试剂与仪器
L-赖氨酸盐酸盐,分析纯,晋州冀荣氨基酸有限公司;氢氧化钙,分析纯,上海埃彼化学试剂有限公司;EDTA,分析纯,青岛合力兴化玻有限公司;无水乙醇(质量分数为99.7%);实验用水为二次蒸馏水;其它试剂均为分析纯。
DK-98-1型恒温水浴锅、DZ-1A型真空干燥箱,天津市泰斯特仪器有限公司;RE-52A型旋转蒸发器、SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂;JB300-S型数字显示转速电动搅拌机、WRS-1B型数字显示熔点仪,上海精密科学仪器有限公司;AVATAR 360型FTIR,美国 Thermo Nicolet;PE-2400型元素分析仪;Bruker/Axs D8 Advance型X-射线粉末衍射仪。
1.2 L-赖氨酸钙的合成
准确称取3.6538 g(0.02 mol)L-赖氨酸盐酸盐溶解在20 mL去离子水中,分批加入0.7409 g(0.01 mol)氢氧化钙,在70℃水浴中搅拌反应2.5 h,趁热过滤,得无色澄清滤液。将滤液减压蒸馏直至有白色固体析出;冷却静置,有大量白色固体析出;过滤,用无水乙醇反复洗涤滤饼,抽滤,至滤液与茚三酮试剂不显蓝紫色为止;将白色固体低温烘干后,称重,得产物3.305 g,产率90.18%。于真空干燥器中保存。
L-赖氨酸钙螯合物为白色粉末,易溶于水,水溶液呈微弱碱性,不溶于乙醇、丙酮等有机溶剂,m.p.为227.6~227.9℃。
1.3 合成条件正交实验
以产率为指标,通过L9(33)正交实验研究原料配比(L-赖氨酸盐酸盐与氢氧化钙的摩尔比,下同)、反应温度、反应时间对螯合反应的影响,确定最佳螯合工艺条件。
2 结果与讨论
2.1 最佳合成条件的确定
采用3因素3水平正交实验确定最佳合成条件,结果与分析见表1。
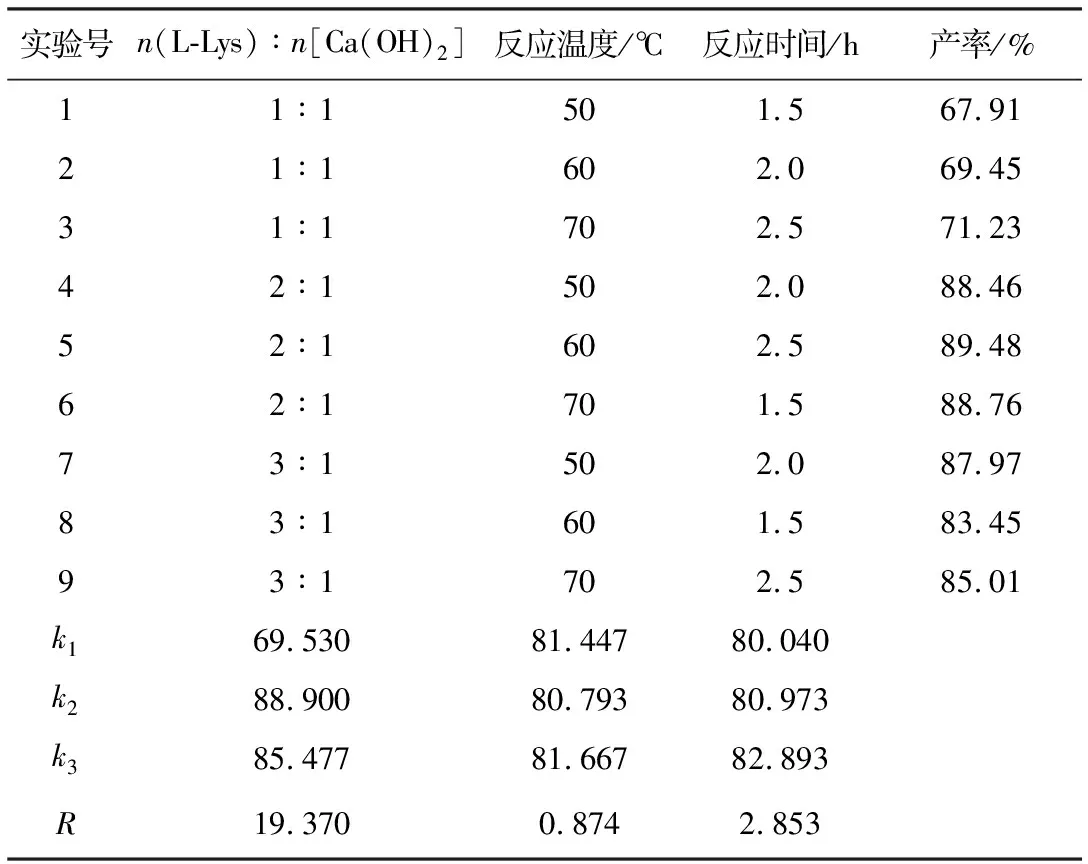
表1 正交实验结果与分析
从表1可知,原料配比、反应温度、反应时间3个因素对L-赖氨酸钙螯合物产率影响的主次顺序为:原料配比>反应时间>反应温度。合成螯合物的最佳工艺条件为:n(L-Lys)∶n[Ca(OH)2]=2∶1、反应温度70℃、反应时间2.5 h。原料配比是影响螯合反应的关键因素,若原料配比过低(L-赖氨酸盐酸盐用量过少),所形成螯合物的结构复杂且稳定性较低;若原料配比过高(L-赖氨酸盐酸盐用量过多),则造成L-赖氨酸资源的浪费[10]。
2.2 重现性实验
重现性是指在不同的实验室不同分析人员测定结果的精密度。精密度一般用相对标准偏差(RSD)表示:
在最佳工艺条件下进行3次重复实验,结果见表2。

表2 重复性实验结果
根据公式及表2数据可得:
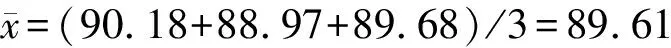
标准偏差s={[(90.18-89.61)2+(88.97-89.61)2+(89.68-89.61)2]/2}1/2=0.7798
由此可以表明,正交实验优化后的合成工艺,条件稳定且具有良好的重现性。
2.3 元素分析和分子组成推测
利用PE-2400型元素分析仪得到螯合物的元素含量。实测值(理论值,%):C 39.47(39.32),H 8.70(8.25),N 15.25(15.29);通过EDTA络合滴定法[11]测定了螯合物中钙离子含量(理论值,%):Ca 11.72(10.94)。测定结果表明,各元素的含量与带两分子结晶水的分子组成非常吻合,由此推测L-赖氨酸钙螯合物可能的分子组成为Ca[NH2(CH2)4CHNH2COO]2·2H2O。
2.4 红外光谱分析
用KBr压片法测定L-赖氨酸和L-赖氨酸钙在400~4000 cm-1的红外光谱,如图1所示。

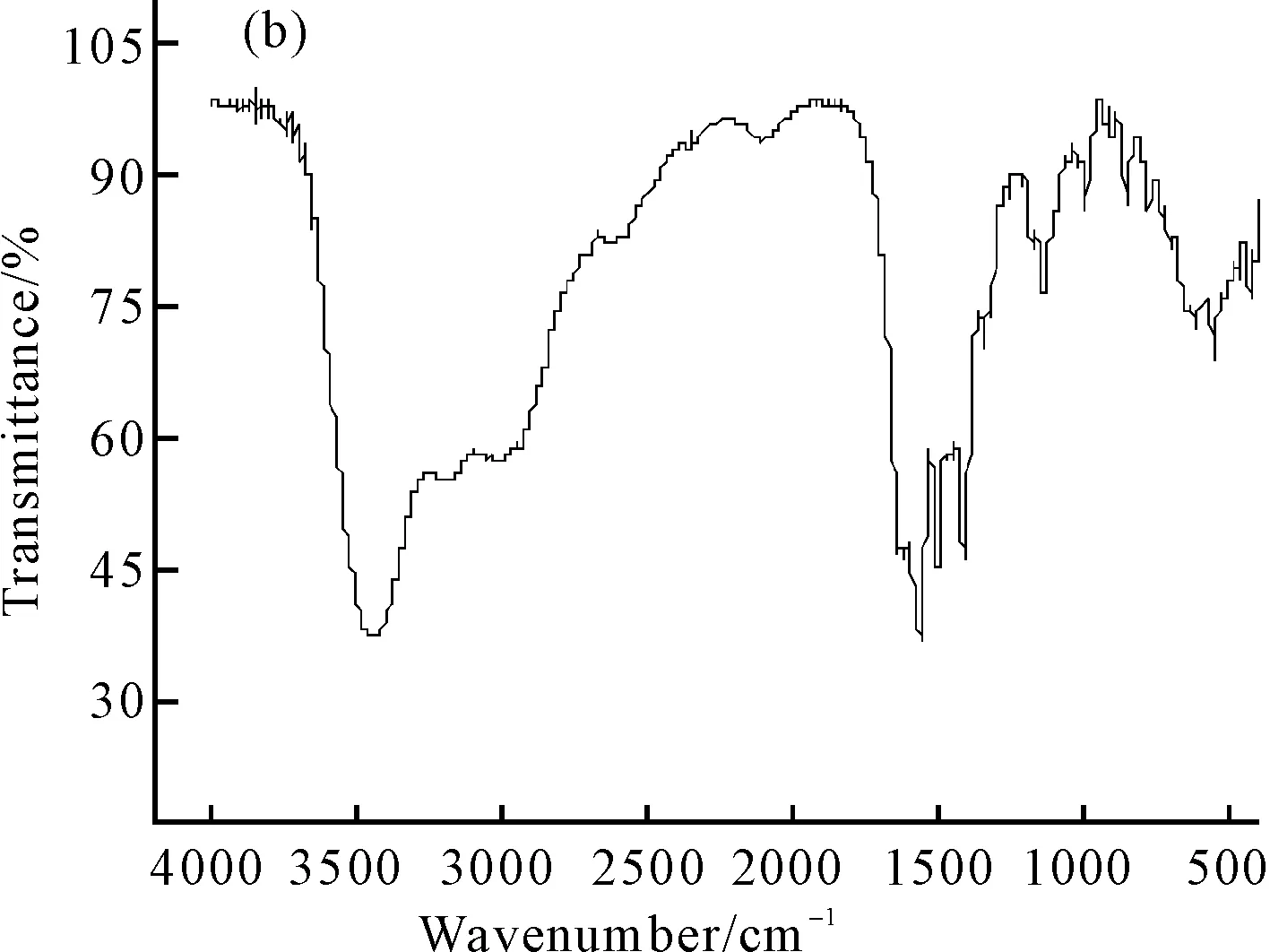
图1 L-赖氨酸(a)和L-赖氨酸钙(b)的红外光谱
由图1可知,L-赖氨酸与钙离子形成螯合物后,其主要吸收峰同配体相比发生了明显位移,相对强度也有所改变。L-赖氨酸在3166.86 cm-1处的ν(N-H)吸收峰在形成螯合物后移至3449.53 cm-1处;3449.53 cm-1和3189.84 cm-1处分别对应于νas(N-H)和νs(N-H)的伸缩振动吸收峰,表明α-氨基的N原子参与了配位;1567.39 cm-1和1407.77 cm-1处分别是羧酸根反对称伸缩振动νas(COO-)吸收峰和羧酸根对称伸缩振动νs(COO-)吸收峰;出现在538.18 cm-1和395.23 cm-1处的新振动吸收峰[12],说明L-赖氨酸与金属离子形成了Ca-N和Ca-O键,进一步表明了L-赖氨酸钙的形成;3400 cm-1处的宽吸收峰表明螯合物中有水分子存在。
2.5 X-射线粉末衍射分析
采用高强度Cuκα射线(λ=0.1540562 nm),扫描速度0.2°·s-1,测定L-赖氨酸和L-赖氨酸钙的X-射线粉末衍射图谱,于室温下收集3°~50°(2θ)衍射数据,结果见图2。

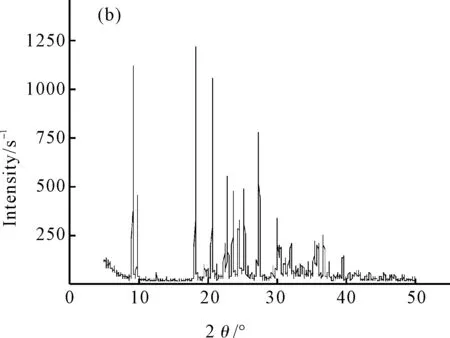
图2 L-赖氨酸(a)和L-赖氨酸钙(b)的X-射线粉末衍射图谱
从图2可知,L-赖氨酸与钙离子螯合后,其X-射线粉末衍射的主要吸收峰位置(2θ)和相对强度(I/I0)均发生了改变。在螯合物中,配体L-赖氨酸在2θ为20.58°和18.10°的主强峰和次强峰消失,而在18.14°和9.03°处分别出现了新的主强峰和次强峰,由此可以表明新螯合物L-赖氨酸钙的形成。
3 结论
以L-赖氨酸盐酸盐和氢氧化钙为原料合成了L-赖氨酸钙螯合物。采用正交实验得到了L-赖氨酸钙的最佳合成工艺为:n(L-Lys)∶n[Ca(OH)2]=2∶1、反应温度70℃、反应时间2.5 h,此时螯合物的产率可达90.18%;并通过元素分析、红外光谱分析、X-射线粉末衍射分析等对产品结构进行了表征,推测出L-赖氨酸钙螯合物可能的分子组成为Ca[NH2(CH2)4CHNH2COO]2·2H2O。
参考文献:
[1] 鲍建民.钙的生理功能及吸收利用[J].微量元素与健康研究,2006,23(4):65-66.
[2] Bronner F. Current concepts of calcium absorption:An overview[J].J Nutr,1992,122(S3):641-643.
[3] 段惠敏,李淑芳,郭光美,等.补钙与钙营养强化剂CCM[J].食品科技,2002,(1):64-65.
[4] Bronner F, Pansu D.Nutritional aspects of calcium absorption[J].J Nutr,1999,129(1):9-12.
[5] 张红漫,陈国松,仪明君,等.复合氨基酸铜螯合物的研究[J].氨基酸和生物资源,2002,24(2):37-40.
[6] Datta D, Bhinge A, Chandran V. Lysine: Is it worth more?[J].Cytotechnology,2001,36(1-3):3-32.
[7] Ward T L, Asche G L, Pollmann D S. Organic trace minerals examined in starter diets[J].Feedstuffs,1997,69(21):13-15.
[8] 王俊,程薇,文莉,等.复合氨基酸螯合钙对大鼠生物利用率的研究[J].湖北农业科学,2008,47(12):1492-1494.
[9] 戎舜城.天门冬氨酸钙合成的研究[J].中国食品添加剂,2003,(3):42-44.
[10] 张祥麟.络合物化学[M].北京:冶金工业出版社,1979:166-168.
[11] 钟国清.甘氨酸钙螯合物的微波固相合成与表征[J].合成化学,2004,12(6):591-594.
[12] Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds(4th ed)[M]. New York: Wiley Sons,1986:287.
