白色念珠菌14α-去甲基化酶基因点突变的研究
2010-05-31肖向梅
肖向梅
随着现代医学的不断发展, 糖皮质激素、免疫抑制剂、化疗放疗、器官移植、各种导管和插管技术的应用, 特别是抗生素的滥用和社会老龄化,白色念珠菌作为一种条件致病菌, 其感染率逐年上升[1-2]。为探讨白色念珠菌耐药机制, 我们对从临床感染患者中分离的耐氟康唑(FLC)和伊曲康唑(ITC)的白色念珠菌扩增编码羊毛甾醇14α-去甲基化酶(CYP51)基因,并将扩增序列与参考序列进行比对和分析,以了解白色念珠菌的耐药机制。
1 材料与方法
1.1 白色念珠菌耐药株的筛选和鉴定 经CHROMagar念珠菌显色培养基(CHROMagar公司,法国)初筛,API20C Aux酵母菌鉴定系统(bioMérieux公司,法国)和45℃生长实验,鉴定为白色念珠菌。纸片扩散法初筛白色念珠菌耐药株,然后按NCCLS推荐的微量稀释法(M-27A)测定白色念珠菌对氟康唑(FLC)、伊曲康唑(ITC)的MIC。分离到两株白色念珠菌耐药株(FLC≥64μg/ml、ITC≥16μg/ml), 均未并发呼吸道感染的重症患者(2007H和2007T株)。
1.2 引物的设计与合成 根据Genbank X13296序列,利用DNA star软件辅助设计三对PCR引物,分别从N、C端和中间,扩增羊毛甾醇14α-去甲基化酶(14DM)的编码基因,并使三个引物扩增片段相互重叠,保证序列的准确性。引物由上海生物工程技术公司合成。引物序列及其相应的位置、扩增片段大小,如表1所示。
1.3 主要实验试剂和仪器 美国PERKIN公司DNA扩增仪;法国Gilson公司各型号移液器;PCR试剂,DNA纯化试剂盒购自promega公司;PCR marker DL2000购自Takara公司。其它化学试剂为进口或国产分析纯试剂。
1.4 白色念珠菌DNA的提取和扩增及产物的纯化 白色念珠菌DNA提取采用Promega DNA提取试剂盒,按说明进行。三对PCR引物,分别从N、C端和中间扩增CYP51基因。取上述DNA2μl,在25μl反应体系中扩增。扩增参数:95℃复性5min;95℃1min,53℃60sec,72℃60sec,30个循环;72℃5min。目的基因的纯化按Wizard DNA clean up试剂盒说明书操作,送上海生物工程公司的测序分析。
2 结果
2.1 CYP51基因的PCR扩增 理论上N、C端和中间PCR扩增产物长度分别为510bp、890bp和1200bp,同DNA标准分子量参照物相比较,目的基因的PCR扩增产物大小与预期结果相一致。
2.2 PCR扩增产物序列分析 利用DNAstar软件,将扩增序列与白色念珠菌参考序列(Accession No: X 12396)进行对比和分析。经比较,耐药株存在有意义突变和无意义突变,详见表2。
3 讨论
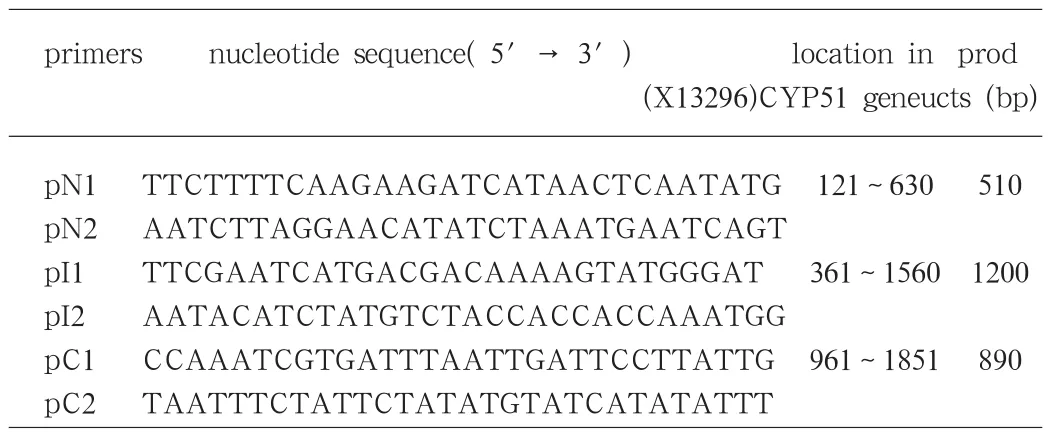
表1 引物序列及其在白色念珠菌CYP51基因中的位置
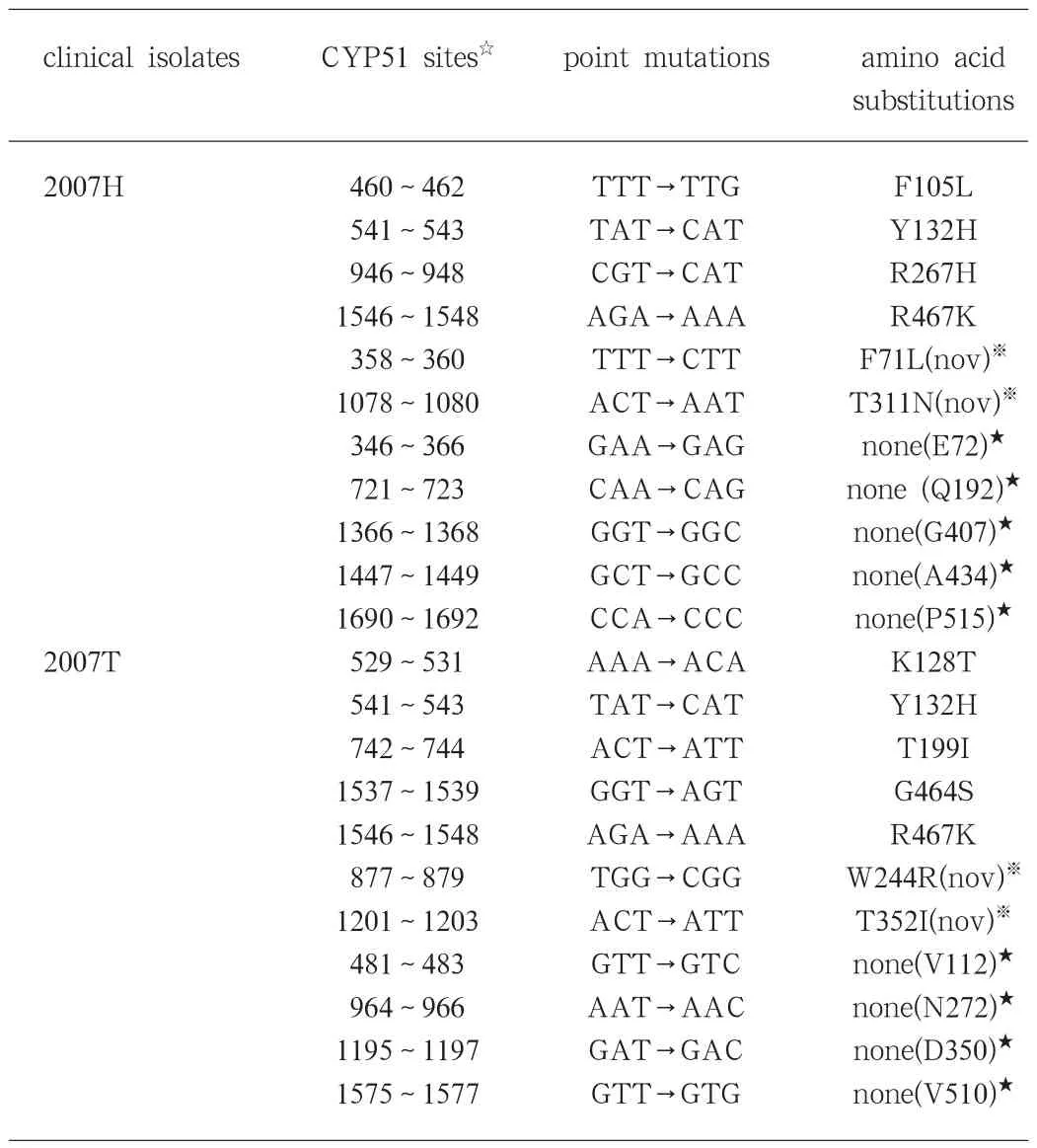
表2 白色念珠菌唑类耐药株CYP51基因突变点及对应的氨基酸变化
CYP51是白色念珠菌羊毛甾醇14α-去甲基化酶(14DM)的编码基因,大小为1851bp,起始密码子是位于第148~150bp的ATG,终止密码子是位于第1732~1734bp的TAA。14DM由528个氨基酸构成,含有A-M共13个α螺旋和数个β片层以及螺旋结构。血红素被束缚于蛋白中央,夹在I螺旋和L螺旋之间。活性位点在血红素远端,深埋于蛋白内部,底物需通过较长的底物进出通道才能到达。唑类抗真菌药物分子可经此通道与14DM结合,阻断羊毛固醇去甲基化过程,影响麦角固醇合成。作为唑类抗真菌药的靶酶, 14DM可以介导药物的毒性作用, 而其变化也能削弱药物的作用。当CYP51点突变影响到14DM空间构型时,就可能降低酶与药物分子间的亲和力,导致菌株耐药[3-4]。
本研究中两个耐药株共有22个碱基突变。突变发生氨基酸替换,与以往报道的相同的有F105L、K128T、Y132H、T199I、R267H、G464S和G467K。其中,Y132H和G467K突变两株菌都存在。Sanglard等[5]最早证实Y132H与耐药表型相关。 Kakeya等[6-7]进一步指出具有双复制的Y132H (等位基因纯合)才可致耐药。Y132H常与其他突变同时出现,当Y132H与S405F或R467K同时出现时,菌株的MIC比单独表达上升更多[5]。这种协同作用在研究I471T时也得到证实: I471T单独表达时可产生耐药, Y132H与之同时表达可加强这一作用[6-7]。研究者分别通过在酿酒酵母中表达带有突变的14DM,证实G464S和R467K[5]可以导致菌株耐药。F105L位于底物/药物通道入口附近,可能影响药物分子的进入[7]。F71L,W244R,T311N 和T352I为本研究新发现的突变,未见报道,它在耐药机制中的作用需进一步探讨。总之,白色念珠菌耐药的形成是多位点突变,是多步骤、复杂的,不同菌株对相同或不同药物产生耐药的机制也不同,有时可能是多机制共同作用的结果。
分离的两株白色念珠菌耐药株, 均来并发呼吸道感染的老年重症患者(2007H和2007T株),都有长期应用抗生素和氟康唑抗真菌药物史,反复患有细菌和念珠菌感染。因此,合理应用抗生素,加强真菌感染的预防和控制,进行深部真菌感染的流行病学研究,深入探讨真菌的耐药机制已刻不容缓。
[1]陆慧君,贺文琦,邓旭明等.白色念珠菌DNA指纹图谱分析及其在临床耐药检测中的应用[J].中国实验诊断学,2007,11(12):1606.
[2]董海新;李晓哲.医院内念珠菌感染及耐药性分析[J].中国实验诊断学,2007,11(11):1476.
[3]Wang YB,Wang H,Guo HY,et al.Analysis of ERG11 gene mutation in Candida albicans.[J]Di Yi Jun Yi Da Xue Xue Bao,2005,25(11):1390.
[4]Podust LM,Poulos TL,Waterman MR.Crystal structure of cytochrome P450 14α2sterol demethylase(CYP51)from Mycobacterium tuberculosis in complex with azole inhibitors[J].Proc Natl Acad SciUSA,2001,98(6):3068.
[5]Sanglard D,Ischer F,Koymans L,et al.Amino acid substitutions in the cytochrome P450 lanosterol 14alpha-demethylase(CYP51A1)from azoleresistant Cand ida albicans clinical isolates contribute to resistance to azole antifungal agents[J].Antimicrob Agents Chemother,1998,42(2):241.
[6]Kakeya H,Miyazaki Y,Miyazaki H,et al.Genetic analysis of azole resistance in the Darlington strain of Cand ida albicans.Antimicrob Agents Chemother,2000,44(11):2985
[7]Kakeya H,Miyazaki T,Miyazaki Y,et al.Azole resistance in Cand ida spp[J].Nippon Ishinkin Gakkai Zasshi,2003,44(2):872.
