心脏转录因子Nkx2.5真核表达质粒的构建
2010-05-29丁建东李开如姚玉宇陶绍玉马根山
方 翔,丁建东,李开如,姚玉宇,陶绍玉,王 点,马根山
(1.东南大学附属中大医院心内科,江苏南京,210009;2.安徽医科大学滁州临床学院,安徽滁州,239000)
心脏的发育过程是在多种转录因子组成的复合物的作用下进行转录调节的。这些复合物包括了超过20种不同的转录因子,研究最多的有Nkx2.5、GATA-4、MEF-2,t-box 等转录因子[1]。其中Nkx2.5是影响心脏发育的关键性转录因子之一。Nkx2.5特异性表达于心房、心室、肌小梁等处的心肌组织[2],在心脏发育和保持出生后心脏稳态,特别是心脏功能成熟以及工作心肌和心脏传导的功能维持等方面起到非常重要的作用。
本课题组在前期研究中首次在国人散发性先天性心脏病患者中发现其Nkx2.5基因外显子1的第239位发生了A-G的突变,等位基因的突变频率在先心病患者与正常人之间差异有统计学意义[3]。为了深入研究转录因子Nkx2.5在先天性心脏病发病过程中的作用,本研究构建含有Nkx2.5的真核表达载体,并将此重组质粒转染入心肌细胞,观察细胞形态学和生物学行为的改变,为后续的研究奠定一定的基础。现就此质粒构建方法报道如下。
1 材料与方法
1.1 主要材料
限制性内切酶、T4 DNA连接酶、T4 DNA连接酶Buffer购自Takara公司;超纯质粒DNA纯化试剂盒购自Vitagene公司;柱离心式胶回收试剂盒购自Promega公司;溴化乙锭(EB)购自上海生工生物工程公司;质粒pCMV6-XL5-Nkx2.5和pCMV-HA载体购自长沙赢润生物技术有限公司;大肠杆菌DH5-α由本研究所保存。
1.2 方法
1.2.1 引物设计:参照 Nkx2.5基因序列(Genebank NO.NC_000005.9)的编码区,利用Primer3软件设计上游引物和下游引物,上游引物引入EcoRⅠ酶切位点,下游引物引入XholⅠ酶切位点,且使其读码框与pCMV-HA多克隆位点读码框一致,由上海生工公司合成。上游引物:5′-CCGGAATTCCGATGTTCCCCAGCCCTGCTC-3,(下划线为EcoRⅠ位点),下游引物:5′-CCG CTCGAG CTACCAGGCTCGGATACCATG-3'(下划线为XholⅠ位点)。
1.2.2 PCR扩增目的基因:以质粒pCMV6-XL5-Nkx2.5为模板,扩增Nkx2.5编码区序列。反应体系为:Taq 酶 0.5 μ L,10×Taq Buffer(含MgCl2)5 μ L,dNTP 2 μ L,Template 2 μ L, 上游引物 1 μ L, 下游引物 1 μ L,dd H2O 38.5 μ L, 共计50 μ L。扩增条件:94℃预变性2 min;94℃30 s,60℃40 s,72℃1 min;72℃10 min,共计30个循环。
1.2.3 PCR产物胶的回收、连接及转化:将PCR的产物进行2%琼脂糖凝胶电泳,胶回收目的基因的DNA片段,回收产物经EcoRⅠ和XholⅠ双酶切,与同样经过 EcoRⅠ和 XholⅠ双酶切的pCMV-HA载体以T4连接酶16℃连接过夜,连接产物转化DH5α感受态大肠杆菌,接种LB平板(AMP 100 mg/L),37℃培养过夜,挑选几个较大的周围没有杂菌的白色菌落,接种于液体LB培养基(AMP 100 mg/L),37℃、160 r/min振荡过夜。超纯质粒DNA纯化试剂盒提取质粒,利用PCR及限制性内切酶EcoRⅠ和XholⅠ双酶切后送上海上海英俊生物公司测序。
2 结 果
2.1 引物设计
成功的设计出上下游引物,扩增出目的基因。通常PCR引物的长度为18~25个碱基,GC含量应在40%~60%,碱基C和G在整个引物中应均匀分布。应避免在引物的3′末端超过3个C或G,因为这样有可能增加非特异性引物。同时在两端可以设计不同的两个限制酶酶切位点(克隆载体上也应有相应的酶切位点),这样除了可以定向插入之外,还具有无外源DNA片段插入的线性载体分子自身再连接问题。
2.2 PCR扩增Nkx2.5基因片段
将Nkx2.5片段的PCR产物进行琼脂糖凝胶电泳,在GIS凝胶系统中检测,出现Nkx2.5片段的条带(约1 kb),结果见图1,PCR扩增出的片段大小与Nkx2.5片段的理论大小一致,胶回收约1 kb大小片段(图1)。
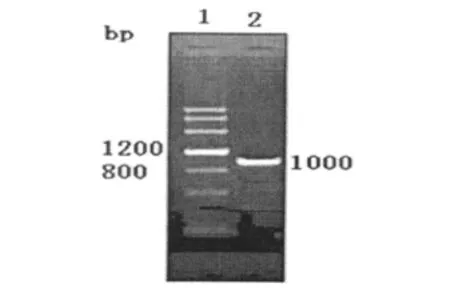
图1 Nkx 2.5的PCR产物电泳图
2.3 Nkx2.5基因片段克隆至pCMV-HA载体
将Nkx2.5基因克隆至pCMV-HA载体,阳性克隆经酶切鉴定,切出约3.8kb的载体带和约1kb的片段(图2),初步推测Nkx2.5已经克隆到pCMV-HA载体。将阳性克隆送上海生工公司测序。测序结果表明,pCMV-HA-Nkx2.5构建正确。
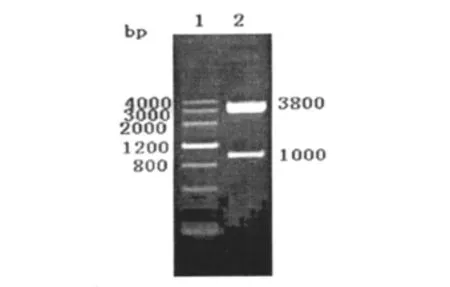
图2 重组质粒pCMV-Ha-Nkx2.5的酶切鉴定电泳图
3 讨 论
人类Nkx2.5基因,亦称心脏特异性同源盒基因(cardiac specific homebox,CSX),是一类同源盒转录因子,它位于人类染色体5q34-35,总长度为 3125bp,有2个外显子,cDNA全长 1015 bp,编码含324个氨基酸的蛋白质,是NK型同源盒基因家族中NK2型成员之一。人类Nkx2.5基因蛋白同源结构域HD含有高度保守的60个氨基酸残基,是与 DNA结合的必需结构[4]。Nkx2.5在心脏前体细胞的分化、心脏的环化、房室分隔、房室流出道和传导系统形成以及成熟心脏正常功能的维持中起到重要的调节作用[5]。Nkx2.5是胚胎发育过程中的早期标志之一,在胚胎发育的7.5天即表达于心脏中胚层[6]。在心脏发育过程中,Nkx2.5最初见于心脏头褶期心肌源性前体细胞,持续表达于心肌细胞分化阶段,随后在胚胎、胎儿和成体心肌细胞中保持一定的表达水平。该基因一旦发生突变可引起先天畸形,如房间隔缺损(atrial septal defect,ASD)、室间隔缺损(ventricular septal defect,VSD)、动脉导管未闭(patent ductus arteriosus,PDA)、肺动脉瓣狭窄(pulmonary stenosis,PS)等。
研究证实Nkx2.5在心脏发育过程参与心房利钠肽(atrial natriuretic peptide,ANP)、脑利钠肽(brain natriuretic peptide,BNP)、肌细胞增强因子(myocyte enhancer factor,MEF)等基因的表达,ANP和MEF2能促进心脏发育时心肌细胞调亡,Nkx2.5基因突变后能上调这些调亡基因高表达,使发育的心肌细胞过度调亡,导致先天性心脏病[7]。Nkx2.5在心脏发育过程中与其他转录因子如 GATA-4、SRF 、Tbx-5、Tbx-2 、dHAND/HAND2等相互作用而调节心脏的发育[8]。小鼠的Nkx2.5基因启动子包含两个GATA结合域,其与GATA结合后对于胚胎形成早期的心脏、咽和脾的发育是必需的[9]。许多研究表明,GATA-4和Nkx2.5在蛋白质水平相互作用调节ANP、骨形态发生蛋白(Bone mrphogenic protein,BMP)和心脏限制性锚蛋白复制蛋白等启动子的表达[10]。
本研究首先以质粒pCMV6-XL5-Nkx2.5为模板,设计上下游引物成功扩增出Nkx2.5的编码序列,经双酶切后与真核表达载体pCMV-HA连接,经PCR、双酶切及测序鉴定,表明本实验成功构建了重组真核表达质粒pCMV-HA-Nkx2.5。在后续的研究中,将重组质粒转染到小鼠心肌细胞中,观察心肌细胞形态学和生物学行为的改变。目前国内还没有成功构建Nkx2.5重组表达质粒的报道,本实验为进一步研究转录因子Nkx2.5在心脏发育以及先天性心脏病的发生过程中的作用奠定基础。
[1]Wang Y,Morishima M,Zheng M,et al.Transcription factors Csx/Nkx2.5 and GATA4 distinctly regulate expression of Ca2+channels in neonatal rat heart[J].J Mol Cell Cardiol,2007,42(6):1045.
[2]汪 剑,卓莉莉,姜之文,等.CSX/Nkx2.5基因在大鼠胚胎心脏发育过程中的表达[J].南京医科大学学报(自然科学版),2008,28(5):605.
[3]丁建东,李开如,张晓黎,等.转录因子Nkx2.5基因突变与先天性心脏病相关性的初步研究[J].中华医学杂志,2009,89(16):1114.
[4]Vincentz J W,Barnes R M,Firulli B A,et al.Cooperative interaction of Nkx2.5 and Mef2c transcription factors during heart development[J].Dev Dyn,2008,237(12):3809.
[5]方 翔,丁建东.转录因子Nkx2.5与GATA-4在心脏发育中的作用[J].医学综述,2009,15(22):3366.
[6]Raffin M,Leong L M,Rones M S,et al.Subdivision of the cardiac Nkx2.5 expression domain into myogenic and nonmyo2genic compartments[J].Dev Biol,2000,218(2):362.
[7]Zhu W,Shiojima I,Hiroi Y,et al.Functional analyses of three Csx/Nkx2.5 mutations that cause human congential heart disease[J].J Biol Chem,2006,275(45):35291.
[8]Akazawa H,Komuro I.Cardiac transcription factor Csx/Nkx2-5:Its role in cardiac development and diseases[J].Pharmacol Ther,2005,107(2):252.
[9]Lien C L,Wu C,Mercer B,et al.Control of early cardiacspecific transcription of Nkx2-5 by a GATA-dependent enhancer[J].Development,1999,126(1):75.
[10]McBride K,Nemer M.Regulation of the ANF and BNP promoters by GATA factors:lessons learned for cardiac transcription[J].Can J Physiol Pharmacol,2001,79(8):673.
