腺病毒载体转导绿荧光蛋白表达在海马神经元树突量化分析中的应用
2010-05-28叶银萍徐晓虹罗清清
叶银萍, 徐晓虹, 李 涛, 罗清清
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江师范大学 生态研究所,浙江 金华 321004)
在脊椎动物的脑结构中,作为潜在记忆库的海马是一个重要的脑区,与学习记忆密切相关[1].海马结构的发育形态学基础决定其机能活动,依据细胞构筑的不同,海马可分为 CA1,CA2和CA3共3个区.海马神经元轴突和树突的生长及突触联系决定了海马的功能,而神经元的功能与其形态密不可分.研究发现,海马锥体神经元顶树突的分支复杂程度在接受传入信息过程中起着重要作用,基树突影响反馈回路的形成,而轴突则决定传出信息的范围和广度[2-3].发育早期的神经元(约出生后1周)树突树逐渐发育成熟,树突干上具有众多树突生长锥和树突丝,它们活跃地伸缩运动,与轴突相接触并逐渐形成突触[4-5].2~3周后,树突丝逐渐被粗短而稳定的树突棘取代,同时形成大量的兴奋性突触,其主要解剖学位置位于树突棘[6-7].传统的固定染色的形态学观测技术限制了神经元形态的动态研究.目前,对海马神经元发育过程的形态学动态变化的研究仍然较少.本实验构建了表达绿色荧光蛋白的腺病毒(Ad-EGFP),用于感染体外培养的大鼠海马神经元,结合活细胞成像法,清楚地显现树突及突起的形态学细节,以达到量化分析神经元形态动态发育的目的.
1 材料和方法
1.1 试剂
细胞培养相关试剂:Neurobasal TM Medium,B27添加剂(Invitrogen),DMEM高糖培养基(Gibco),胰蛋白酶(Amresco),多聚赖氨酸(sigma),优级胎牛血清(FBS.杭州四季清),L-谷氨酰胺(Amresco),青霉素,链霉素(Amresco).其他试剂为国产分析纯.
包装腺病毒相关试剂:腺病毒穿梭质粒pAdtrackcmv,骨架质粒pAdEasy-1(由美国Johns Hopkins肿瘤研究中心Belt Vogelstein博士惠赠),限制性内切酶Pme I,Pac I(NEB),BJ5183菌,Lipofectin 2000(Invitrogen),Promega质粒小量提取试剂盒(Promega),胰蛋白胨,酵母提取物(Amresco).
实验动物:新生24 h内的健康SD大鼠乳鼠.成年SD大鼠购自浙江省实验动物中心.
1.2 构建表达绿色荧光蛋白的病毒
表达绿色荧光蛋白腺病毒质粒的构建:用Pme I酶切1 μg pAdtrackcmv质粒使其线性化,然后与100 ng腺病毒骨架质pAdEasy-1共同电转化(2.5 kV,200 Ω,25 μF)20 μL的 BJ5183感受态菌.取30 μL菌液涂于含25 μg/mL卡那霉素的LB平板上,20 h后挑选小克隆菌团,37 ℃培养过夜,小量提取质粒电泳初步判断重组体后,再经Pac I酶切鉴定正确重组的pAd-EGFP腺病毒质粒.
原代病毒的制备:按照Promega试剂盒说明书提取重组的质粒.当生长于25 cm2培养瓶中的293A细胞汇合率达90%时,按照Lipofectine 2000的说明书,取4 μg经Pac I线性化的pAd-EGFP质粒转染293A细胞.转染后2 d在荧光显微镜下观察绿色荧光蛋白的表达.感染7~9 d后收集细胞,液氮反复冻融细胞3次,离心取上清液,再次感染2瓶接种于75 cm2培养瓶的293A细胞并收集病毒液,重复2~3次以得到高滴度病毒.
病毒滴度计算:取10 μL病毒液,1∶10倍稀释后感染293A细胞,感染后24 h在荧光显微镜下记录各稀释度病毒感染细胞后发荧光的细胞数,按公式
病毒滴度=发荧光细胞数×稀释度/病毒液体积
计算病毒滴度.病毒液中加入10%的甘油并保存于-80 ℃冰箱中.
1.3 大鼠海马神经元离体培养及鉴定
参照文献[8],取出生24 h内的SD仔鼠的大脑,分离出海马组织,去脑膜,剪碎加入0.125%的胰蛋白酶,消化15 min并用抛光过的小开口滴管反复吹打制成细胞悬液.用种植液(含10% FBS,3 g/LL-谷氨酰胺和100 mg/L双抗的DMEM高糖培养液)稀释细胞并接种于预先涂有多聚赖氨酸(0.1 mg/mL)的小玻片上,细胞密度(1~2)×104/cm2,每个直径35 mm培养皿中约10片小玻片,培养于37 ℃的CO2培养箱中,4~5 h后每个培养皿补加2 mL种植液,24 h后用培养液(含2% B27添加剂,3 g/LL-谷氨酰胺和100 mg/L双抗的Neurobasal培养基)全量换液,之后每隔3 d半量换液.
采用烯醇化酶(NSE)免疫染色法测定体外培养第7天的海马神经的纯度.取培养第7天的海马神经元,磷酸盐缓冲液(PBS)洗涤3遍,4%多聚甲醛液固定10 min,3%H2O2溶液去除内源性过氧化物酶活性,0.1% Triton X-100溶液破膜,滴加正常山羊血清工作液封闭10 min,然后加入兔抗鼠NSE抗体(1∶200),37 ℃孵育4 h,PBS洗涤3次,加入生物素化二抗(山羊抗兔IgG),37 ℃孵育15 min,PBS洗涤3次,滴加过氧化物酶复合物溶液37 ℃孵育15 min,PBS洗涤,滴加3,3-二氨基苯联胺(DAB)显色液显色15 min,自来水冲洗后封片.光镜下观察NSE表达阳性细胞.
1.4 腺病毒(Ad-EGFP)感染海马神经元
体外培养第5天的大鼠海马神经元,每个培养皿(培养液2 mL)加入4 μL腺病毒(Ad-EGFP),十字型缓慢摇匀,6 h后全量换液,感染48 h后观察绿色荧光蛋白(GFP)的表达[9].0.4%台盼蓝溶液检测腺病毒感染48 h后神经元的存活率.

1.5 活细胞成像与定量分析
对体外培养第7天的海马神经元(感染后48 h)进行成像时,用倒置荧光显微镜的40倍物镜,每隔2 min对同一视野下的神经元进行成像,11张照片为1组,叠加后可动态观察树突的发育.根据形态学分类,把树突干上长度为2~10 μm具有指状尖端的突起定义为树突丝.挑选形态健康的海马神经元手工描绘所有树突丝,用Image-pro Plus 5.0测量随机选取的10段树突丝的长度,将每2张照片的树突丝长度之差的绝对值相加,表示单个细胞样品树突丝的变化值.树突丝的运动性用20 min内树突丝长度变化总值的平均值表示,单位为μm.用每100 μm树突干上树突丝的平均数目定义树突丝的密度.测量所有树突分支的长度,计算树突分支的总长度.计数样本来自3个不同批次培养的神经元,每批次选取6~8个转染细胞,约测量100个树突丝.
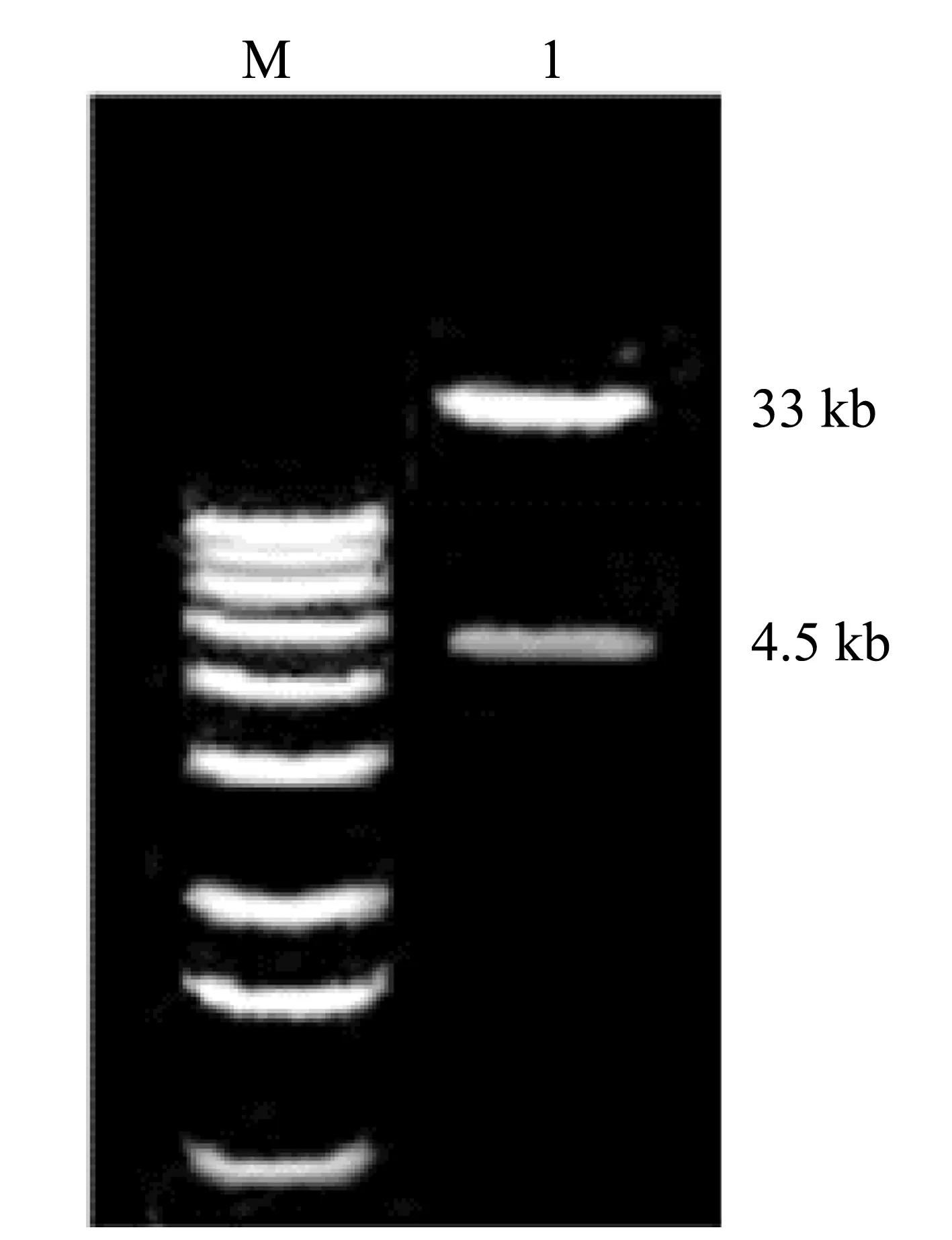
M:1 kb Marker;1:腺病毒重组体(pAd-EGFP)
2 结 果
2.1 pAd-EGFP腺病毒载体的鉴定
pAdtractcmv和pAdEasy-1电转化后,对腺病毒同源重组体用Pac I酶切分析,阳性重组体除有一约33 kb的大片段外,还应释放出一4.5 kb的特异性小片段,酶切结果与预期33 kb和4.5 kb的2条片段相符(见图1).
2.2 重组腺病毒原代包装过程的观察
将线性化的pAd-EGFP质粒转入293A细胞后在该细胞内进行包装.感染2,5,7 d后的海马神经细胞于倒置荧光显微镜下观察绿色荧光蛋白的表达,荧光下可见彗星样病毒特征性噬斑形成(见图2),说明腺病毒包装成功.
2.3 体外培养海马神经元形态的观察
倒置显微镜下观察:刚分离的海马神经元小而圆;培养24 h后可见细胞贴壁良好,生长旺盛,并形成1~2个细而短的突起;培养第7天,海马神经元的胞体丰满(10~20 μm),突起进一步增多、延长,并交织形成网络(见图3).活性较好的海马神经元胞体呈锥形或椭圆形,细胞膜完整、清晰,有折光性,立体感较强;活性较差的海马神经元通常胞膜不清晰,立体感较差,突起断裂或呈串珠状,胞质中常可见明显的核仁,有些神经元为圆形,无突起,说明细胞受损伤较严重.烯醇化酶(NSE)免疫染色结果显示培养第7天的海马神经元纯度可达95%.
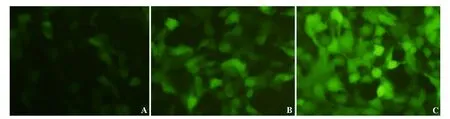
A:2 d;B:5 d;C:7 d(200×)
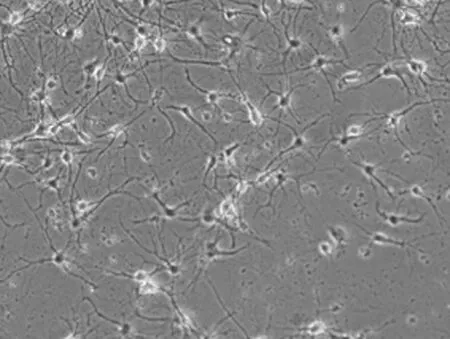
图3 培养第7天的海马神经元(200×)
2.4 Ad-EGFP感染海马神经元的细胞成像
腺病毒感染48 h后进行台盼蓝染色,结果表明神经元的存活率约为92%.由此表明该方法对神经元细胞无明显毒性,可用于神经元形态学的研究.倒置荧光显微镜下对腺病毒感染48 h后的神经元进行细胞成像,海马神经元全细胞表达绿色荧光蛋白(见图4中A),清晰显示其全细胞形态,且感染率可达30%~50%.该技术结合活细胞成像可显现树突丝的运动性(见图4中B).图4中箭头标注为生长变化较为明显的树突丝.量化分析结果显示20 min内体外培养第7天的海马神经元树突丝运动的绝对平均值为3.47 μm(树突丝运动性:20 min (3.47±0.004) μm);每100 μm树突干上的树突丝数目为9.7个(树突丝密度:9.7±0.36).
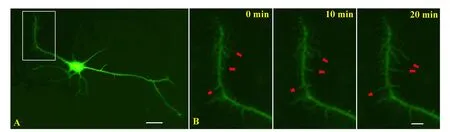
A:海马神经元全细胞形态;B:活细胞实时成像显现树突丝的生长动态.Scale bar:4 μm
3 讨 论
腺病毒载体是目前广泛应用的基因运载系统,它可以高效地将目的基因直接转入哺乳动物的细胞或组织中,并且具有宿主范围广泛、可感染增殖和非增殖细胞、易于制备等优点[9].E1区缺失的腺病毒只能在整合E1区的HEK293等少数细胞中复制,因此,采用包装好的复制缺陷型重组腺病毒可在其他宿主细胞内表达目的基因而自身不复制,从而减少了对宿主细胞的伤害而作为基因表达的优良载体[10].本实验选用pAdtrackcmv作为穿梭载体,此载体内含表达绿色荧光蛋白的启动子,绿色荧光蛋白的表达使转染结果的判断以及滴度测定更加容易,若插入目的基因则可作为报告基因判断目的蛋白的表达[11].本实验构建的腺病毒(Ad- EGFP)感染宿主细胞后只表达绿色荧光蛋白,可用于各种细胞的形态学研究.
神经元树突的主要功能是接受和整合突触传入信息,其接受的突触传入信息种类很多,既有兴奋性的,也有抑制性的;既有可产生电效应的,亦有可产生生物化学效应的.树突分支结构和生物物理特性决定了突触输入和输出的过程.脑发育早期,神经元树突干上出现许多未成熟的丝状突起,称为树突丝.随着神经元的发育,树突干上的树突丝减少,而树突棘出现.树突丝的发育过程被认为参与了树突分支形成、树突棘发育和突触形成[4].在突触发生阶段,树突表现出高度的运动性,随着突触的形成,树突丝的密度下降而树突棘密度增加[12-13].因而人们普遍认为树突丝是树突棘的前体.这种观点在近年的实验中逐渐得到了证实[6-7,14],即随着发育的进行,树突丝逐渐被粗短而稳定的树突棘取代.树突发育过程的分支动力学特征高度动态变化,对环境因素也非常敏感,传入纤维支配、功能刺激、激素和神经递质等均可影响树突的生长发育,因此,研究树突形态的动态变化对阐明神经元的发育及各种因素的影响机制具有重要意义.传统的通过固定细胞后染色研究海马神经元形态的方法,如:Dil染色、MAP2染色、Golgi染色法在分析树突树和树突棘中也有广泛的应用[15-17],但这些方法的缺点是不能体现树突的动态生长过程.而绿荧光蛋白表达的海马神经元活细胞成像和量化分析技术是神经元形态动态研究的有效方法[18-19].
海马神经元是最难转染DNA的细胞类群之一,原因在于它们对微环境的变化非常敏感,并且感染后细胞非常容易死亡.近年来采用较多的磷酸钙法和脂质体法将GFP质粒转入神经元[20-22],使其表达绿色荧光蛋白,但这2种方法普遍存在转染效率偏低、转染后细胞受损较严重和细胞凋亡等问题.采用腺病毒感染海马神经元可以克服GFP质粒转染的缺点.本实验结果表明:腺病毒能有效感染海马神经元,感染率可达30%~50%,可清晰显现表达绿色荧光蛋白海马神经元的全部形态细节,包括细微结构如树突丝、树突棘,结合活细胞成像和量化分析技术即可用于具有高度运动性的树突丝的长度、运动性、密度等指标的测量[23],从而达到动态观察神经元树突生长发育的目的.同时,感染腺病毒对体外培养的海马神经元无明显毒性作用,细胞生长状况良好;包装出来的病毒适宜保存,应用方便,经济而高效.当然,本实验中也发现了它在应用过程中存在的缺陷:形态学观察受到荧光蛋白表达时间和强度的限制.本研究发现绿色荧光蛋白可持续表达3~5 d,感染后48 h是观察的最佳时间.此外,普通荧光显微镜成像所得图像存在清晰度欠佳和分辨率、放大率不够高等问题.运用激光共聚焦显微镜成像可获得比普通荧光显微镜更高对比度、清晰度和分辨率的图像,并且具有实现多重荧光同时观察及形成清晰的三维图像等优点.这些优势为腺病毒转导绿色荧光蛋白进行神经元形态学研究提供了更为精确、可靠的成像技术,为该实验方法的广泛运用提供了可能性.
本研究成功构建了表达绿色荧光蛋白的腺病毒(Ad-EGFP),并有效地感染了原代培养海马神经元.该方法与活细胞成像、量化分析技术相结合能够有效地应用于神经元发育的动态研究,为发育中神经元树突生长的形态变化及各种环境因素和化学物质对神经元生长发育影响的研究,提供了一种简便、经济而有效的方法.
参考文献:
[1]Bertoglio L J,Joca S R,Guimarães F S.Further evidence that anxiety and memory are regionally dissociated within the hippocampus[J].Behavioural Brain Research,2006,175(1):183-188.
[2]王殿仕,李继硕.新生大鼠海马CA1神经元突触反应和树突分支的关系[J].中国神经科学杂志,2002,18(1):400-404.
[3]Chevaleyre V,Moos F C,Desarmenien M G.Correlation between electrophysiological and morphologlical characteristics during maturation of rat supraoptic neurons[J].The European Journal of Neuroscience,2001,13(6):1136-1146.
[4]Konur S,Yuste R.Imaging the motility of dendritic protrusions and axon terminals:roles in axon sampling and synaptic competition[J].Molecular and Cellular Neurosciences,2004,27(4):427-440.
[5]Wong W T,Wong R O.Rapid dendritic movements during synapse formation and rearrangement[J].Current Opinion in Neurobiology,2000,10(1):118-124.
[6]Fiala J C,Feinberg M,Popov V,et al.Synaptogenesis Via Dendritic Filopodia in Developing Hippocampal Area CA1[J].Journal of Neuroscience,1998,18(21):8900-8911.
[7]Ziv N E,Smith S J.Evidence for a Role of Dendritic Filopodia in Synaptogenesis and Spine Formation[J].Neuron,1996,17(1):91-102.
[8]Kivell B M,McDonald F J,Miller J H.Serum-free culture of rat post-natal and fetal brainstem neurons[J].Developmental Brain Research,2000,120(2):199-210.
[9]Chen Huanmian,Honse Y,Ikeda S R.Alternative modalities of adenovirus-mediated gene expression in hippocampal neurons cultured on microisland substrate[J].Neuroscience Letters,2004,368(2):221-225.
[10]Breyer B,Jiang Wei,Cheng Hongwei,et al.Adenoviral vector-mediated gene transfer for human gene therapy[J].Current Gene Therapy,2001,1(2):149-162.
[11]吴伟,王虔,粱浩,等.重组腺病毒载体转导的脑源性神经生长因子在大鼠体外培养海马神经元谷氨酸损伤模型中的保护作用[J].中华神经科杂志,2005,38(7):457-459.
[12]Zuo Yi,Lin A,Chang P,et al.Development of long-term dendritic spine stability in diverse regions of cerebral cortex[J].Neuron,2005,46(2):181-189.
[13]Zuo Yi,Yang Guang,Kwon E,et al.Long-term sensory deprivation prevents dendritic spine loss in primary somatosensory cortex[J].Nature,2005,436(7048):261-265.
[14]Dailey M E,Smith S J.The Dynamics of Dendritic Structure in Developing Hippocampal Slices[J].Journal of Neuroscience,1996,16(9):2983-2994.
[15]O′Malley D,MacDonald N,Mizielinska S,et al.Leptin promotes rapid dynamic changes in hippocampal dendritic morphology[J].Molecular and Cellular Neurosciences,2007,35(4):559-572.
[16]Jiang Min,Chen Gong.High Ca2+-phosphate transfection efficiency in low-density neuronal cultures[J].Nature Protocols,2006,1(2):695-699.
[17]Kayser M S,Nolt M J,Dalva M B.EphB receptors couple dendritic filopodia motility to synapse formation[J].Neuron,2008,59(1):56-69.
[18]Heinen K,Barker R E,Spijker S.Impaired dendritic spine maturation in GABAA receptor-1 knock out mice[J].Neuroscience,2003,122(3):699-705.
[19]Yokosuka M,Ohtani-Kancko R,Yamashita K,et al.Estrogen and environmental estrogenic chemicals exert developmental effects on rat hypothalamic neurons and glias[J].Toxicology in Vitro,2008,22(1):1-9.
[20]Matsutani S,Yamamoto N.Brain-derived neurotrophic factors induces rapid morphological changes in dendritic spines of olfactory bulb granule cells in cultured slices through the modulation of glumateric signaling[J].Neuroscience,2004,123(3):695-702.
[21]宁薇.GSM 1 800 MHz电磁波对培养海马神经元树突发育和突触发生的影响[D].杭州:浙江大学医学院,2006.
[22]Nägerl U V,Willig K I,Hein B,et al.Live-cell imaging of dendritic spines by STED microscopy[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(48):18982-18987.
[23]Luikart B W,Zhang Wei,Wayman G A,et al.Neurotrophin-dependent dendritic filopodial motility:a convergence on PI3K signaling[J].The Journal of Neuroscience,2008,28(27):7006-7012.
