急性肠系膜静脉血栓形成的活化蛋白C抵抗研究
2010-05-25曹辉胡新华何家安张强辛世杰段志泉
曹辉,胡新华,何家安,张强,辛世杰,段志泉
(中国医科大学 附属第一医院普通外科教研室,血管甲状腺外科,沈阳 110001)
活化蛋白C抵抗(activated protein Cresistance,APCR)可以使患者终身伴有高血栓风险,是血栓形成的高危因素[1]。在我国APCR并不少见,但凝血因子V基因第1691位核苷酸发生G-A点突变(FV Leiden突变)的发生率却极低甚至缺如,由于生理或病理因素所产生的获得性APCR是高凝状态和血栓形成的重要原因[2]。抗磷脂抗体(antiphospholipid antibody,APA) 主要包括抗心磷脂抗体(anticardiolipin antibody,ACA)和狼疮抗磷物(lupus anticoagulants,LA)两大类,是一大类针对各种负电荷磷脂蛋白复合物的自身抗体或同种抗体,通过其识别的抗原性不同,与各种磷脂蛋白质复合物结合,干扰各种依赖磷脂的凝血和抗凝因子发挥作用,与血栓形成密切相关[3]。但迄今为止,APA与血栓的病理病因联系的研究大多数局限于系统性红斑狼疮(lupus erythematosus,SLE)和深静脉血栓形成(deep vein thrombosis,DVT),而与急性肠系膜静脉血栓形成(acute mesenteric venous thrombosis,AMVT) 的相关性研究很少。本文检测了我国东北地区68例AMVT患者APCR、ACA、LA,分析上述因素与AMVT的关系。
1 材料与方法
1.1 研究对象
2000年1 月至2009年12月在中国医科大学附属第一医院住院的急性肠系膜静脉血栓形成(AMVT)患者共68例(AMVT组)。男51例,女17例,平均年龄(48.9±22.6)岁。59例AMVT患者经增强CT确诊,其中有32例经手术进一步证实;另外有9例经腹部探查手术证实。入选条件:除外肝硬化性门静脉高压症、脾切除术后、肾病综合征及真性红细胞增多症等有明确高凝状态疾病患者。所有患者均无血栓病家族史,采血前两周内没有应用影响凝血功能的药物。对照组为95例辽宁省血液中心的健康献血者,男56例,女19例;平均年龄(44.2±18.4)岁。本研究人群均为汉族人群,个体之间无血缘关系,2组差异不显著。
1.2 标本采集
采集患者空腹8 h静脉血5 ml,置于3.8%枸橼酸钠抗凝的真空管中,4℃、3 000 r/min离心20 min后,分别取上层去血小板血浆和血清,置-80℃保存。
1.3 方法
1.3.1 APCR测定:分别检测加活化蛋白C(APC)(浓度为200μg/ml)和不加APC的正常混合血浆的活化部分凝血酶时间(APTT),试剂盒购于法国贝特公司,结果以APC敏感率(APC-SR)表示,APC-SR=(APTT+APC)/(APTT-APC)。APC-SR≤2.0判定为APCR阳性,>2.0则为阴性。
1.3.2 ACA检测:采用ELISA法分别检测血清IgG、IgM、IgA型ACA,结果以结合指数(BI)表示[BI=被测吸收度(A)/标准A值]。高于正常2个标准差以上为阳性。试剂购于福建太阳生物技术公司。
1.3.3 LA检测:采用激活的部分凝血活酶时间(PTT)测定法[4]。包括 3 个试验:(1)筛选试验:采用APTT-LA试剂(购于法国Staclot公司)检测血浆APTT,时间延长超过标准血浆5 s者,则进行下一步试验;(2)纠正试验:取患者血浆与正常混合血浆等量混合测APTT,若不能被纠正,则进行下一步试验;(3)血小板中和试验(PNP):取上述等量混合血浆加入外源磷脂测定APTT,若被中和则为LA阳性,反之为阴性。
1.4 统计学分析
数据资料应用SPSS10.0统计软件进行χ2检验和t检验,检验水准α=0.05。
2 结果
2.1 AMVT组与正常对照组APCR检测
AMVT组APCR阳性率30.9%(21/68)明显高于对照组 4.0%(3/75),差异有统计学意义(χ2=18.45,P<0.01);AMVT 组 APC-SR(1.52± 0.26)则显著低于对照组(3.35 ± 0.85)(t=4.69,P<0.01),见表 1。

表1 AMVT组和正常对照组中APCR和APA检测结果比较Tab.1 Comparison of APCRand APAbetween AMVT and control groups
2.2 AMVT组与正常对照组APA检测
AMVT组ACA阳性率(13.2%,9/68)高于对照组(1.3%,1/75),差异有统计学意义(χ2=6.05,P<0.05);AMVT 组 LA 阳性率(22.1%,15/68),而对照组仅2例(2.7%,2/75),差异有统计学意义(χ2=12.8,P<0.01),AMVT组 IgG 型 ACA 的结合指数(BI)及阳性率明显高于正常对照组,差异有统计学意义(t=2.52,P<0.05),IgM和IgA型ACA的阳性率差异无统计学意义(t=1.25,P>0.05),见表 1。
2.3 APA与APCR的关系
AMVT患者LA阳性组中的APCR阳性率(80.0%,12/15)明显高于LA阴性组中的APCR阳性率(17.0%,9/53)(χ2=18.9,P<0.01);ACA 阳性组中的 APCR 阳性率(33.3%,3/19)和ACA阴性组中的APCR阳性率(30.5%,18/59)之间无明显差异(χ2=1.58,P>0.05)。见表 2。
3 讨论
AMVT是一种起病隐匿、病死率高、早期无特异症状和体征的缺血性肠疾病,临床上误诊误治率极高,许多病人往往是在剖腹探查术中才得以确诊,误诊率高达90%~95%。Fagge首次报道AMVT,直至1935年才由Wareen将AMVT确立为一个临床上的独立疾病。AMVT形成血栓机制至今尚未清楚[5]。
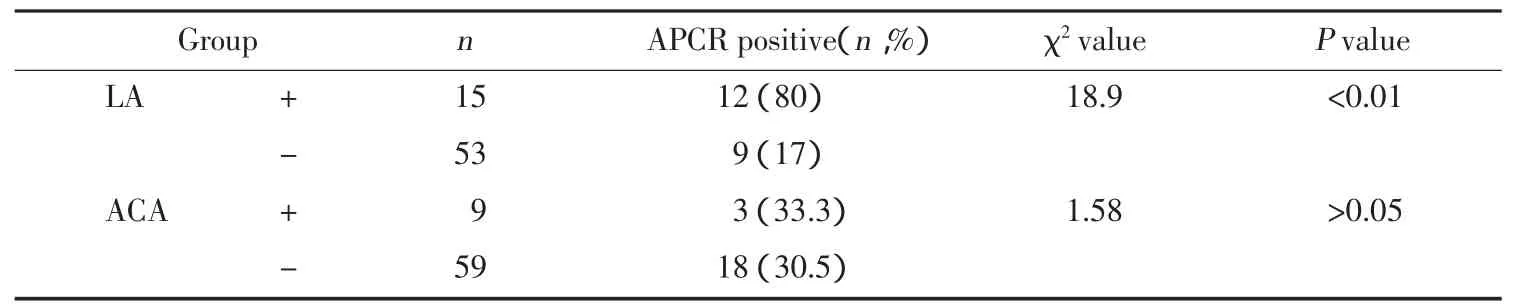
表2 AMVT组APCR与APA相关性分析Tab.2 Association between each APA antibody and APCRin AMVT group
二十世纪九十年代,由瑞典的Dahlback和荷兰的Beltina首先提出了凝血因子V的Leiden突变导致的活化蛋白C抵抗(APCR)[1]。在西方国家,APCR已经被证实是与下肢深静脉血栓形成(DVT)发病最为相关的危险因子,其中约80%的APCR是由FV Leiden突变导致的,即由于凝血因子FVa基因外显子10第1691位的点突变G→A基因突变(Leiden突变),造成FV第506位的精氨酸被谷氨酸取代。这恰好是APC发挥抗凝功能、降解活化的因子V(Va)的第一个酶切位点。点突变使APC不能催化FVa失活位点,FVa不易被裂解灭活,机体表现为高凝状态。这些患者血浆对加入外源的APC抗凝反应减弱,这种现象称为APCR[6]。但是,在部分国家和地区FV Leiden低发区也发现有静脉血栓的患者,即由于各种获得性因素造成APC对FVa、FⅧa降解能力减弱,称这种现象为获得性APCR[7]。现有的许多研究结果表明中国的正常人和血栓性疾病患者均有APCR阳性者,但FV Leiden突变的发生率却很低[2,7]。
研究显示,本组AMVT患者APCR发生率高达30.9%,明显高于正常对照组(4%),提示APCR可能是中国人AMVT患者诱发血栓的主要原因之一。进一步研究发现,LA阳性患者中APCR发生率明显高于LA阴性患者,在15例LA阳性的AMVT中,就有12例APCR阳性(80%),且APTT比值不被正常血浆纠正,但能被血小板膜磷脂纠正,说明这12例LA与获得性APCR有关。研究还发现,本组AMVT病例中,15例LA阳性患者的年龄多数在25~45岁之间,该年龄段的人数占总人数的86%(13/15)。因此,对于年轻的AMVT患者或者反复发生血栓者,应进一步检测APA。
近年的国外研究结果表明,获得性APCR与抗磷脂抗体存在着一定的相关性[9,10]。本实验结果相关分析显示LA阳性患者与APCR发生率密切相关,而ACA与APCR之间无明显相关性。这些结果表明,LA可能是引起AMVT患者发生APCR的重要因素之一。总之,我们的研究结果提示LA通过抑制APC途径引起APCR可能是AMVT患者形成血栓的主要原因之一,这是AMVT患者获得性APCR的重要机制。AMVT发病是多因素参与的复杂病理过程,尚需进一步深入研究其发病的其他机制,才能提高这类疾病的诊治水平,从而改善其预后。
[1]Nicolaes GA,Dahlb覿ck B.Congenital and acquired activated protein Cresistance[J].Semin Vasc Med,2003,3(1):33-46.
[2]Yanqing H,Fangping C,Qinzhi X,et al.No association between thrombosisand factor V genepolymorphismsin Chinese Han population[J].Thromb Haemost,2003,89(3):446-451.
[3]Farmer-Boatwright MK,Roubey RA.Venous thrombosis in the antiphospholipid syndrome[J].Arterioscler Thromb Vasc Biol,2009,29(3):321-325.
[4]Tripodi A.Laboratory testing for lupusanticoagulants:diagnostic criteria and use of screening,mixing,and confirmatory studies[J].Semin Thromb Hemost,2008,34(4):373-379.
[5]He JA,Hu XH,Fan YY,et al.Hyperhomocysteinaemia,low folate concentrations and methylene tetrahydrofolate reductase C677T mutation in acute mesenteric venous thrombosis[J].Eur JVasc Endovasc Surg,2010,39(4):508-513.
[6]Marzo C,Araguás C,Gómez-Arbonés J,et al.Prevalence of phenotypic activated protein Cresistance(APCR)in venous thromboembolic patients[J].Haematologica,1998,83(4):377-378.
[7]Nojima J,Kuratsune H,Suehisa E,et al.Acquired activated protein C resistance associated with IgG antibodies against beta2-glycoprotein Iand prothrombin as a strong risk factor for venous thromboembolism[J].Clin Chem,2005,51(3):545-552.
[8]Wu J,Zhou Z,Li X,et al.Activated protein Cresistance in antiphospholipid thrombosis syndrome[J].Chin Med J,2000,113(8):699-701.
[9]Kassis J,Neville C,Rauch J,et al.Antiphospholipid antibodies and thrombosis:association with acquired activated protein C resistance in venous thrombosis and with hyperhomocysteinemia in arterial thrombosis[J].Thromb Haemost,2004,92(6):1312-1319.
[10]Nojima J,Kuratsune H,Suehisa E,et al.Acquired activated protein Cresistance associated with anti-protein Santibody as a strong risk factor for DVTin non-SLEpatients[J].Thromb Haemost,2002,88(5):716-722.
