TLR4对脑缺血再灌注小鼠皮质IRF-3和IFN-β表达的影响
2010-05-25刘姗姗李静平高音
刘姗姗,李静平,高音
(齐齐哈尔医学院 基础医学院解剖学教研室,黑龙江 齐齐哈尔 161006)
干扰素调节因子3(interferon-regulated factor-3,IRF-3)作为一个重要的转录调节因子,在Toll样受体 4(Toll-like receptor 4,TLR4)介导的髓样分化因子 88(myeloid differentiationfactor 88,MyD88)非 依赖信号转导通路(TIR-domain containing adaptor inducing interferon-β,TRIF信号途径)抵抗病原体入侵的免疫应答的启动过程中起着重要作用,IRF-3活化后形成同源二聚体转位入核,诱导β干扰素(interferon β,IFN-β)基因表达[1,2]。目前,对 TLR4介导的TRIF依赖信号通路中IRF-3的研究主要集中在抗感染免疫反应中[3,4],本研究采用 TLR4 抗体封闭阻断 TLR4,Western blot检测皮质TLR4、IRF-3和IFN-β蛋白表达量,旨在观察脑缺血再灌注损伤是否激活TLR4及采用TLR4抗体阻断TLR4后,IRF-3和IFN-β的表达变化,探讨TLR4参与脑缺血再灌注的反应机制。
1 材料与方法
1.1 主要试剂
兔抗TLR4单克隆抗体(sc-16240)、辣根过氧化物酶标记羊抗兔、羊抗羊IgG二抗、β-actin抗体、兔抗IRF-3单克隆抗体(sc-9082)、山羊抗IFN-β单克隆抗体 IgG(sc-17569)(美国 Santa Cruz公司)。
1.2 实验动物的分组
健康昆明种小鼠144只,雌雄兼用,体质量18~22 g,由中国医科大学实验动物中心提供,随机分为3 组:(1)假手术组(S 组,n=48);(2)缺血再灌注组(I组,n=48);(3)TLR4 阻断组(T 组,n=48)。各组又分 1 d、2 d、3 d、4 d 4 个时间点组(n=6)。
1.3 小鼠脑缺血再灌注模型的制备
手术在室温25℃、湿度50%的条件下进行。用2%的戊巴比妥钠腹腔注射(40 mg/kg),络合碘消毒,行颈部正中切口,分离两侧颈总动脉(common carotid arteries,CCA),用动脉夹夹闭小鼠双侧颈总动脉血流,阻断12 min后,松开动脉夹实现再灌注。在阻断双侧颈总动脉血流后,出现心跳加快、呼吸幅度加深、频率先加快、后减慢典型生理变化过程的小鼠,作为缺血成功样本入选。TLR4阻断组小鼠缺血10 min时在右侧颈总动脉内注入TLR4抗体(10 μg/ml)0.1 ml,注射为缓慢注射,用微量注射泵在2 min内注射完毕,缝合切口。缺血再灌注组注射等量生理盐水,假手术组只分离双侧颈总动脉,其余步骤同上。术中用白炽灯保持小鼠肛温在(37±0.5)℃。术后置清洁饲养笼中观察。
1.4 Western blot检测 TLR4、IRF-3 和IFN-β 表达
各组动物分别于再灌注1 d、2 d、3 d、4 d时间点(n=6)立即冰上断头取右侧皮质,加入适量的细胞裂解液 150 μl[0.1 mol/L NaCl,0.01 mol/L Tris-HCl(pH7.6),0.001 mol/L EDTA (pH8.0),1 μg/ml aprotinin,100 μg/ml PMSF],超声粉碎,离心。 用 Lowry法测定蛋白浓度。取总蛋白30μg经120 g/L SDS-聚丙烯酰胺凝胶电泳分离。转印,杂交,暗室内ECL反应,X线显影、定影。扫描蛋白印迹条带。
1.5 图像分析及统计学处理
蛋白条带用自动凝胶成像系统Chemi Imager 5500 V2.03软件进行扫描,用Fluor Chen 2.0软件进行分析测得平均光学密度值(integrated density value,IDV)。所得数据以x±s表示,用SPSS13.0统计软件作统计分析,样本均数间比较用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 TLR4蛋白表达结果
Western blot分析显示缺血再灌注组TLR4蛋白表达水平明显高于TLR4阻断组和假手术组(图1)。缺血再灌注组TLR4表达在1 d、2 d、3 d和4 d分别高于TLR4阻断组(P<0.05)。见表1。
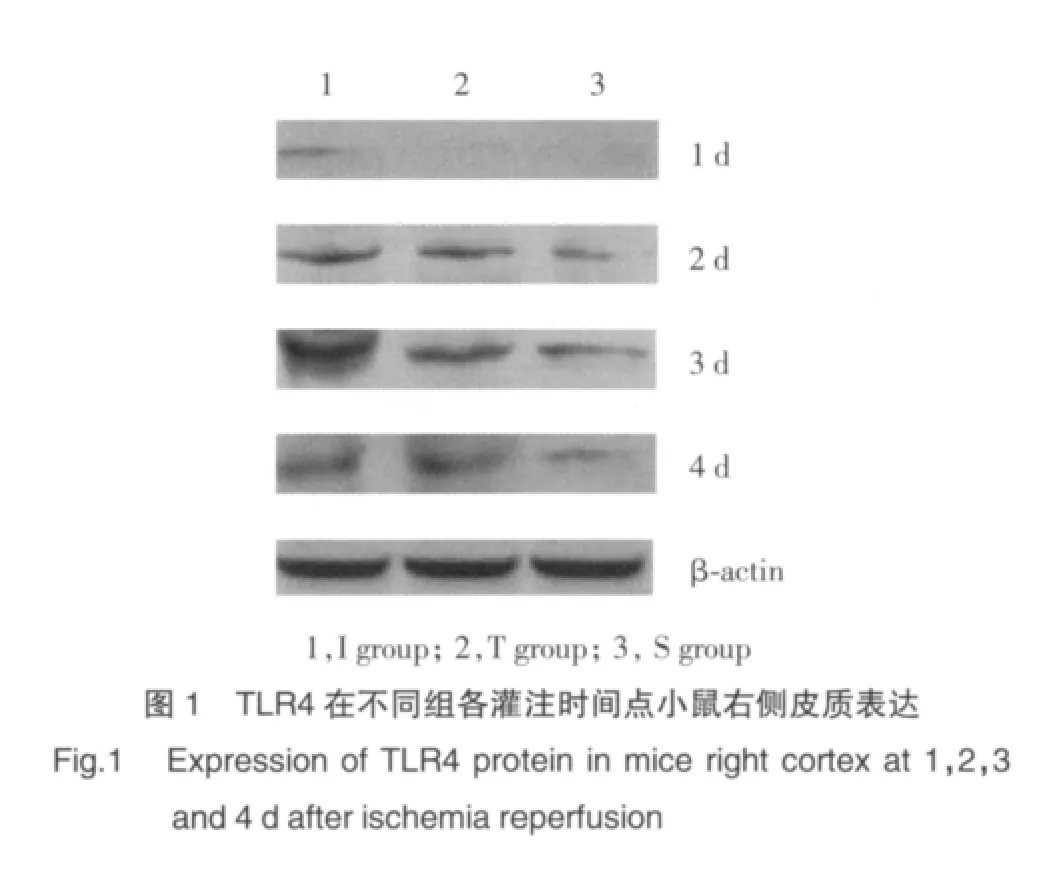
表1 TLR4在小鼠右侧皮质表达的ID值(±s)Tab.1 The IDV of TLR4 expression at different reperfusion time point(±s)
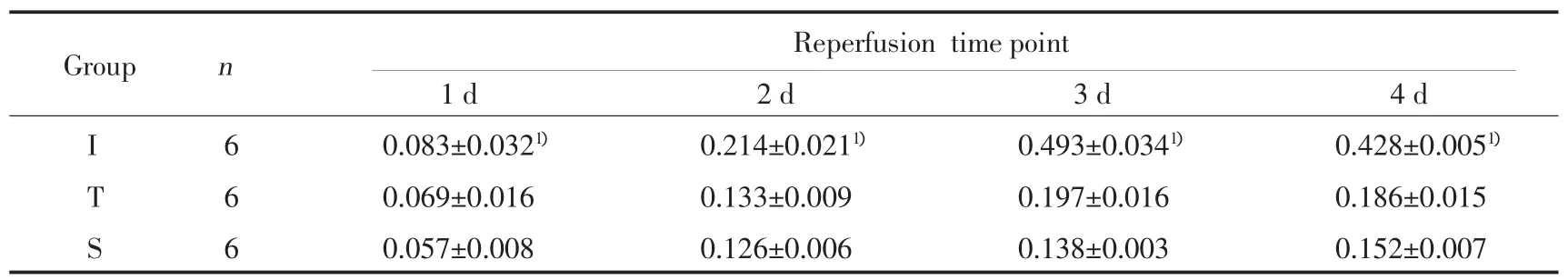
表1 TLR4在小鼠右侧皮质表达的ID值(±s)Tab.1 The IDV of TLR4 expression at different reperfusion time point(±s)
1)P<0.05 vs Sgroup or T group.IDV,integrated density value;I,ischemia reperfusion group;T,TLR4 blocking group;S,shamgroup
Group n Reperfusion timepoint 1 d 2 d 3 d 4 d I 6 0.083±0.0321) 0.214±0.0211) 0.493±0.0341) 0.428±0.0051)T 6 0.069±0.016 0.133±0.009 0.197±0.016 0.186±0.015 S 6 0.057±0.008 0.126±0.006 0.138±0.003 0.152±0.007
2.2 IRF-3蛋白表达结果
Western blot分析显示缺血再灌注组IRF-3蛋白表达水平明显高于TLR4阻断组和假手术组(图2)。缺血再灌注组IRF-3表达在1 d、2 d、3 d和4 d分别高于TLR4阻断组(P<0.05)。见表2。
2.3 IFN-β蛋白表达结果
Western blot分析显示缺血再灌注组IFN-β蛋白表达水平明显高于TLR4阻断组和假手术组(图3)。缺血再灌注组IFN-β蛋白在再灌注1 d开始表达,3 d达到高峰,4 d开始下降(图3)。缺血再灌注组IFN-β表达在1 d、2 d、3 d和4 d高于TLR4阻断组(P<0.05)。见表3。
3 讨论
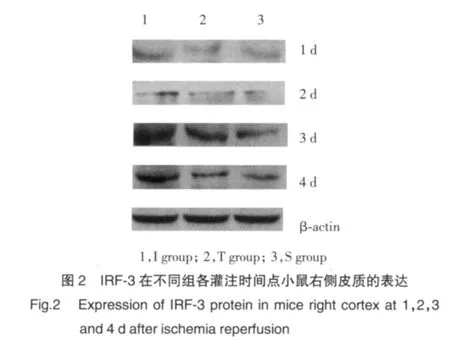
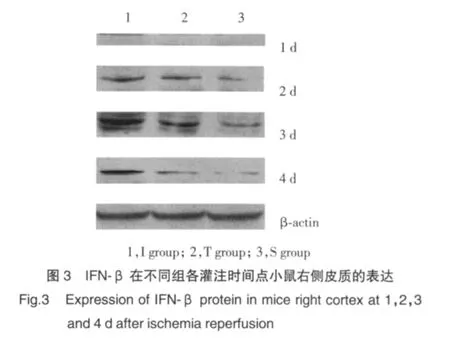
表2 IRF-3在小鼠右侧皮质表达的ID值(±s)Tab.2 The IDV of IRF-3 at different reperfusion time point(±s)
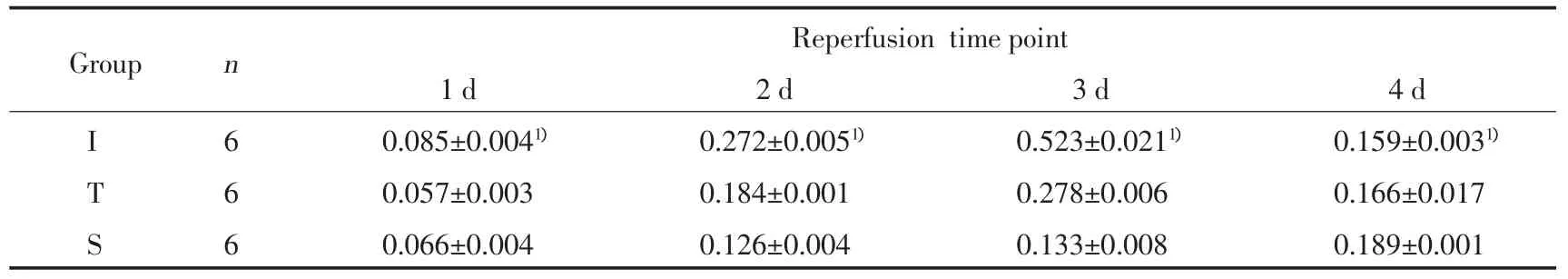
表2 IRF-3在小鼠右侧皮质表达的ID值(±s)Tab.2 The IDV of IRF-3 at different reperfusion time point(±s)
1)P<0.05 vs Sgroup or Tgroup.
Reperfusion timepoint 1 d 2 d 3 d 4 d I 6 0.085±0.0041) 0.272±0.0051) 0.523±0.0211) 0.159±0.0031)T 6 0.057±0.003 0.184±0.001 0.278±0.006 0.166±0.017 S 6 0.066±0.004 0.126±0.004 0.133±0.008 0.189±0.001 Group n
表3 IFN-β在小鼠右侧皮质表达的ID值(±s)Tab.3 The IDV of IFN-β in each group with different reperfusion time point(±s)
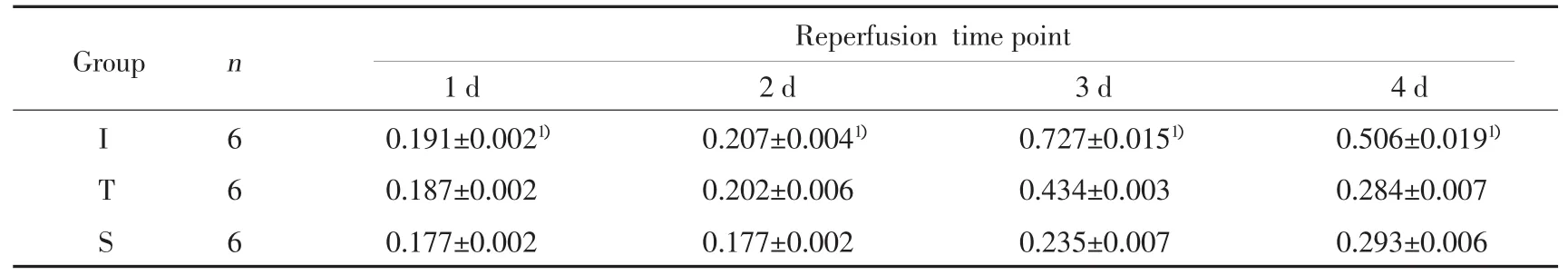
表3 IFN-β在小鼠右侧皮质表达的ID值(±s)Tab.3 The IDV of IFN-β in each group with different reperfusion time point(±s)
1)P<0.05 vs Sgroup or Tgroup.
Reperfusion timepoint 1 d 2 d 3 d 4 d I 6 0.191±0.0021) 0.207±0.0041) 0.727±0.0151) 0.506±0.0191)T 6 0.187±0.002 0.202±0.006 0.434±0.003 0.284±0.007 S 6 0.177±0.002 0.177±0.002 0.235±0.007 0.293±0.006 Group n
TLR4是一种跨膜蛋白受体,TLR4被激活后,其信号经由2条信号通路由胞外向胞内传导:MyD88依赖性途径和MyD88非依赖性途径,MyD88非依赖性途径又称TRIF依赖性,TRIF可激活TBK1 [TRAFfamily-member-associated NF-κB activator(TANK)binding kinase 1],TBK1由一个可诱导的 I-κBkinase(IKK-i)家族组成[5]。TBK1/IKK-i直接使IRF-3和干扰素调节因子7(interferon response factor 7,IRF-7)磷酸化[6],磷酸化的 IRF-3 和IRF-7形成同源二聚体,转移到细胞核,导致IFN-β和一系列IFN诱导的基因表达[7]。目前,TLR4介导的TRIF信号通路的研究主要集中在对抗微生物感染的免疫反应中[8,9],在脑缺血再灌注损伤中该通路是否介入尚未见报道。
由于IRF-3是TLR4信号传导通路的一个关键分子,本研究在脑缺血再灌注损伤激活TLR4后,观察了IRF-3及其诱导的IFN-β在小鼠皮质的表达。结果显示:缺血再灌注组IRF-3蛋白表达水平明显高于TLR4阻断组和假手术组(P<0.05),说明TLR4被激活后,引起IRF-3表达量增加,而采用TLR4抗体阻断后,IRF-3表达量减少。提示IRF-3参与了脑缺血再灌注TLR4激活后的信号传导路径。Western blot结果显示:缺血再灌注组小鼠的皮质在TLR4被激活并引起IRF-3的过表达后,IFN-β表达量显著高于TLR4阻断组和假手术组(P<0.05);而采用TLR4抗体封闭TLR4阻断后,TLR4阻断组的IFN-β表达量明显低于缺血再灌注组(P<0.05),提示在脑缺血再灌注的病理发展过程中,TLR4-IRF-3-IFN-β信号通路可能被激活;阻断TLR4后,IRF-3和IFN-β表达量明显减少。目前,直接针对TLR4-IRF-3-IFN-β信号通路的研究较少,这一途径在脑缺血再灌注中所发挥的作用还有待于进一步深入研究。
[1]Katherine AF,Sarah MM,Kerrie LF,et al.IKK epsilon and TBK1 are essential components of the IRF-3 signaling pathway [J].Nat Immunol,2003,4(5):491-496.
[2]Sharma S,Tenoexer BR,Grandvaux N,et al.Triggeringtheinterferon antiviral response through an ikk-related pathway [J].Science,2003,30(12):1148-1151.
[3]Barton GM.Viral recognition by Toll-like receptors [J].Semin Immunol,2007,32(4):113-121.
[4]Menzies M,Ingham A.Identification and expression of Toll-like receptors1-10 in selected bovineand ovinetissues[J].Veterinary Immunology and Immunopathology,2006,109(11):23-30.
[5]Oganesyan G,Saha SK,Guo B,et al.Critical role of TRAF3 in the Toll-like receptor-dependent and-independent antiviral response[J].Nature,2006,439(10):208-211.
[6]Fitzgerald KA,Rowe DC,Bames BJ,et al.LPS-TLR4 signaling to IRF-3/7 and NF-kappaB involves the toll adapters TRAM and TRIF[J].JExp Med,2003,198(9):1043-1055.
[7]Kawai T,Akira S.TLR signaling [J].Cell Death Differ,2006,13(4):816-825.
[8]Fitzgerald KA,Mcwhirter SM,Faia KL,et al.IKK and TBK1 are essential components of the IRF-3 signaling pathway [J].Nat Immunol,2003,14(2):491-496.
[9]Yoneyama M,Suhara W,Fukuhara Y,et al.Direct triggering of the type I interferon system by virus infection:activation of a transcription factor complex containing IRF-3 and CBP/p300 [J].EMBOJ,1998,17(7):1087-1095.
