癌组织中 mi RNA表达谱的变化与 NSCLC放疗敏感性的关系
2010-05-22崔爽爽杜利清王月英孟爱民王小春赵永成
崔爽爽,杜利清,王月英,孟爱民,王小春*,赵永成*
(1北京协和医学院,北京 100730;2中国医学科学院放射医学研究所)
放疗是肺癌治疗的主要手段,但不同个体对放疗的敏感性存在差异。如果在治疗前可预测患者对放疗的敏感性,就可能拟订对肿瘤有最高疗效而对正常组织损伤最低的放疗剂量,但目前尚无临床预测放疗敏感性的指标。2008年 10月 ~2009年 8月,我们检测了非小细胞肺癌(NSCLC)患者癌组织中微型核糖核酸(miRNA)表达谱的变化,并探讨其与 NSCLC放疗敏感性的关系。
1 资料与方法
1.1 临床资料 30例Ⅱ ~Ⅲ期 NSCLC患者中,男21例、女 9例,平均年龄 47岁;其中鳞癌 23例,腺癌 7例;患者术前未行任何治疗,于 2001~2003年均行手术治疗,并收集其癌组织标本,术后均行放疗(总累积剂量 60 Gy,60Co光子束,周剂量 10 Gy)。根据总体生存率和远端转移情况将患者分为两组,生存率 >36个月、无远端转移者为放疗敏感组,其他为放疗不敏感组,每组 15例。
1.2 癌组织中 miRNA表达谱检测 采用 miRNA表达谱芯片检测。操作步骤:①小 RNA提取:按 miRNeasy Mini Kit操作说明提取 C57BL/6J小鼠大脑组织的大 RNA(>200 nt)和小 RNA(<200 nt),通过测定 260 nm下的光密度值确定 RNA浓度,用1%(质量分数)的琼脂糖凝胶电泳确认大 RNA未降解,以保证小 RNA的质量。用 3.5%(质量分数)的 NuSieve琼脂糖凝胶电泳检测小 RNA。②miRNA微阵列基因分析:在 μParafloTM微流体芯片上含有最新版本探针序列(Version 10.0 RNA数据库)及 LC Sciences公司提供的质控探针,探针由(光敏试剂)PGR化学试剂原位合成。微阵列实验需要 2~5μg总 RNA样品,通过 YM-100微离心过滤柱得到片段 <300 nt的小RNA。Poly(A)聚合酶在分离到的小 RNA 3'端加上poly(A)尾巴,再将一个寡聚核苷酸标记与这个 poly(A)尾巴连接用于后续的荧光标记。在双样品实验中,用 2个不同的标记物来标记 2个 RNA样品。杂交反应通过微循环泵杂交仪器在 μParafloTM微流体芯片上过夜[1]。杂交使用含 25%甲酰胺的 100μl 6×SSPE缓冲液,杂交温度 34℃。杂交检测使用 Cy3和Cy5特异性荧光标记,激光扫描仪采集杂交图像,用Array-Pro软件对杂交图像进行数字化转换。③微阵列数据分析:数据处理和分析首先是扣除背景,计算重复点平均值和标准偏差,再通过LOWESS过滤进行标准化。对于双色标记实验,将计算两种检测信号的比值(log2)和 t-test的 P值。P≤0.01为差异有统计学意义。采用 Cluster 3.0软件对结果进行聚类分析。
2 结果
与放疗不敏感组相比,放疗敏感组中有 5个miRNA(miR-126、miR-let-7a、miR-495、miR-451、miR-128b)表达显著上调,7个 miRNA(miRNA-130a、miRNA-106b、miRNA-19b、 miRNA-22、miRNA-15b、miRNA-17-5p、miRNA-21)表达显著下调,详见表1。
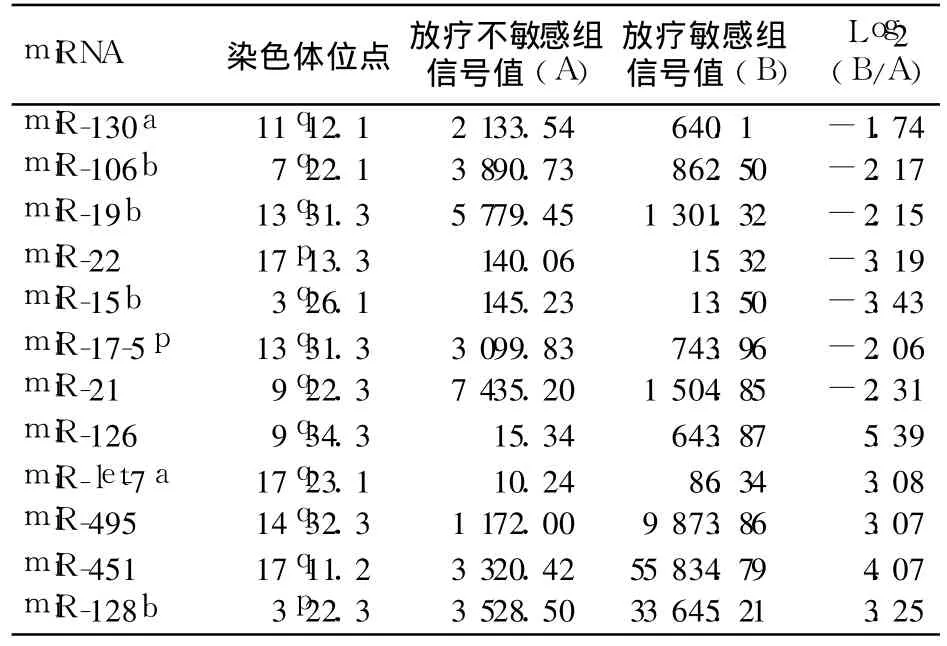
表1 两组12个差异表达的miRNA比较
3 讨论
miRNA是一类小的(19~24 nt)非编码 RNAs,可负调控靶基因 mRNAs的稳定性或转录效率,在调节细胞增殖、凋亡、发育、分化及代谢等方面发挥重要作用。目前,已在多种肿瘤中发现特异性 miRNA表达谱,包括慢性 B型淋巴细胞性白血病[2]、乳腺癌[3]、初级恶性胶质瘤[4]、肝细胞癌[5]、乳头状甲状腺癌[6]、肺癌[7]、胃癌和结肠癌等[8]。
研究发现,miRNA在肿瘤发生、发展中起重要作用,并与其预后有关。因此,我们检测了放疗敏感和不敏感 NSCLC患者癌组织中 miRNA表达谱的差异,结果发现,12个 miRNA的表达在放疗敏感组和不敏感组有显著差异。Brueckner等采用 Northern blotting法检测了 16例肺癌患者癌组织中的 miRNA-let-7a,其中 7例 miRNA-let-7a表达与健康对照相比降低了80%;另有研究表明,miRNA-let-7a低表达者肺癌术后生存率较低[9]。本研究结果显示,放疗敏感组癌组织中 miRNA-let-7a表达较不敏感组高,提示 miRNA-let-7a可能与 NSCLC放疗敏感性有关。miRNA-126在肿瘤细胞的增殖中发挥重要作用,尚未见其与放射敏感性关系的报道。本研究发现,miRNA-126在两组患者癌组织中变化最显著,提示其与肺癌放疗敏感性可能存在很大相关性。miRNA-21位于肺癌扩增的位点,miRNA-451、miRNA-106b可能在支气管肺泡干细胞保持自我更新能力中发挥重要作用[10]。本研究发现,miRNA-2、miRNA-451、miRNA-106b在放疗敏感组癌组织中的表达低于不敏感组,提示三者可能与肺癌的放疗敏感性有关。但影响放疗敏感性的因素较多,尚需深入研究。
[1]Gao X,Gulari E,Zhou X.In situ synthesis of oligonucleotide microarrays[J].Biopolymers,2004,73(5):579-596.
[2]Calin GA,Liu CG,Sevignani C,et al.MicroRNA profiling reveals distinct signatures in B cell chronic lymphocytic leukemias[J].Proc Natl Acad Sci USA,2004,101(32):11755-11760.
[3]Iorio MV,Ferracin M,Liu CG,et al.MicroRNA gene expression deregulation in human breast cancer[J].Cancer Res,2005,65(16):7065-7070.
[4]Ciafre SA,Galardi S,Mangiola A,et al.Extensive modulation of a set of microRNAs in primary glioblastoma[J].Biochem Biophys Res Commun,2005,334(4):1351-1358.
[5]Murakami Y,Yasuda T,Saigo K,et al.Comprehensive analysis of microRNA expression patternsin hepatocellular carcinoma and nontumoroustissues[J].Oncogene,2006,25(17):2537-2545.
[6]Liu B,Peng XC,Zheng XL,et al.MiR-126 restoration down-regulate VEGF and inhibit the growth of lung cancer cell lines in vitro and in vivo[J].Lung Cancer,2009,66(2):169-175.
[7]Takamizawa J,Konishi H,Yanagisawa K,et al.Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival[J].Cancer Res,2004,64(11):3753-3756.
[8]Michael MZ,O′Connor SM,van Holst Pellekaan NG,et al.Reduced accumulation of specific microRNAs in colorectal neoplasia[J].Mol Cancer Res,2003,1(12):882-891.
[9]Fang WJ,Lin CZ,Zhang HH,et al.Detection of let-7a microRNA by real-time PCR in colorectal cancer:a single-centre experience from China[J].JInt Med Res,2007,35(5):716-723.
[10]Brueckner B,Stresemann C,Kuner R,et al.The human let-7a-3 locus contains an epigenetically regulated microRNA gene with oncogenic function[J].Cancer Res,2007,67(4):1419-1423.
