CD105和血管内皮生长因子在大鼠角膜新生血管中的表达
2010-05-16张明昌
丁 怡 张明昌
1广州军区武汉总医院眼科,武汉 430070
2华中科技大学同济医学院附属协和医院眼科,武汉 430022
角膜是眼主要的屈光介质,正常角膜没有血管,以保持其透明性。角膜缘则具有丰富的血管网,在感染、外伤、免疫反应等病理情况下,毛细血管由角膜缘处向角膜内生长。一般认为,毛细血管进入角膜周边部1~2 mm以上即称为角膜新生血管(corneal neovascularization,CNV)。虽然新生血管对感染清除,伤口愈合,抑制角膜溶解等有一定作用[1],但CNV可破坏角膜正常微环境,使眼前节相关免疫赦免偏离消失[2],是角膜移植排斥反应的高危因素;而且新生血管结构较脆弱,易渗透,常因出血渗出及继发纤维化等导致失明,是目前常见的致盲原因之一。角膜新生血管的治疗一直是个棘手的问题,对其发生机制的研究是解决问题的关键。
CD105是一种内皮细胞增殖的标志物,是转化生长因子-β(TGF-β)受体复合物的成分之一[3-4]。本实验通过对CD105在角膜新生血管中的表达来研究其在CNV发生中的作用,从而希望能指导CNV的治疗。
1 材料与方法
1.1 材料
一抗:兔抗大鼠CD105单克隆抗体,兔抗大鼠VEGF单克隆抗体EnVisionTM加强型试剂盒(通用型,含色源底物溶液DAB)(美国 DAKO公司)。1%丁卡因滴眼液,10%水合氯醛,1%阿托品眼膏(均由武汉市协和医院分装)。美多丽滴(复方托吡卡胺)眼液(日本参天制药株式会社),鼠碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(美国BioSource公司),琼脂糖(Spain公司)。Sprague-Dawleg(SD)大鼠(华中科技大学同济医学院实验动物学部清洁级动物)。
1.2 实验动物分组
36只SD大鼠,雌雄不限,体重 150~200 g,裂隙灯显微镜下检查无眼前节疾病,分为正常对照组和实验组,正常对照组6只。根据模型制作时间4、7、10、14、21 d将实验组随机分为5组,每组6只。
1.3 动物模型制备
方法参见文献[5-6]。
1.3.1 缓释药丸制备 在解剖显微镜下用无菌显微剪将医用明胶海绵片剪成1 mm ×1mm ×1 mm的小片,浸入4℃PBS过夜后,用无菌滤纸将水分吸干 。滴加1 μ L(100 ng/μ L,溶剂PBS)bFGF 于明胶海绵小片上,待完全吸收后置于超净台内干燥48 h形成小药丸。将此小丸浸入2%琼脂糖溶液包裹后取出,再置于超净台内干燥48 h备用。
1.3.2 动物模型制作 术前高压消毒所有手术器械,所有步骤均在无菌条件下进行。用10%水合氯醛腹腔注射麻醉(30 mg/kg),1%丁卡因双眼角膜表面麻醉。角膜中央做长约1.5 mm半厚切口,并从此切口用15°角膜穿刺刀向9:00方向角膜缘做潜行隧道,隧道顶端距角膜缘1 mm。用显微镊将缓释药丸植入隧道顶端。术毕涂四环素眼膏和阿托品眼膏,观察期间氯霉素眼药水点眼,3次/d。
1.4 标本处理
大鼠分别于手术后 4、7、10、14、21 d 后颈椎脱臼法处死,迅速摘除完整角膜组织,用多聚甲醛固定24~48 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,2 μ m连续切片,行免疫组织化学染色。
1.5 形态学观察
手术后每日用显微镜观察大鼠角膜、结膜及前房情况。待新生血管长出后,测量其从角膜缘长出的长度和数量。测量时,以连续弯曲度小,CNV朝向角膜中心生长的最长血管为准,并计算CNV生长面积A,A=C/12 ×3.1416[r2-(r-I)2],其中C为CNV累及角膜的圆周钟点数,I为CNV从角膜缘伸入角膜的长度,r为角膜半径。
1.6 免疫组织化学分析
将连续切片置于65℃烤箱中放置2~3 h,常规二甲苯脱蜡,梯度乙醇水化,高温高压抗原修复。置新鲜配置的3%双氧水甲醇中室温下孵育10 min以灭活内源性过氧化物。双蒸水冲洗3次,每次5 min。滴加1∶100稀释的一抗,37℃孵育60 min。恢复室温后,蒸馏水漂洗2次,每次1 min;PBS漂洗2次,每次2 min。滴加二抗37℃孵育30 min后漂洗。滴加DAB溶液显色,显微镜下观察2~10 min控制显色,蒸馏水冲洗以终止染色。苏木精复染,脱水干燥,二甲苯透明,中性树胶封片。首先在低倍镜(10×)视野下扫描整个组织切片,找到染色清晰,背景良好的区域,然后在高倍镜(20×)视野下随机选择视野,使用HPIAS-2000型彩色图文分析系统免疫组化分析程序分别对CD105、VEGF染色进行积分吸光度分析,每张切片随机选取3个视野进行定量分析。
1.7 统计学分析
采用SPSS 12.0软件对数据进行处理,所有计量资料以±s表示,组间差异比较采用 t检验,以P<0.05为差异有统计学意义。2种因子的表达与CNV增长的相关性采用Pearson相关分析法。
2 结果
2.1 形态学观察
手术后1 d,结膜轻度睫状充血,局部角膜水肿,囊袋形成良好,药丸可见,尚无新生血管生长;术后4 d,可见局部角膜轻度水肿,囊袋形成好,药丸在位,可见少量稀疏细小的新生血管自角膜缘向角膜中心区长出,血管定向成束向植入物生长,血管范围局限且管腔较细(图1A)。此后角膜新生血管逐渐进展,吻合,浓密,呈束状生长,伸向角膜中心,包裹药丸。7~10 d达高峰,血管最为密集,管腔最为粗大,充血明显,完全包裹植入物(图1B)。2周左右新生血管仍较多较粗,但趋于消退(图1C)。21 d后趋于平静,血管开始渐少而细,管腔萎缩,管腔中无血细胞(图1D)。不同时间CNV面积计算结果见表1。
2.2 免疫组织化学分析
CD105和VEGF阳性表达呈棕黄色或棕褐色染色,定位于微血管内皮细胞的细胞膜和(或)细胞质,各组染色吸光度值检测结果见表1。
在正常角膜组织中,CD105和VEGF不表达或仅在上皮层呈弱表达(图2A、2D)。4 d时,角膜新生血管形成,可见CD105和VEGF均表达于血管内皮细胞,呈棕黄色染色(图2B、2E);10 d,角膜新生血管达高峰,CD105和VEGF强表达于血管内皮细胞,可成深棕黄或棕褐色染色(图2C、2F)。各组2种因子的表达与正常对照组比较,其差异均有统计学意义(P<0.01)。2种因子的表达与CNV的增长呈正相关(CD105与CNV面积相关系数r=0.969 1,P<0.01;VEGF与面积相关系数r=0.974 6,P<0.01)。CD105与VEGF的表达也呈正相关(r=0.999 6,P<0.01)。
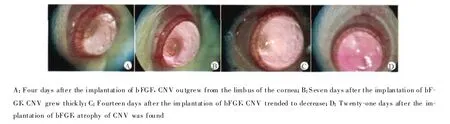
图1 bFGF植入后CNV的生长变化(×25)Fig.1 The change of CNV after the implantation of bFGF(×25)
表1 各组CNV面积和平均吸光度(A)值(±s,n=6)Table 1 The area of CNV and the average of abso rbance(A,±s,n=6)

表1 各组CNV面积和平均吸光度(A)值(±s,n=6)Table 1 The area of CNV and the average of abso rbance(A,±s,n=6)
Groups Area of CNV(mm2)A values of IHC CD105 VEGF Control 0 0.049±0.009 0.052±0.010 4 d 1.58±0.53 0.292±0.031 0.325±0.037 7d 3.02±0.79 0.625±0.045 0.663±0.047 10 d 3.69±0.96 0.938±0.059 0.986±0.064 14 d 3.12±1.12 0.601±0.050 0.652±0.051 21 d 1.12±0.27 0.273±0.029 0.289±0.026
3 讨论
本实验采用较为成熟的稳定有效的角膜囊袋法制作角膜新生血管模型。bFGF能够在极低浓度(1 ng/mL,约等于1 ng/g)时起作用[7],在机体的胚胎发育、血管形成、创伤愈合及神经系统生长发育过程中都起着十分重要的作用[8]。在一系列体外实验中,它被证实具有对血管内皮细胞分化、增生、迁移和趋化作用[9]。bFGF与其靶细胞表面的受体结合之后,可以刺激靶细胞内的 DNA合成增加,进而导致细胞的分裂增生[10]。它具有重要的生理功能,可促使微血管的生长分化,使局部的毛细血管数目增加。实验证明它诱导的新生血管稳定便于研究[11],作为新生血管的直接刺激因子,它能排除炎症等间接新生血管刺激因素。本实验通过多次探索,摸索出较为合适的试验剂量浓度,并达到最好的效果。
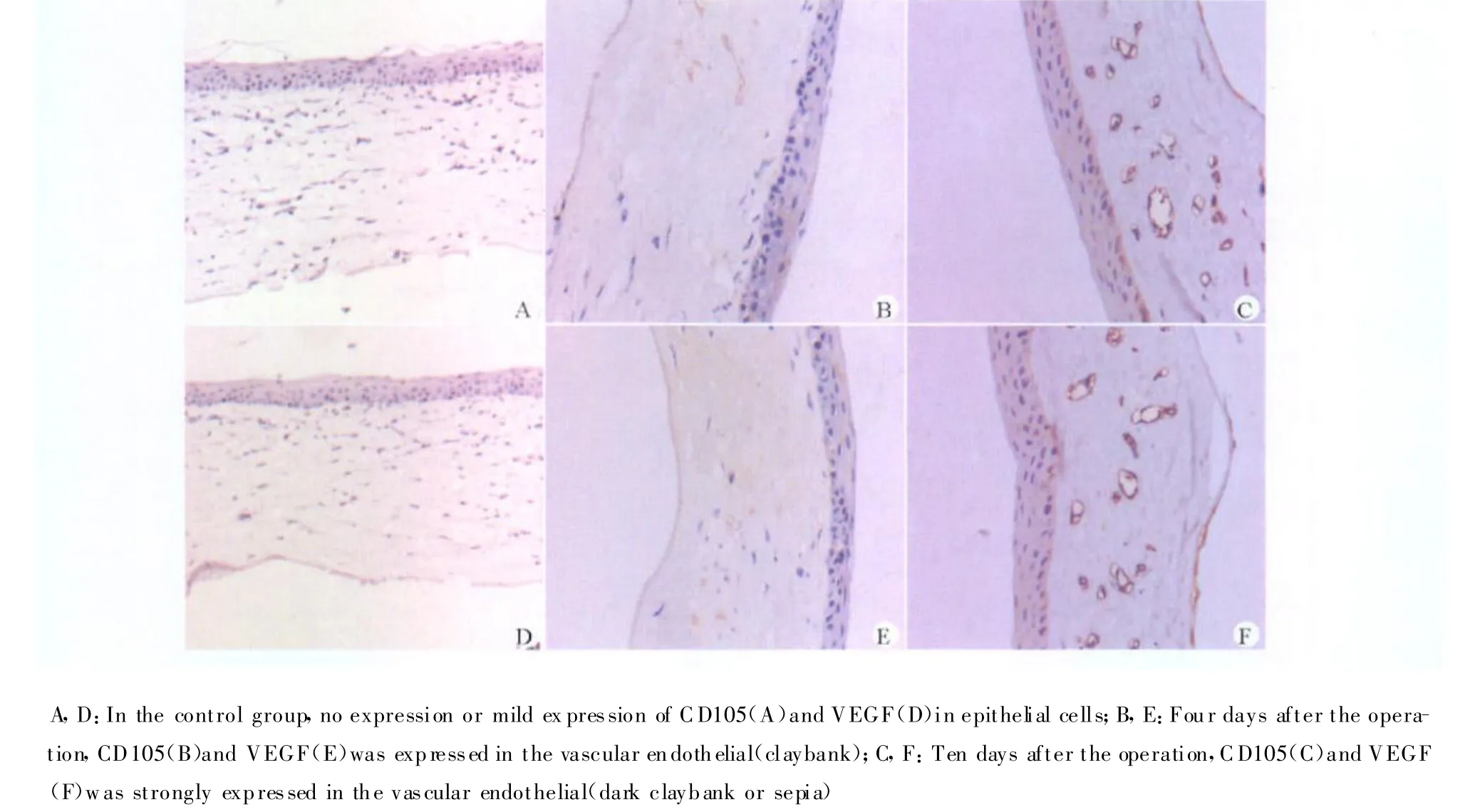
图2 CD105和VEGF在角膜组织中的表达(DAB显色,×200)Fig.2 The expression of CD105 and VEGF in cornea(DAB,×200)
CD105是一种180 kD的跨膜糖蛋白[12],能特异性结合 TGF-β,是 TGF-β受体复合物的辅助成分之一,其对TGF-β的调节作用主要是抑制 TGF-β的生物学效应,主要表现为阻断对内皮细胞生长的抑制以及纤溶酶原激活物抑制剂-1和纤维结合素的合成等[13]。CD105具有特殊的组织学标记,在内皮细胞显著表达,并能选择内皮细胞[14],在人类微血管内皮细胞和增生的血管内皮细胞中,CD105已被检测出[15]。它大量表达于细小的和尚未成熟的血管中[16],尤其在再生组织、炎症组织和肿瘤组织中[17]。Li等[18]研究发现敲除CD105基因的裸鼠血管发育障碍,于妊娠10~11 d死于脉管发育不全,表明了CD105在血管生成中是必需的。在不同组织和正常组织的血管内皮细胞的比较中观察到CD105能强有力地调节其血管内皮细胞的生长[19]。
VEGF是1983年被发现表达于血管内皮并命名的细胞因子[20],在1989年被Leung等[21]证明有促进内皮细胞有丝分裂的作用。VEGF是刺激血管内皮细胞增殖和移行的重要因子,并可影响血管通透性。本研究发现VEGF也能在正常大鼠角膜上皮层弱表达,在有新生血管的角膜中可见其在新生血管内皮中表达,并且其与CNV的形成呈正相关,这进一步证明了VEGF可以刺激血管内皮细胞的增殖,促进新生血管的形成。CD105同VEGF一样,也能在正常大鼠角膜上皮层弱表达或无表达,而在有新生血管的角膜中角膜上皮以及血管内皮中表达明显,且其表达强弱趋势与CNV的发展一致,在CNV发展高峰,CD105的表达也最强。我们还发现CD105与VEGF的表达是一致的。当VEGF呈强表达时,CD105也是较强表达。这说明CD105很有可能与VEGF一样,同样在CNV的发生发展中起着重要作用。这为我们临床治疗CNV类疾病提供了新的思路,为以CD105为靶向治疗CNV的方法提供了理论依据。
[1] Streiein J W,Bradley D,Sano Y,et al.Immunosuppressive pr
operties of tissues obtained from eyes with experimentally manipulated corneas[J].Invest Ophthalmol Vis Sci,1996,37(2):413-424.
[2] Dana M R,Streilein J W.Loss and resto ration of immune privilege in ey es with corneal neovascularization[J].Invest Ophthalmol Vis Sci,1996,37(12):2485-2494.
[3] Fonsati E,Sigalotti L,Arslan P,et al.Emerging role of endoglin(CD105)as a marker of angiogenesis with clinical potential in human malig nancies[J].Curr Cancer Drug Targets,2003,3(6):427-432.
[4] Fonsatti E,Del Vecchio L,Altomonte M,et al.Endoglin an accessory component of the TGF-beta-binding receptor complex with diagnostic,prognostic,and bioimmunotherapeutic potential in human malignancies[J].J Cell Physiol,2001,188(1):1-7.
[5] White R R,Shan S,Rusconi C P,et al.Inhibition of rat corneal angiogenesis by a nuclease-resistant RNA aptamer specific for angiopoinetin-2[J].PNAS,2003,100(9):5028-5033.
[6] McCarty M F,Baker C H,Bucana C D,et al.Quantitative and qualitative in vivo angiogenesis assay[J].Intern J Oncol,2002,21(1):5-10.
[7] 庆宏,郭畹华.与中脑黑质有关的神经营养因子[J].神经解剖学杂志,1995,11(3):257.
[8] Aoyagi A,Nishikawa K,Sait O H.Characterization of bFGF mediated acceleration of ax onal bronching in cultured rat hippocamplaneurons[J].Brain Res,1994,661(2):117-123.
[9] Murata T,Ishibashi T,Khalil A,et al.Vascular endothelial growth factor plays a role in hyperpermeability of diabetic retinal vessels[J].Ophthalmol Res,1995,27(1):48-52.
[10] 黄巨恩,陈维平.碱性成纤维细胞生长因子的基础与应用研究[J].解剖学进展,1996,2(2):133-137.
[11] 邱培瑾.角膜新生血管的动物模型[J].国外医学眼科学分册,2000,24(6):360-363.
[12] Haruta Y,Seon B K.Distinct human leukemia-associated cell surface glycoprotein GP160 defined by monoclonal antibody SN6[J].Pro Natl Acad Sci USA,1986,83(20):7898-7902.
[13] Li C,Hampaon L.CD105 antagonizes the inhibitory signaling of transforming growth factor beta 1 on human vascular endothelial cell[J].FASEB J,2000,14(1):55-64.
[14] Guaulich W,Nettelbeck D M,Fischer D,et al.Cell type specificity of the human endoglin promoter[J].Gene,1999,227(1):55-62.
[15] Wong S H,Hamel L,Chevalier S,et al.Endoglin expression on human microvascular endothelial cells association with betagly can and formation of higher order complexes with TGF-beta signaling receptors[J].Eur J Biochem,2000,267(17):5550-5560.
[16] Wang J M,Kumar S,Pye D,et al.Breast carcinoma:comparative study of tumor vasculature using two endothelial cell markers[J].J Natl Cancer Inst,1994,86(5):386-388.
[17] Miller D W,Graulich W,Karges B,et al.Elevated expression of endoglin,a component of the T GF-β-receptor complex,correlates with proliferation of tumor endothelial cells[J].Int J Cancer,1999,81(4):568-572.
[18] Li D Y,Sorensen L K,Brooke B S,et al.Defective angiogenesis in mice lacking endoglin[J].Science,1999,284(5419):1534-1537.
[19] Dickson M C,M artin J S,Cousins F M,et al.Defective haematopoiesis and vasculogenesis in transforming growth factor-beta 1 knock out mice[J].Development,1995,121(6):1845-1854.
[20] Senger D R,Galli S J,Dvo rak A M,et al.Tumo r cells secrete a vascular permeability factor that promotes accumulation of ascites fluid[J].Science,1983,219(4587):983-985.
[21] Leung D W,Cachianes G,Kuang W J,et al.Vascular endothelial g rowth factor is a secreted angiogenic mitogen[J].Science,1989,246(4935):1306-1309.
