短刺小克银汉霉AS 3.153菌株对安非他酮的代谢转化
2010-05-14吴艳平何艳艳齐秀兰
吴艳平,何艳艳,齐秀兰,徐 威,陈 羽,孙 璐
(沈阳药科大学1.分析化学教研室,2.微生物学教研室,3.高等职业技术学院,辽宁沈阳 110016)
盐酸安非他酮(1-(3-氯苯基)-2-[(1,1-甲基乙基)氨基]-1-丙酮盐酸盐)(amfepramone)属氨基酮类抗抑郁药,具有良好的治疗作用和较小的不良反应,同时也是全球第一个非尼古丁类似物的戒烟药[1],该药在人和动物体内的代谢途径主要包括叔丁基羟基化、苯环羟基化、羰基还原及进一步与葡萄糖醛酸或硫酸结合[2]。其中叔丁基羟基化安非他酮结构中的羟基会迅速与羰基成环,形成代谢产物2(metabolite 2,M2),经确认为吗啉环羟基化安非他酮(morpholine-hydroxyamfepramone),这一代谢反应在人体中较为少见,具有一定的研究价值。虽有文献报道M2的合成工艺[3],但操作复杂,副产物较多。小克银汉霉菌属中的一些菌株具有与哺乳动物细胞色素P450同工酶非常类似的代谢酶类,可以进行某些与哺乳动物相似的Ⅰ相和Ⅱ相药物代谢反应[4-5]。本研究从小克银汉霉菌属真菌中筛选出4株最佳菌株,并在采用此菌株优化最佳转化条件的同时探讨用其制备M2纯品的可能性。
1 材料与方法
1.1 菌种和培养基
短刺小克银汉霉(Cunninghamella blakesleana AS 3.153)、刺孢小克银汉霉(C.echinulata AS 3.2004)、雅致小克银汉霉(C.elegans AS 3.156)和雅致小克银汉霉(C.elegans AS 3.2028)由沈阳药科大学微生物学教研室提供。
斜面培养基为马铃薯蔗糖琼脂培养基,成分为:蔗糖1.5 g,琼脂2.0 g,马铃薯20 g 和蒸馏水100 ml。种子和转化培养基:葡萄糖 2.0 g,酵母膏 0.5 g,蛋白胨0.5 g,氯化钠 0.5 g,磷酸氢二钾 0.5 g 和蒸馏水100 ml,pH调至 8.0。培养基均于 115℃ 灭菌30 min。
1.2 药品和仪器
安非他酮由沈阳华泰药物研究有限公司提供,纯度>99.8%。液相色谱-多级质谱分析所用试剂均为色谱纯,其他试剂均为市售生物化学试剂和分析纯试剂。
Agilent 1100 SL型液相色谱-质谱联用仪(Agilent公司,美国),KQ-300DA型数控超声波清洗器(昆山市超声仪器有限公司),LD5-2A低速离心机(北京医用离心机厂),XK96-A快速混匀器(姜堰市新康医疗器械有限公司),DHG-9070电热恒温鼓风干燥箱(上海申贤恒温设备厂),JA2002电子天平(上海精天电子仪器有限公司),HH-B 11-80S电热恒温培养箱(天津市实验仪器厂),MJ-250I霉菌培养箱(上海一恒科技有限公司),银州牌280型手提式压力蒸汽消毒器(辽宁省铁岭市医疗器械总厂),TG 328B豪华型超净工作台(上海智城分析仪器制造有限公司)和Strata C18-E固相萃取柱(菲罗门公司,美国)。
1.3 孢子和种子的制备
将4℃保存的4个菌株分别接种于相应的斜面培养基上,置于28℃恒温培养7 d,得到菌丝生长旺盛、孢子丰富的培养物。用无菌接种环取一环含有大量孢子的菌丝体,仅将孢子接入种子瓶(250 ml三角瓶内装50 ml培养基),于28℃振荡培养24 h,得到种子培养物。
1.4 安非他酮的微生物转化和转化液的收集
以5%的量将4种种子培养物转至转化瓶(100 ml三角瓶内装20 ml培养基),采用上述振荡培养条件,预培养24 h后加入安非他酮无菌水溶液,使安非他酮终浓度达到0.1 g·L-1,转化反应持续168 h。取转化培养物上清液,置-20℃冷冻待测。另设3组分析对照样品:对照1(转化菌株+培养基),排除转化菌株的自身代谢产物和培养基残留成分的干扰;对照2(安非他酮+培养基),考察转化液中是否存在非微生物引起的安非他酮分解产物,同时确定安非他酮在液相色谱分析时的出峰时间;对照3(纯培养基),消除培养基成分的影响。
1.5 分析样品制备和液相色谱-质谱分析条件
将冷冻的安非他酮微生物转化样品及对照样品在室温下融化。用2 ml甲醇和2 ml水依次活化固相萃取小柱,然后取300 μl转化液,与700 μl水混合后通过固相萃取小柱,用1 ml水洗涤,再用1 ml甲醇洗脱,将洗脱液在40℃氮气流下吹干,100 μl流动相溶解,20 μl进样进行液相色谱-多级质谱分析。
色谱柱为 Agilent Extend C18柱(150 mm ×4.6 mm,5 μm);流动相为甲醇-水-甲酸(35∶65∶0.2,V/V/V);流速为0.5 ml·min-1;室温。质谱电喷雾离子化源(ESI),正、负离子检测方式。氮气雾化气压力 30 psi,氮气干燥气流速 8.0 L·min-1,源电压4.0 kV,毛细管温度325℃,碰撞能量 1.0 V。
1.6 转化菌株的筛选
采用液相色谱-质谱测定经4种小克银汉霉对安非他酮的转化液中的安非他酮及其转化产物,以总产率即菌株产生的所有转化产物的峰面积占所有转化产物与原形药物峰面积之和的百分比来表示菌株的转化能力。
1.7 安非他酮的微生物转化条件优化
通过菌株筛选实验,确定采用短刺小克银汉霉AS 3.153作为模型微生物。为了进一步制备转化产物M2,优化短刺小克银汉霉AS 3.153对安非他酮的转化条件。
1.7.1 转化条件的单因素考察实验
底物终浓度分别为 0.025,0.05,0.1 和 0.2 g·L-1,转化时间分别为72,96,120,144 和168 h,初始 pH 值分别为6.0,6.5,7.0,7.5,8.0 和 8.5的单因素优化实验,确定最佳转化条件及正交试验的因素和水平。
1.7.2 转化条件的进一步优化
根据文献[6],培养基初始pH、底物浓度、转化时间和微生物4个因素对安非他酮转化率有影响。在单因素考察的基础上,每个因素又各自选取了3个水平(表1),忽略各因素间的相互作用,采用L9(34)正交试验设计(表2)确定最佳转化条件。
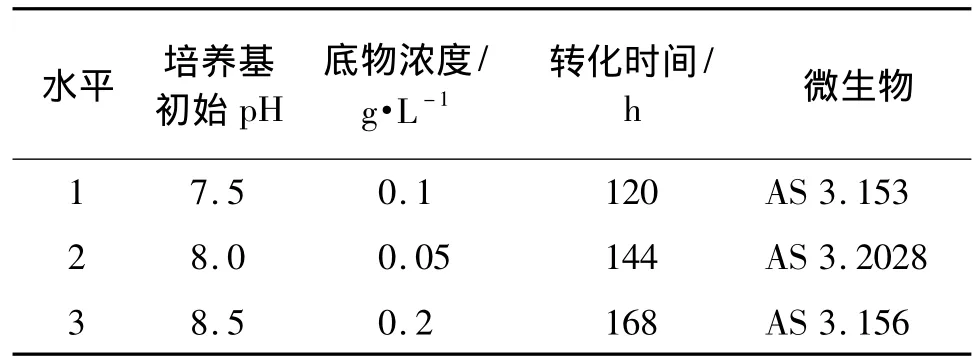
表1 安非他酮优化转化条件的4个因素及其3个水平Tab.1 Factors and levels of amfepramone transformation conditions
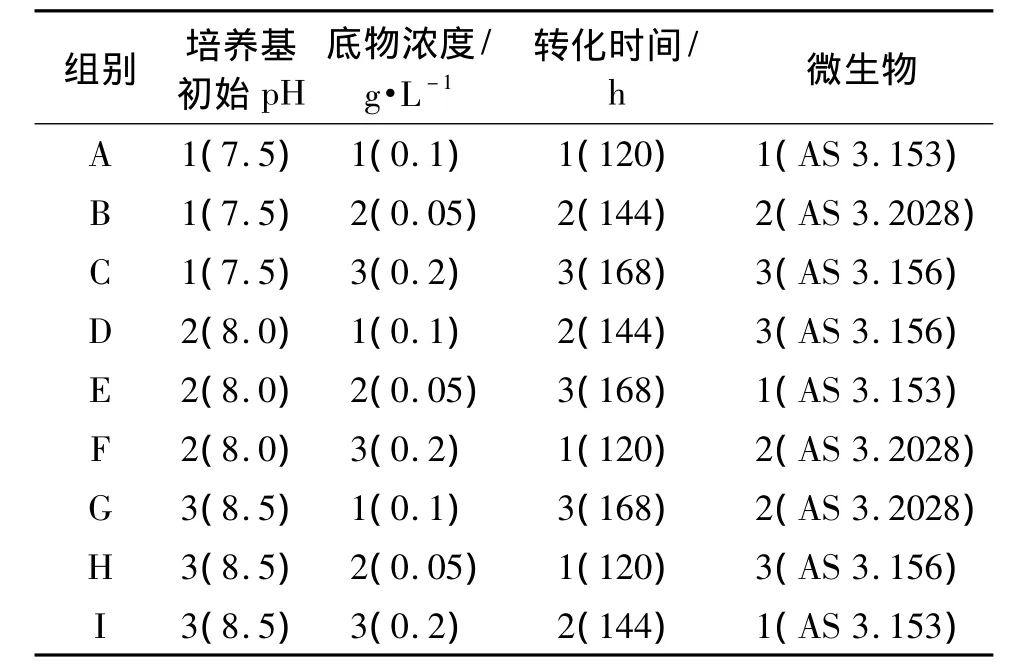
表2 安非他酮转化条件考察的正交实验设计Tab.2 Orthogonal expreiment of amfepramone transformation conditions
1.8 统计学分析
根据文献和预实验,各因素间的相互作用可以忽略。根据预实验挑选的4因素和各因素的3水平,采用L9(34)正交试验设计优化最佳转化条件。
2 结果
2.1 安非他酮代谢产物的高效液相-多级质谱分析
安非他酮的总离子流和选择离子流色谱图见图1,安非他酮及其转化产物M1,M2和M3的一级质谱图见图2,安非他酮及M1,M2和M3的二级和三级质谱图见图3。结果显示,每个菌株的3组对照样品对转化产物和残留底物的分析检测均无干扰。在(+)ESI-MS一级全扫描质谱条件下,安非他酮主要生成质荷比(mass-to-charge ratio,m/z)为240([M+H]+)(图2A)的准分子离子。采用电喷雾离子阱质谱技术选择性地对其进行二级质谱分析,安非他酮主要脱去叔丁基,生成m/z为184的碎片离子(图3A)。
以安非他酮底物对照样品(对照2)的总离子流色谱图(total ion current,TIC)(正离子检测)为对照(图1A1),在短刺小克银汉霉菌转化样品的色谱图中几乎没有检测到安非他酮的原形药物(m/z=240),而是发现了2个准分子离子m/z为256([M+H]+)的M1(图2B)和M2(图2C)(图1B1)。根据药物代谢的一般规律,转化产物的准分子离子比母体药物大16 u,可能为单羟基化代谢产物。对M1进行二级全扫描质谱分析,主要生成碎片离子m/z 200和m/z 182 u(图3B)。其中碎片离子m/z 200比母离子小56 u,为脱去叔丁基后生成的碎片离子,质谱断裂方式与母体药物一致,且m/z 200比m/z 184大16 u,表明羟基化位点发生在安非他酮脱叔丁基后的剩余部分上;碎片离子m/z 182为M1脱叔丁基后进一步脱水生成。M1的质谱数据与文献[7]一致,推测M1为苯环单羟基化安非他酮。在M2的二级全扫描质谱中,主要生成碎片离子m/z 238(图3C)和m/z 184(响应值约为基峰m/z 238的1%)。其中碎片离子m/z 184与母体药物脱去叔丁基后的碎片一致,推测羟基化位点发生在叔丁基上;碎片离子m/z 238为M2脱水生成。将M2进行分离纯化,根据质谱数据并结合NMR方法(图略),确证代谢产物M2为吗啉环羟基化安非他酮。

图1 高效液相色谱-质谱总离子流(TIC)和选择离子监测(EIC)模式下安非他酮的底物的对照品(A)和经短刺小克银汉霉AS 3.153转化的转化样品(B)的色谱图.1.正离子检测方式(+MS),2.负离子检测方式(-MS).Fig.1 Chromatograms of amfepramone substrate control sample(A)and transformed amfepramone sample from C.blakesleana AS 3.153(B)by total ion current(TIC)scan mode and selected ion monitoring(SIM)scan mode.
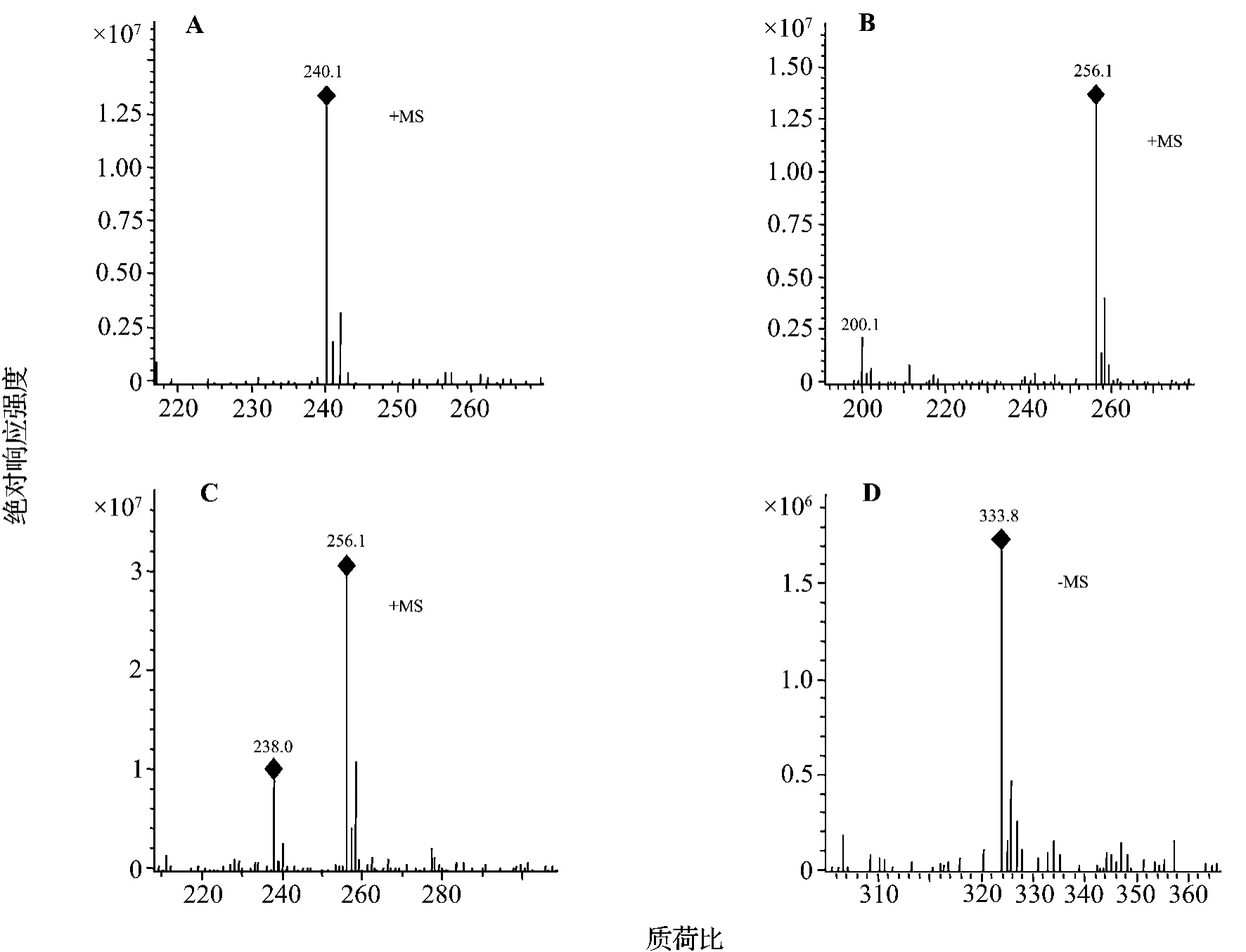
图2 安非他酮(A)及其代谢产物M1(B),M2(C),M3(D)的一级质谱图.+MS:正离子检测方式;-MS:负离子检测方式.Fig.2 Full scan MS of amfepramone(A)and its metabolites M1(B),M2(C)and M3(D).
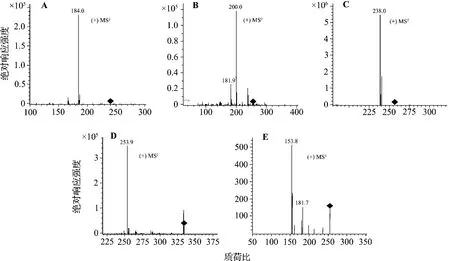
图3 安非他酮(A)及其代谢产物M1(B),M2(C),M3(D)的二级质谱和M3的三级质谱.MS2:二级质谱.MS3:三级质谱.(+)正离子检测方式;(-):负离子检测方式.Fig.3Full scan MS2of amfepramone(A),M1(B),M2(C),M3(D)and MS3of M3(E).
以安非他酮底物对照品(对照2)的TIC色谱图(负离子检测)为对照(图1A2),在短刺小克银汉霉菌转化样品的色谱图中还检测到准分子离子m/z 334([M-H]-)(图2D)的代谢产物M3(图1B2)。对其进行二级全扫描质谱分析,主要生成减少了80 u的碎片离子m/z 254(图3D),而 m/z 254为单羟基化安非他酮的负离子扫描结果,推测M3为单羟基化安非他酮的硫酸结合物。对m/z 254进行三级全扫描质谱分析,主要生成碎片离子m/z 154和m/z 182(图3E),其中m/z 154为m/z 254脱去叔丁胺基乙基后生成的碎片离子,m/z 182为脱去叔丁胺基后生成的碎片离子,推测羟基化位点发生在苯环上。而且M3的质谱断裂方式与文献[2]一致,可推测代谢产物M3为苯环单羟基化安非他酮的硫酸结合物。综合以上结果,短刺小克银汉霉AS 3.153对药物安非他酮的代谢途径见图4。
2.2 安非他酮转化菌株的筛选
短刺小克银汉霉AS 3.153,刺孢小克银汉霉AS 3.2004,雅致小克银汉霉AS 3.156和雅致小克银汉霉AS 3.2028 4种小克银汉霉菌对安非他酮均具有一定的转化能力,总产率分别为88.0%,78.3%,50.2%和42.7%。其中短刺小克银汉霉AS 3.153的总转化率最高,生成代谢产物M2的比例也最高,故将其作为安非他酮药物代谢研究的体外模型作进一步研究。
2.3 短刺小克银汉霉AS 3.153对安非他酮的转化条件优化
2.3.1 培养基初始pH值对安非他酮转化的影响
微生物转化的实质是进行酶促反应,pH值作为影响药物代谢酶活性的因素同样也影响转化反应的进行程度。转化体系中环境的pH在影响酶分子解离状态的同时也影响了底物的解离状态,通常分子状态的底物更容易透过细胞膜进入菌体发生转化;pH过高或过低均影响酶蛋白的构象,甚至使其丧失活性。培养基在初始 pH 值为 6.0,6.5,7.0,7.5,8.0和8.5 时,总产率分别为 17.4%,60.7%,77.1%,81.5%,88.0%和 85.0%,其中 pH 8.0 时转化率达到最大值88%。
2.3.2 底物浓度对安非他酮转化的影响
安非他酮浓度对短刺小克银汉霉AS 3.153转化安非他酮的产率影响较大。安非他酮终浓度为0.025,0.05,0.1 和 0.2 g·L-1时的短刺小克银汉霉对安非他酮的转化产率分别为64.1%,67.5%,87.0%和 73.7%;其中当安非他酮浓度为 0.1 g·L-1时,代谢物M2产率达到最大值87%。
2.3.3 转化时间对安非他酮转化的影响
微生物转化安非他酮的主要产物M2在不同时间的累积量差异较大。转化时间为168 h时,安非他酮几乎完全被转化,M2的转化率最大。

图4 安非他酮在微生物中的化学转化过程.M1,M2,M3和M4为安非他酮的代谢产物.M4为本实验未直接检测的代谢产物.Fig.4 Metabolic pathways of amfepramone in microorganism.
2.3.4 正交实验对安非他酮的转化条件的进一步优化
忽略各因素间的相互作用,正交实验设计结果如表3所示。从表中可以看出,培养基初始pH因素中为最大,即培养基初始pH因素中3水平的平均转化率最高。同理来选择底物浓度、转化时间和微生物3因素的最优水平,得安非他酮的最佳转化条件为采用短刺小克银汉霉AS 3.153作为模型微生物,培养基初始 pH 8.5,底物浓度 0.1 g·L-1和转化时间为168 h。
3 讨论
自提出哺乳类动物药物代谢的微生物模型概念以来,微生物转化作为一种平行于人体药物代谢的手段而发展起来,为现代药理学与毒理学的药物代谢研究提供了一些有用的方法。
在文献[7]的基础上,本实验筛选了小克银汉霉菌属的4种菌株,确定以短刺小克银汉霉AS 3.153作为模型微生物。短刺小克银汉霉AS 3.153主要将安非他酮转化为苯环羟基化安非他酮(M1)、吗啉环羟基化安非他酮(M2)和苯环羟基化安非他酮的硫酸结合物(M3),总转化率达到88%。本研究检测到的代谢产物与文献中报道的人体内安非他酮代谢产物结构相同,可认为该菌株是研究安非他酮代谢反应的适宜体外模型。但安非他酮在人体内的Ⅱ相代谢产物除了硫酸结合物外,还有葡萄糖醛酸结合物。而在微生物模型中只找到硫酸结合物,说明微生物转化和哺乳动物代谢之间仍存在着一定的种属差异,造成这种差异的原因可能是用于安非他酮代谢研究的短刺小克银汉霉AS 3.153体内缺少与葡萄糖醛酸结合反应相关的代谢酶或辅助因子。
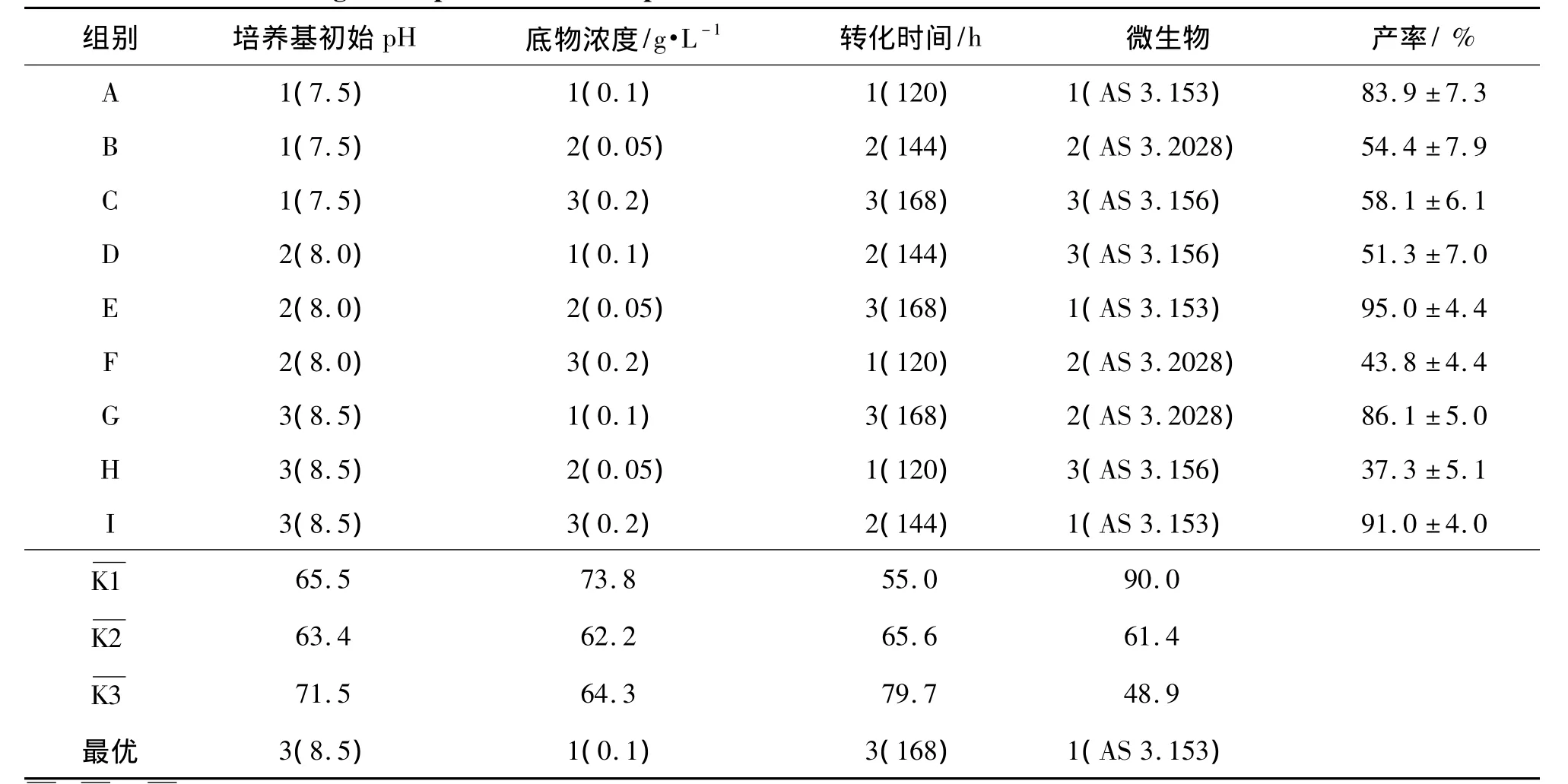
表3 正交实验设计的安非他酮转化条件Tab.3 Results of orthogonal experiment of amfepramone transformation conditions
为了制备代谢产物M2,本实验采用单因素考察实验和正交实验两种方法来确定安非他酮微生物转化的最佳条件。实验结果表明,除培养基的初始pH有微小差别外,其他最佳条件均一致。
与哺乳动物生物转化相比,微生物转化具有很强的专一性,能够用来进行特定的药物代谢反应[8],此外,微生物转化法还具有周期短、成本低[9]、易调节和易放大等特点[10-11]。本研究筛选出的短刺小克银汉霉AS 3.153可以作为研究人用药物代谢的体外模型,同时,还可以采用优化后的转化条件制备M2纯品。
[1] 陈 科,胡艾希,陈声宗,曹 高,吴红岩.盐酸安非他酮的合成研究[J].中国药物化学杂志,2003,13(05):286-287,296.
[2] Petsalo A,Turpeinen M,Tolonen A.Identification of bupropion urinary metabolites by liquid chromatography/mass spectrometry[J].Rapid Commun Mass Spectrom,2007,21(16):2547-2554.
[3] 胡艾希,吴红岩,陈 科,杨林涛,周 冰.盐酸2-芳基-3,5,5-三甲基-2-吗啉醇的合成[J].应用化学,2005,22(3):343-345.
[4] Huang HH,Chen XY,Zhong DF.Selective biotransformation of propafenone by Cunninghamella blakesleana[J].Asian J Drug Metab Pharmacokinet,2001,11(1):37-43.
[5] Zhang D,Yang Y,Leakey JE,Cerniglia CE.PhaseⅠand phaseⅡenzymes produced by Cunninghamella elegans for the metabolism of xenobiotics[J].FEMS Microbiol Lett,1996,138(2-3):221-226.
[6] 刘 磊,黄海华,孙 璐,钟大放.短刺小克银汉霉菌对维拉帕米转化的能力[J].中国药理学与毒理学杂志,2002,16(4):292-298.
[7] Taylor LCE,Singh R,Chang SY,Johnson RL,Schwartz J.The identification of in vitro metabolites of bupropion using ion trap mass spectrometry[J].Rapid Commun Mass Spectrom,1995,9(10):902-910.
[8] 黄海华,陈笑艳,崔洪霞,钟大放.采用微生物转化法合成5-羟基普萘洛尔[J].药物生物技术,2001,8(5):268-271.
[9] Asha S,Vidyavathi M.Cunninghamella-a microbial model for drug metabolism studies- a review[J].Biotechnol Adv,2009,27(1):16-29.
[10] 黄海华,崔洪霞,钟大放,杜宗敏.利用微生物转化模型研究苯丙哌林的代谢产物[J].中国药理学与毒理学杂志,2001,15(4):297-301.
[11] Sun XH, Man F, Pang LY, Gao GH,Li XQ,Qi XL,et al.Fungal biotransformation of mosapride by Cunninghamella elegans[J].J Mol Catal B:Enzymatic,2009,59(1-3):82-89.
