可溶性玉米须多糖的提取与纯化
2010-04-28安徽农业大学生命科学学院王在贵刘朝良吴晓峰方杨武
安徽农业大学生命科学学院 王在贵 刘朝良 吴晓峰 方杨武
玉米须为禾本科玉属植物玉米(Zea mays L.)的花柱及柱头,其味淡、性平,有清血热、利尿等功效(南京药学院,1980)。我国是养殖大国,玉米作为能量饲料在我国的种植面积逐年扩大,其副产品玉米须产量也越来越大,因此,利用玉米须提取可溶性多糖,有利于玉米须资源的充分利用,提高经济效率。郑鸿雁等(2004)研究发现,玉米须多糖具有调节小鼠体液免疫功能和增强小鼠巨噬细胞吞噬功能的作用。目前,可溶性玉米须多糖因其具有多种生物活性而逐渐引起关注,本试验对产自安徽亳州的玉米须多糖进行提取纯化,为其实际开发与利用提供一定的依据。
1 材料与方法
1.1 材料及主要设备 玉米须购自合肥市为民大药房。
分光光度计(VIS-7220,北京瑞利分析仪器有限公司),可调恒温水浴锅(HH-5,江苏国顺仪器厂),高速离心机(TDL-60B,上海安言科学仪器厂),电热恒温鼓风干燥箱(DHG-9425A型),1/1000台式天平(JTY-架盘药物天平,上海医用激光仪器厂),标准葡萄糖,苯酚,浓硫酸(98%分析纯),95%乙醇,丙酮,乙酸乙脂等。
1.2 试验方法
1.2.1 标准曲线的绘制 取24只20 mL试管分为3组,编号,分别加入一定量的蒸馏水和葡萄糖溶液,然后在每只试管中加入6%的苯酚溶液1 mL,将各试管仔细摇匀后,向每试管中加入5 mL 98%浓硫酸,静置20 min后摇匀,在40℃的恒温水浴锅里静置15 min后490 nm处测定OD值。做3个平行试验,取平均值。计算葡萄糖浓度的线性范围,以糖含量为横坐标,OD490为纵坐标制作线性关系图,得出标准曲线方程:y=0.003x,R2=0.999。
1.2.2 玉米须的提取过程 玉米须→烘干→研磨→微沸浸泡→过滤→浓缩→乙醇沉淀→静置→离心→无水乙醇、丙酮、乙酸乙脂交替洗涤→乙醇沉淀→烘干→得玉米须粗成品(王在贵等,2008;金丽梅等,2007)。
具体操作:将玉米须在烘箱中50℃干燥后研磨成粉末状保存。称取5 g玉米须粉末于杯中,加50 mL蒸馏水置于60℃水浴锅里浸泡2 h,用四层纱布过滤,滤液继续在60℃水浴锅中浓缩至16 mL,然后加入2.5倍(即40 mL)95%乙醇静置充分沉淀8 h。用离心机5000 r/min离心5 min后弃上清液。在沉淀中加入丙酮洗涤后离心2次,然后继续分别加入无水乙醇和乙酸乙脂洗涤后离心2次,将最后所得的沉淀放入表面皿中于50℃烘箱中烘12 h,即得到60℃条件下提取的玉米须多糖粗产品。
1.2.3 多糖含量的测定 具体操作:取0.025 g多糖粗制品,研磨后加少量水溶解,转入25 mL容量瓶中定容。取1 mL样品液稀释10倍(加水9 mL)再取稀释后的样品液2 mL于试管中,加入6%的苯酚1 mL,再加浓硫酸5 mL,静置10 min摇匀。将上述试管放入恒温水浴锅中水浴(40℃),15 min后取出。在490 nm处测OD值,作3个平行,取平均值,利用标准曲线带入所测光度密值换算出多糖含量(张惟杰,1987),按以下公式分别计算相关提取指标数值。
多糖含量(μg/g)=查标准曲线(μg)×稀释倍数/样品的质量(g);
多糖提取率(%)=多糖干重(g)/玉米须干重(g)×100%;
多糖得率(%)=多糖含量(μg/g)×多糖提取率×100%。
1.2.4 多糖的初步纯化 TCA法除蛋白:称取1.5 g粗糖,加30 mL纯水溶解,再分别称取三氯乙酸0.3 g各加水10 mL配成浓度为3%的TCA溶液。分别取10 mL粗糖溶液加入上述TCA溶液中,静置5 h后离心,分别加入无水乙醇至含醇量达80%,静置过夜,再次离心后弃去上清液,取出沉淀50℃烘箱过夜即得初步纯化的产品。
1.2.5 酶法助提玉米须渣中的多糖 称取煮过的玉米须提取残渣5 g(干重),取8支试管,编为1~8号加酶液,处理温度为37℃,处理时间为180 min(魏静娜等,2008),处理后的样品用四层纱布过滤,其他步骤按1.2.2的方法进行。
1.2.6 玉米须多糖的纯度鉴定 提取的粗多糖用TCA法除多糖结合蛋白后,配置成0.1 mg/mL溶液用紫外扫描检验TCA法除蛋白的效果,得扫描图谱(刘春兰等,2009)。
2 结果与分析
2.1 影响多糖提取的因素
2.1.1 不同温度对粗糖提取的影响 重复1.2.1步骤,改变玉米须多糖的提取温度。分别在30、50、70℃和90℃条件下提取玉米须多糖粗产品。根据1.2.2测定不同提取温度下所得到多糖的含量,结果见图1。由图1可以看出,在80℃时,从玉米须中提取多糖的总含量最高。
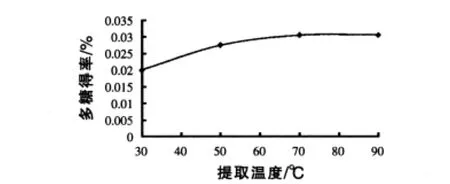
图1 温度对玉米须粗糖提取的影响
2.1.2 提取时间不同对粗糖提取量的影响 分别在 100 ℃水中浸泡 70、80、90 min和 100 min;用四层纱布过滤,再把所的滤液离心8 min(5000 r/min)取上清液在100℃水浴锅中浓缩至16 mL,其他重复1.2.2步骤,根据1.2.3测定在不同提取时间下所得到多糖的含量,结果见图2。由图3可以看出,在80℃提取时间为80 min条件下,提取多糖得率最高。
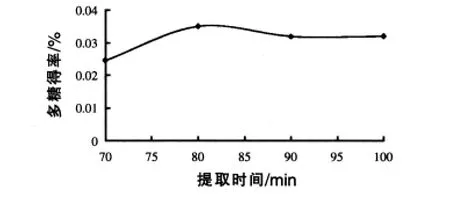
图2 提取时间对玉米须粗糖提取的影响
2.1.3 不同乙醇体积对粗糖提取的影响 80℃水中浸泡80 min,用四层纱布过滤,再把所得滤液离心8 min(5000 r/min)取上清液在80℃水浴锅中浓缩至16 mL,然后向其中分别加入2、2.5(即 40 mL)、3倍,95%乙醇静置充分沉淀 8 h。其他重复1.2.2步骤,根据1.2.3测定在不同体积的95%乙醇沉淀时所得到多糖的含量,结果见图3。由图3可以看出:在80℃提取时间为80 min条件下,用2.5倍(40 mL)的95%乙醇沉淀时,从玉米须中提取多糖得率最高。
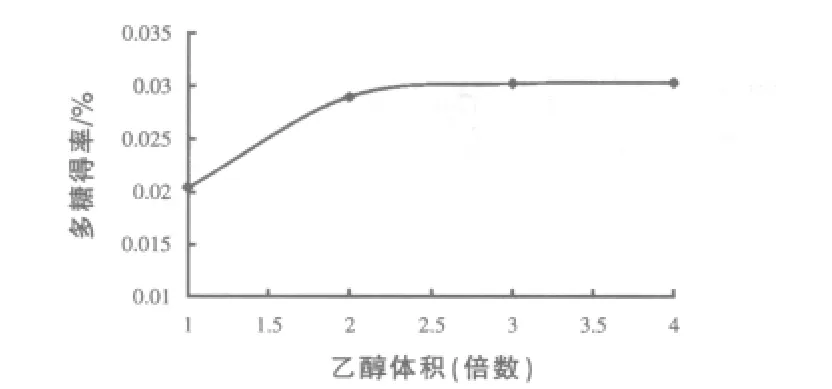
图3 不同乙醇体积对玉米须多糖提取的影响
2.1.4 不同水料比对玉米须多糖得率的影响 由图4可以看出,最佳的加水倍数为18倍。试验结果说明水提醇沉法提取玉米须多糖,最佳提取条件为80 min、80℃、18倍的水料比,用2.5倍体积多糖液的乙醇醇沉。
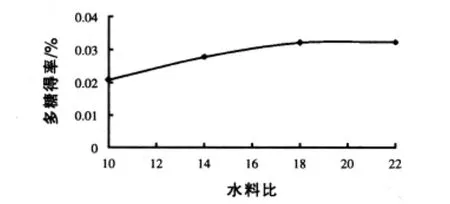
图4 不同水料比对玉米须多糖得率的影响
2.2 TCA法除蛋白结果 结果测得未除蛋白质前测得多糖的糖OD490为1.916,蛋白质OD595为1.424。
从表1可以看出,当三氯乙酸溶液浓度为3%时,多糖的损失不是很高,且蛋白除得较充分,因此,合适的TCA浓度为3%。

表1 TCA法除蛋白质结果
2.3 酶法助提玉米须渣中的多糖结果 提取多糖后,称出糖重量、测糖纯度,结果见表2。由表2可以看出,β-葡聚糖酶用量为7 mL时,酶助提效果最好。
2.4 玉米须多糖紫外扫描结果 从图5可以看出,在280 nm附近不存在明显的吸收峰,说明糖结合蛋白基本除尽。
3 讨论与小结
本试验提取过程参照了王在贵等(2008)茶多糖的提取方法,通过比较发现水料比对玉米须多糖的提取结果影响较大。由于玉米须的胞外多糖比胞内多糖含量多,胞内多糖的提取率和细胞壁破碎程度有关,如果酶解细胞壁的方法充分破碎细胞,就能有效的提取胞内多糖。紫外扫描结果在260~280 nm时曲线下降缓慢的现象,可能由于样品中含有部分核酸干扰吸光度数值而导致曲线下降缓慢。以上试验结果表明,玉米须多糖提取的最佳条件为:80 min、80 ℃、18倍的水料比、2.5倍体积乙醇沉淀效果最佳;3%浓度的TCA溶液除蛋白质效果最好;通过紫外扫描检测纯化样品表明糖结合蛋白基本除尽。
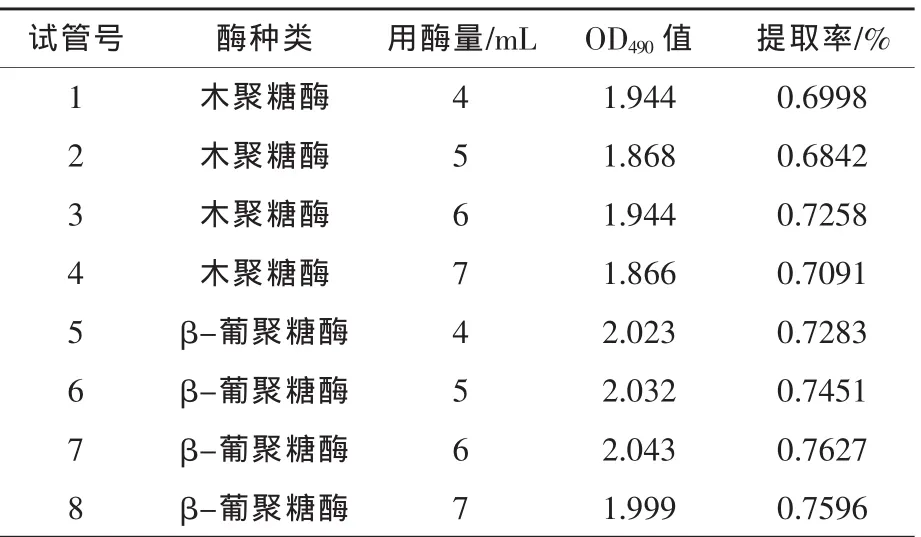
表2 酶法助提玉米须多糖试验结果
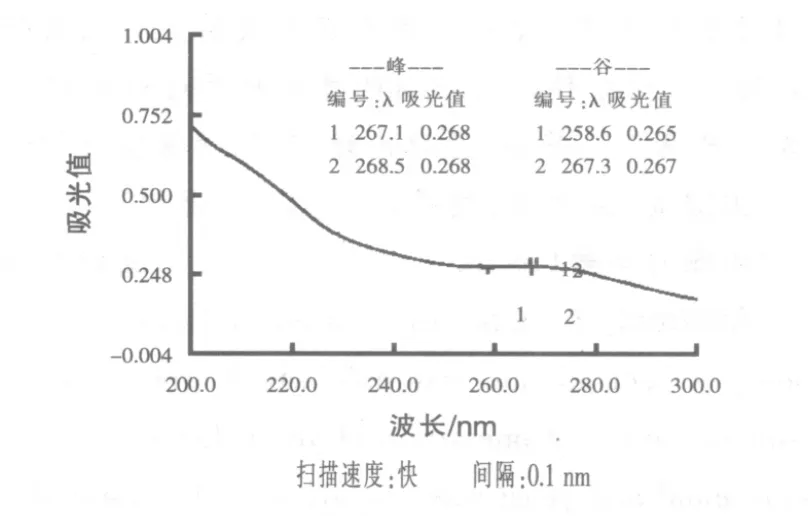
图5 玉米须多糖(0.1 mg/mL)的紫外全波段扫描
[1]金丽梅,刘伟.水提醇沉淀法玉米须多糖的提取工艺研究[J].黑龙江八一农垦大学学报,2007,19(5):62 ~66.
[2]刘春兰,邓义红,杜宁,等.新疆雪莲水溶性多糖的分离纯化及组成分析[J].天然产物研究与开发,2009,21:99 ~103.
[3]南京药学院.中草药学[M].南京:江苏科学技术出版社,1980.167.
[4]王在贵,刘朝良,杨世高,等.茶多糖的提取与初步纯化[J].中国饲料,2008,10:38 ~40.
[5]魏静娜,朱宏吉,林强.纤维素酶和超声辅助提取玉米须多糖[J].化学工业与工程,2008,25(2):146 ~149.
[6]张惟杰.复合多糖生化研究技术[M].上海:上海科技出版社,1987.251~253.
[7]郑鸿雁,闵伟红,昌友权,等.玉米须多糖调节免疫功能研究[J].食品科学,2004,10:291 ~293.
