动物血中超氧化物歧化酶的提纯及应用
2010-04-25黄建华李晓波邓璞红
黄建华,李晓波,邓璞红
(河南科技学院,河南新乡 453003)
1939年Mann和Keilin[1]首次从牛红细胞中分离出蓝色含铜蛋白质,1969年Mccord和Fridovich[2]发现该蛋白具有催化歧化功能,故将此酶命名为超氧化物歧化酶(Superoxide Dismutase,SOD,EC1.15.1.1),该酶能有效清除体内超氧自由基,具有抗衰老、抗肿瘤、抗辐射、增强人体免疫等功能.有关SOD的研究受到国内外学者的广泛关注,田春美等人[3]对SOD的种类分布、催化、抗氧化机理、结构性质、生产方式、模拟研究及应用等方面做了大量研究,目前在食品、化妆品、临床上有广泛应用,特别近年来,SOD作为日用化工产品和保健食品行业的重要添加剂成为人们的研究热点.
SOD的制备方法因原料不同而异,目前制备SOD的原料有动物血液、微生物和动植物组织.纵观大量文献发现,从植物组织中提取SOD的工艺已经成熟且广泛应用,如从大蒜、芦荟、唇形科芳香植物等中提取SOD[4-7].微生物方面已从啤酒废酵母中提取SOD[8],发酵法生产SOD在乳酸菌发酵[9]、枯草杆菌发酵[10]等一些特殊性质的细菌等方面取得了很大突破,但还存在很多潜力领域有待开发.我国从80年代起,相继从人、牛、猪、鸭、马、牦牛、鹿血液中提取SOD[11-17],但很多屠宰场因技术问题浪费了很多血源,为了更好地利用动物血液,促进养殖业的发展,本文主要探讨了动物血液SOD的不同制备方法及在食品中的广泛应用、存在问题.
1 SOD的分类
SOD是一种广泛存在于动植物及微生物体中的金属酶,依据金属辅基的不同分类如下[18]:第一类,CuZn-SOD,是最常见的一种,呈蓝绿色,有两条肽链组成,每条肽链含有铜、锌原子各一个,主要存在于真核细胞的细胞浆内,如动物血液、肝和植物体内.第二类,Mn-SOD,纯品呈粉红或紫红色,由两条或四条肽链组成,主要存在于原核细胞体、真核细胞的细胞浆和线粒体内,如人和狒狒的肝细胞的胞液.第三类:Fe-SOD,纯品呈黄色或黄褐色,由两条肽链组成,多数情况下一个二聚体中含一个Fe原子,主要存在于原核细胞内,如绿菌属、脱硫弧菌属等.Sa-Ouk Kang等人最近又从链霉菌Streptomyces spp.和S.coelicotor中发现了两种新的SOD:Ni-SOD和Fe/Zn-SOD,它们均为四聚体,表观分子量分别是13 KD和22 KD,它们之间没有免疫交叉反应[19-21].
2 催化抗氧化机理
SOD酶作用的底物是超氧阴离子自由基(O2.-),它带一个负电荷,又有一个未成对的电子,在不同条件下,氧负离子既可作还原剂变成O2,又可作氧化剂变成H2O2,H2O2在过氧化氢酶(Catalase,CAT)的作用下,生成H2O和O2.其作用机理如下:
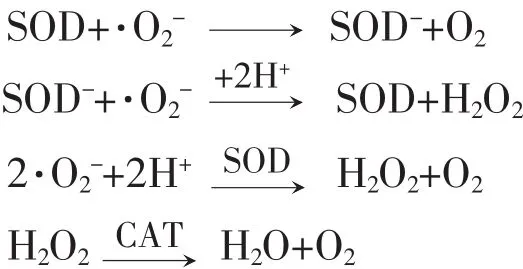
3 提纯工艺中关键操作的探讨
从动物血中提纯SOD的方法很多,每种方法中操作环节各有异同,提取率差异很大,这直接关系到SOD价值利用,本文从所用试剂的安全性、采取方法对提取率的影响、程序繁琐程度等方面对其进行了探讨.
3.1 分离红细胞
红细胞的分离一般采取三种方法,其一不加抗凝血剂,直接加2倍的0.9%的氯化钠洗涤3遍,倾干.加入与血块等体积的去离子水,机械搅拌30min,使成溶血液,过滤,收集滤液.其二直接加萃取剂柠檬酸和柠檬酸三钠(1∶4.5)混合,调节pH7.6,无需另加抗凝剂,取0.34倍血块量的抗凝血剂与血块等体积的去离子水超声破碎,萃取过程中保持pH 7.4~7.8对提取率的提高是很关键的.其三加抗凝血剂,之后经0.9%氯化钠离心洗涤两次,加等体积去离子水超声破碎,经比较发现,加抗凝血剂的活性提取率是不加抗凝血剂萃取的1.33倍,超声15min破碎后SOD总活性比机械搅拌高1.2倍,时间仅15min,缩短了生产周期.
另外还有两种方法:冻融处理和溶菌酶处理.前者是快速冷却破坏细胞而使CuZn-SOD释放出来,此法易使SOD的活性损失,且设备投入大,不适合大规模生产.后者用商品溶菌酶经济成本太高,若用蛋清代替溶菌酶,效果虽基本不变,但纯蛋清的获取,增加了过程的复杂性.
3.2 除杂蛋白、沉淀得粗品
SOD是酸性蛋白质,较稳定,保守性强,对环境pH、温度适应范围广,它在55~65℃下一定时间内活性变化不大,热变时间一般在10~20min.从目前研究看,各种血源处理时的热变温度和时间归纳如表1.试验表明,热变性过程中加激活剂3%或15%CuCl2比不加激活剂的比活提高了1.8倍,因此针对不同的动物血,可在上述范围内调节参数,减少探索程序.

表1 不同动物血的热变温度和时间
除杂蛋白通常加入0.25血块体积的预冷(0~4℃)95%乙醇和0.15体积的预冷氯仿,搅拌15min,3 000 r/min冷冻离心30min,收集上清液,再向上清液中加入等体积的冷丙酮,静置,离心收集沉淀.把沉淀溶于0.05mol/L的pH=7.6的磷酸氢钾缓冲液中,之后添加1.0mL0.3mol/L氯化铜,55~65℃恒温热变性,然后迅速冷却,再用冷丙酮离心收集沉淀,最后用无水丙酮脱水,真空干燥即得粗品.由于氯仿是毒害试剂,2003年王仲礼[22]探索了不加氯仿的新工艺,这种新工艺不使用氯仿、乙醇等贵重、有害的有机溶剂,无需加入抗凝剂,而且生产过程所使用的丙酮液可以回收2%以上.这种方法更符合安全生产的要求,且周期短、收效高,适合大规模生产.
3.3 纯化得精品
这一环节操作基本相同,CuZn-SOD粗品用尽量少的去离子水溶解或者直接用磷酸钾缓冲液溶解,装入带盖塑料瓶,离心30min,除去不溶性蛋白.上清液置于透析袋中真空动态透析,得到透析液.将透析液加到用2.5mmol/L的pH=7.6的磷酸钾盐缓冲液平衡好的DEAE-SephadexA50柱上吸附,用2.5~5.0mmol/L的pH=7.6的磷酸钾盐缓冲液进行梯度洗脱,收集具有SOD活力的洗脱液,超滤浓缩后,冷冻干燥得到CuZn-SOD精品.此操作中注意透析在0~4℃下操作,控制好上样流速是提高得率的关键.
3.4 活性检测
根据原料的不同,常用的SOD活性测定方法如下:邻苯三酚自氧化法[23-24]、羟胺发色法[25]、黄嘌呤氧化酶-细胞色素法[26]、化学发光法[27-28]、电子自旋共振光谱法、氮蓝四唑(NBT)改良法,在实际生产中力求实验设备简单、经济,pH灵敏度要低,对O2-有高度的特异性,以下是对几种方法的比较.
3.4.1 分光光度法 分光光度法包括黄嘌呤氧化酶-细胞色素法和氮蓝四唑(NBT)法.因为cytochrome C易被NADPH还原酶或其他还原剂还原,因此必须考虑对样品的污染因素,而且,此过程需要每隔1.5min就要察看一下,不适合做大批量实验.NBT法的原理是生成不溶于水的蓝色甲臢染料(lmax:560 nm)去和O2-反应.这种染料不溶于水,在做长时程分析时会生成不均一的沉淀物,从而影响实验数据的重现性.为了得到水溶性的甲臢染料,许多改良方法如添加BSA被人们所采用.但是,添加了不必要的蛋白质会使数据分析变得十分复杂,而且NBT会被多种还原剂所还原.NBT法的最大缺点是即使加入过量的SOD也不能获得100%的抑制率,原因是NBT会与黄嘌呤氧化酶直接反应.
3.4.2 邻苯三酚自氧化法 原理:在碱性条件下,邻苯三酚发生自氧化反应,并产生O-,在SOD存在下,自氧化反应受到抑制.该法所用试剂和仪器比较普通,测试方便,灵敏度高,是目前应用最广泛的一种测试方法,但对温度、pH、邻苯三酚浓度、SOD待测液存放时间等诸因素比较敏感,因此测定时要严格控制这些因素.
3.4.3 化学发光法 用于O2-检测的化学发光探针同样也能用于SOD的检测,这种探针分为2种,一种是光泽精,另一种是荧光素衍生物(MCLA).这种化学发光反应对pH有高度的依赖性.例如,光泽精只有在pH 9.0或者更高处会发出强烈的化学光.因此,在生理的pH条件下用这种方法检测SOD是不可行的.另一方面,MCLA在生理条件下能够发出较强的化学荧光,因此可以用于人脑的Cu,Zn-SOD活性的检测.但是,MCLA不适合用作SOD检测的探针,因为它不仅和O2-反应,还会和单质氧反应.而且MCLA与溶解氧反应后会发出化学光,转移的金属离子还会加速氧化反应,该法具有时间响应快、分析精确、灵敏度高、专性强、样品用量少等优点,但需要高灵敏度的精密发光测量仪器.
3.4.4 电子自旋共振(ESR)光谱法 电子自旋共振是一种检测样品中不成对电子特性相关研究的光谱学方法.在室温下,溶液中O2-的ESR信号不能直接被检测出,但能够通过自旋捕捉法间接获得.最常见的诱捕剂是5,5-dimethyl-1-pyrroline N-oxide(DMPO).由于O2-诱捕DMPO会产生一个特殊的光谱图,因此ESR法是O2-检测的方法中特异性最好的一种.然而,DMPO与O2-间的二阶速度常数比O2-自发反应常数相对要低,因此需要向溶液中加入大量的DMPO(如:终浓度为0.45M).这样,每次试验所要用的DMPO将花去大笔的经费.这种方法的另一个问题是在实验中需要一套较为昂贵的ESR设备.
另外还有极谱氧电极法、碱性二甲基亚砜法、碱性连二亚硫酸钠法、化学发光免疫测定法,在实际生产中要力求实验设备简单、经济,pH灵敏度要低,对O2-有高度的特异性,目前从血液中提取的SOD主要采用邻苯三酚自氧化法.
4 SOD在食品领域的应用
SOD是国内外学者公认的最佳自由基清洁剂,它的独特生理性质使其在食品中的应用成为成为众多学者和企事业科研单位的研究亮点.
SOD在食品中的应用与其它抗氧化剂一样,SOD可作为罐头食品、果汁、啤酒等的抗氧化剂,防止过氧化酶引起的食品变质及腐败现象;还可作为水果、蔬菜等的良好保鲜剂.
由于绝大部分蔬菜、水果都含SOD,且水果SOD活性在储藏期内均呈下降趋势.人们就充分利用这些富含SOD的原料开发天然保健食品如芦荟汁、大蒜素、刺梨汁、菠萝汁、麦绿素等.
其它含SOD的食品有:食用菌、扇贝、鸡、调味品等.常见食用菌中猴头菇SOD活性较强,达3 120U/g湿菌丝.灵芝菌活性也很高,已被制成灵芝酒投放市场.常见调味品中,发现酱油、鱼露、豆腐乳中均含SOD样活性物质,其具体性质还有待进一步研究.
另外还可以作为营养强化剂加入食品中制成新的保健食品,例如绿茶饮料有预防龋齿、敏感症、痛风、降压、抑制氧化等作用;番木瓜SOD酒采用低温生物技术发酵而成,是一种低度纯天然的绿色健康型果露酒,能帮助消化,消除慢性胃炎,舒张血管,降低血压等作用.目前已开发的还有蛋黄酱、酸牛奶、可溶性咖啡、奶糖等产品为扩大SOD在食品中的应用范围,需增强SOD的稳定性,有必要对SOD进行化学修饰,选择无毒副作用的物质作为修饰剂,例如肝素化合物、硫酸软骨素、脂肪酸等,其中由玻璃酸、月桂酸修饰的SOD已投入商品化生产.有研究表明,制成SOD脂质体不仅能增强稳定性,还能促进人体皮肤的吸收.
动物血液中SOD含量丰富,尤其是特种经济动物极富药用价值,利用动物血液中SOD开发的保健食品主要有:第一,保健酒的研制,其中基质酒的选择也是极其重要的环节,能否作为基质酒依据酒质而定;与中药材一起研制药酒,目前主要研究了杜仲、白术、甘草、枸杞、鸡血藤、大血藤等浸提液参与研制的复合酒.第二,抗衰老食品、口服液、片剂生产等.
5 亟待解决的问题
目前由于精品SOD的提纯成本较高,且SOD与过氧化氢酶、过氧化物酶的协同作用对人体有更好地保健功能,因此,目前几乎没有单纯使用SOD酶开发功能食品和药物的企业.另外有关SOD的吸收机理、吸收率、有效剂量的基础研究不够,直接影响SOD功能性食品的研制和开发,且SOD活性在储藏性的稳定性不好,需要加强这方面的研究.
测定SOD活性的方法有多种,且各方法间测定结果的差异性很大,目前国内未制定含SOD保健食品的统一标准,这就难以规范和监督这类功能性食品的质量.因此,保健食品SOD标准亟待制定.
富含SOD自然资源未得到充分利用,如:刺梨中可食部分含SOD比活是一般水果的2~3倍,市场上未见其相应的保健产品;大蒜SOD在20 a前就有人报道过,但其产品会产生令人不适的酸臭味,因口感问题使其资源利用较少,存在资源的大量浪费.动物血液除极少部分以血粉形式供作饲料外,其它以污水形式排放,致使大量宝贵营养资源流失,且造成严重环境污染,而一些发达的工业化国家则对血液有合理的利用.另外,我国有很多鹿养殖基地,目前人们从医药保健方面对鹿茸利用较多,对鹿血及鹿血中SOD的利用较少,除鹿血酒外很少见其它上市产品.因此,我国亟待努力推动动物血液的深度利用和保健食品的功能因子开发.
6 小结
动物血液中SOD的提纯工艺已基本成熟,不同的血源提取工艺上有差别,应注意遵循环保、安全前提下,调节参数提高得率,提取过程中的副产物也应当综合利用.针对上述问题,我们将在下一步加强SOD的吸收机理、吸收率、有效剂量的基础研究,尽快制定保健食品SOD统一标准,开发潜在领域的应用才是我们研究的主旨.
[1]Mann T,Keilin D.Haemocuprein and hepatocuprein,copper-protein compounds of bloed andliverinmammals[J].Proc R Soc B,1938,126:303-315.
[2]Joe M.Mc Cord,Irwin Fridovich.Superoxide dismutase:An enzymic function for erythrthrocuprein[J].The Journal of Biological Chemistry,1969,244(22):6049-6065.
[3]田春美,钟秋平.超氧化物歧化酶的研究进展[J].中国热带医学,2005,5(8):1730-1732.
[4]邓旭,李清彪,孙道华,等.从大蒜细胞中分离纯化出超氧化物歧化酶[J].食品科学,2002,9(22):47-49.
[5]原龙,王新.大蒜中超氧化物歧化酶提取工艺研究[J].西安工程大学学报,2009,23(1):71-73.
[6]董长颖,张巧.三种芦荟超氧化物歧化酶的活性测定[J].北方园艺,2009,(5):97-99.
[7]王艳,任吉君.唇形科芳香植物SOD活性比较[J].河北农业科学,2009,48(2):429-431.
[8]吴思方,方尚玲.啤酒废酵母提取SOD研究[J].食品科学,2000,21(3):22-24.
[9]迟乃玉,刘英昊.SOD高产菌株乳酸菌的选育机器产酶条件的研究[J].微生物学通报,2001,28(6):22-25.
[10]丁琳,孟玲,刘宁,等.枯草杆菌超氧化物歧化酶制备的最佳工艺条件研究[J].沈阳化工学院学报,2007,21(2):105-108.
[11]翁清清.人血红细胞的超氧化物歧化酶纯化及其稳定性的研究[J].生物化学与生物物理学报,1980,20(4):357-362.
[12]袁勤生.牛血SOD的纯化及性质研究[J].医药工业,1983,(4):4-6.
[13]袁勤生.猪血SOD的纯化及性质研究[J].生物化学与生物物理学报,1987,19(1):22-26.
[14]杨芩,邹国林.鸭血SOD的纯化及性质研究[J].生物化学杂志,1989,5(2):169-174.
[15]郭中满.马血超氧化物歧化酶的纯化及其性质研究[J].中国兽医杂志,1991,17(12):7-8.
[16]徐广峰.牦牛血铜锌SOD的提纯研究[J].中国兽医科技,1991,(8):6-8.
[17]张兰杰.鹿血红细胞Cu,Zn-SOD的纯化及部分性质研究[J].特产研究,2005,(1):5-10.
[18]Grace SC.Phylogenetic distribution of superoxide dismutase supportsan endosymbiotic origin for chloroplastsandmitochondria[J].Life Sciences,1990,47:l875-1886.
[19]Kim E J,Kim H P,Hah Y C,et a1.Diferential expression of superoxide dismutases containing Niand Fe/Zn in Streptomyces coelicotor[J].Eur.J.Biochem.1996.241:178-185.
[20]Youn H D.Lee JW.Unique isozymes of supemxide dismutases in Streptomyces griseus[J].Arch.Biochem.Biophys,1996,334:341-348.
[21]Youn H D,Kim E J,Roe JH,et a1.A novelnickil-containing superoxide dismutase from Streptomyces spp[J].Biochem J.,1996,318:889-896.
[22]王仲礼.从动物血提取 SOD[J].肉类研究,2003,9(1):42-43.
[23]胡跃,顾巍.超氧化物歧化酶的活力和含量测定及其相互关系[J].上海医学检验杂志,1990,(2):84-86.
[24]顾孔书,林泽喜.邻苯三酚比色法损5定红细胞邻苯三酚的影响因素[J].中华血液学杂志,1991,(2):655-656.
[25]任立英,陈小刚.羟胺发色法测定超氧化物歧化酶[J].临床检验杂志,1993,(4):185-186.
[26]McrdjM,Fridovich.Superoxide dismutase:an e function forerychroeuprein[J].Biochem J.,1969,244:6049.
[27]李益新,方允中.超氧化物歧化酶测定新方法一化学发光法[J].生物化学与生物物理进展,1983,(2):59.
[28]贾宁人,王丽珠.化学发光法测定超氧化物歧化酶[J].临床检验杂志,1996,(2):59-62.
