离子交换层析纯化重组福安泰-03功能域的工艺条件研究
2010-04-21苏伟明马润娣于立坚广东海洋大学海洋药物研究与开发重点实验室广东湛江524025
苏伟明,马润娣,于立坚 (广东海洋大学海洋药物研究与开发重点实验室,广东湛江524025)
于廷曦 Cell Biology Group,Department of Surgery,Department of Pathology,University of Maryland School of Medicine and Baltimore Veterans Affairs Medical Center,Baltimore,MD 21201,USA
离子交换层析主要利用蛋白质等电点 (pI)的差异使其分离,即在一定的缓冲体系中,不同蛋白质与离子交换凝胶有不同的结合能力,而不同浓度的NaCl可以把不同结合力的蛋白质从层析柱上先后洗脱下来。由于离子交换层析具有处理量大、分辨率较高和成本低廉的特点[1],因此,该技术在众多蛋白质分离中得到广泛应用。
福安泰-03(Fuantai-03,FAT-03)功能域从赤魟组织中分离得到,分子量大约为43000Da,具有强抗血管生成活性和强抗肿瘤生长和转移作用[2~5]。将用DNA重建技术构建的、含FAT-03功能域基因的质粒整合入 BL121(DE3)大肠杆菌中,其表达的蛋白质即重组福安泰-03功能域 (recombinant functional domain of Fuantai-03,rFAT-03)。将重组福安泰-03功能域分离纯化是获得具有实用价值产品的关键步骤。下面,笔者在20℃、上样量一致、层析介质相同的条件下对离子交换层析纯化重组福安泰-03功能域功能域的工艺条件进行了研究。
1 试验部分
1.1 材料
HiTrap Desalting5×5ml(17-1408-01)脱盐预装柱、HiT rap DEAE Sepharose FF琼脂糖凝胶、XK 26/20柱均为美国GE公司产品;L-还原型谷胱甘肽 (AMRESCO公司);Tris(Genriew公司);丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、T EMED、SDS购自北京鼎国生物广州分公司,其余试剂均为国产分析纯。
1.2 仪器
AKTA explorer 100蛋白质快速纯化开拓系统 (美国GE公司);Avant J-25大容量高速冷冻离心机 (美国贝克曼公司);3K30高速冷冻离心机 (德国SIGMA公司);420A pH计 (美国奥力龙公司);Mini trans垂直电泳槽加转印系统 (美国Bio-Rad公司);FR-1000凝胶成像系统 (上海复日公司);Milli-Q RG(美国Millipore公司);2501紫外分光光度计 (日本岛津公司)。
1.3 试验方法
1)样品处理 调整原液蛋白浓度为1mg/ml,上样体积为400ml,用0.22μ m滤膜过滤,脱气10min。
2)缓冲液的配制 上样缓冲液 (0.1 mol/L Tris-HCl)的配制过程如下:称取Tris 12.11g,加去离子水500ml,搅拌溶解。用0.1mol/L HCl调pH至8.8,用去离子水定容至1000ml;洗脱缓冲液(1mol/L NaCl+0.1 mol/L T ris-HCl)的配制过程如下:称取Tris 12.11 g和NaCl 58.44 g,加去离子水500 ml,搅拌溶解。用0.1 mol/L HCl调pH至8.8,用去离子水定容至1000ml。
3)离子交换层析 采用XK26/20柱,填料为DEAE Sepharose FF琼脂糖凝胶 (50ml),在AKTA explorer 100蛋白质快速纯化开拓系统上进行。用上样缓冲液平衡5个柱床体积以上,至基线平稳。通过上样泵上样400ml,流速8ml/min。上样完毕后,用上样缓冲液洗至基线平稳,再用洗脱缓冲液采用以下3种不同洗脱条件进行洗脱:①线性梯度洗脱。即用洗脱缓冲液从0%到100%洗脱6个柱床体积,收集洗脱峰。②固定梯度和线性梯度混合洗脱。先用20%洗脱缓冲液直接洗脱3个柱床体积,再用洗脱缓冲液从20%到100%洗脱2个柱床体积,收集洗脱峰。③不同阶段线性梯度洗脱。先用洗脱缓冲液从30%到60%洗脱3个柱床体积,再用洗脱缓冲液从60%到100%洗脱2个柱床体积,收集洗脱峰。
4)脱盐 采用HiTrap脱盐柱进行脱盐,上样1ml,流速5ml/min,收集样品。
5)总蛋白量测定 采用Lowry法[6],以牛血清白蛋白为基准。
6)SDS-PAGE电泳 利用SDS-聚丙烯酰胺电泳[7]测定粗品和层析分离后样品的纯度,分离胶为10%聚丙烯酰胺凝胶,考马斯亮蓝染色。用 FR-1000凝胶成像系统处理SDS-PAGE凝胶。利用SMART VIEW分析软件对电泳图谱进行分析。
7)UNICORN 5.11软件分析 用UNICORN 5.11软件对离子层析图谱进行分析。
2 试验结果与分析
用UNICORN 5.11软件对离子层析图谱进行得率分析和SMART VIEW分析软件对电泳图谱进行纯度分析,3种不同洗脱条件下的具体分析结果如下。
2.1 线性梯度洗脱
采用线性梯度洗脱时,其离子交换层析图谱如图1(a)所示,由图1(a)可知出现2个洗脱峰,1#得率只有11.16%,2#得率为88.84%。SDS-PAGE电泳图如图2(a)所示,由图2(a)可知,1#峰为目的蛋白,但有杂带,纯度为90.1%,2#峰中有目的蛋白,但分离不完全。
2.2 固定梯度和线性梯度混合洗脱
采用固定梯度和线性梯度混合洗脱时,其离子交换层析图谱如图1(b)所示。由图1(b)可知出现3个洗脱峰,3个峰分离不完全,1#得率为27.73%,2#得率为11.75%,3#得率为60.51%。SDS-PAGE电泳图如图2(b)所示。由图2(b)可知,1#峰为目的蛋白,纯度为99.5%,2#有部分目的蛋白。
2.3 不同阶段线性梯度洗脱
采用不同阶段线性梯度洗脱时,其离子交换层析图谱如图1(c)所示。由图1(c)可知出现2个洗脱峰,1#和2#分离比较完全,1#得率为35.97%,2#得率为64.03%。SDS-PAGE电泳图如图2(c)所示。由图2(c)可知,1#为目的蛋白,呈单一条带,纯度为99.5%,2#基本上无目的蛋白。
综上所述,采用不同阶段线性梯度洗脱时,重组福安泰-03功能域和小分子物质已完全分离开来,目的蛋白纯度很高,且得率最高。因此,使用该洗脱条件可获得最佳分离纯化效果。
3 结 语
在上样缓冲液为0.1mol/L Tris-HCl、洗脱缓冲液为1mol/L NaCl+0.1mol/L T ris-HCl、pH为8.8的条件下,利用HiTrap DEAE Sepharose FF琼脂糖凝胶吸附柱,先用洗脱缓冲液从30%到60%洗脱3个柱床体积,再用洗脱缓冲液从60%到100%洗脱2个柱床体积,最后收集洗脱峰。通过上述操作能获得最佳分离纯化效果,即重组福安泰-03功能域的纯度最高,得率最大。因此,该试验条件的确定为制备足量高纯度重组福安泰-03功能域提供了重要参考。
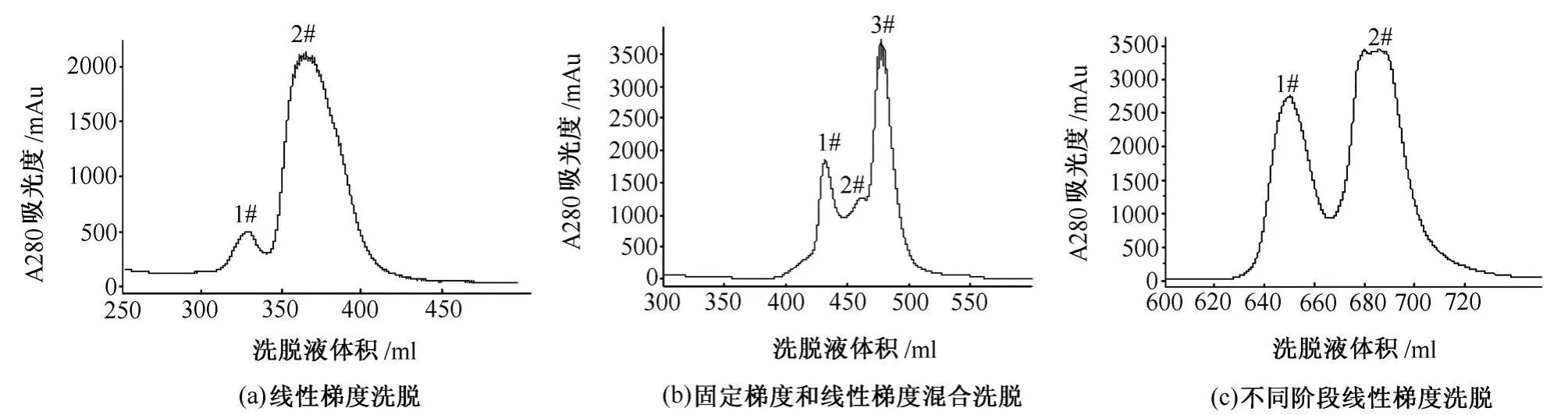
图1 离子交换层析图谱
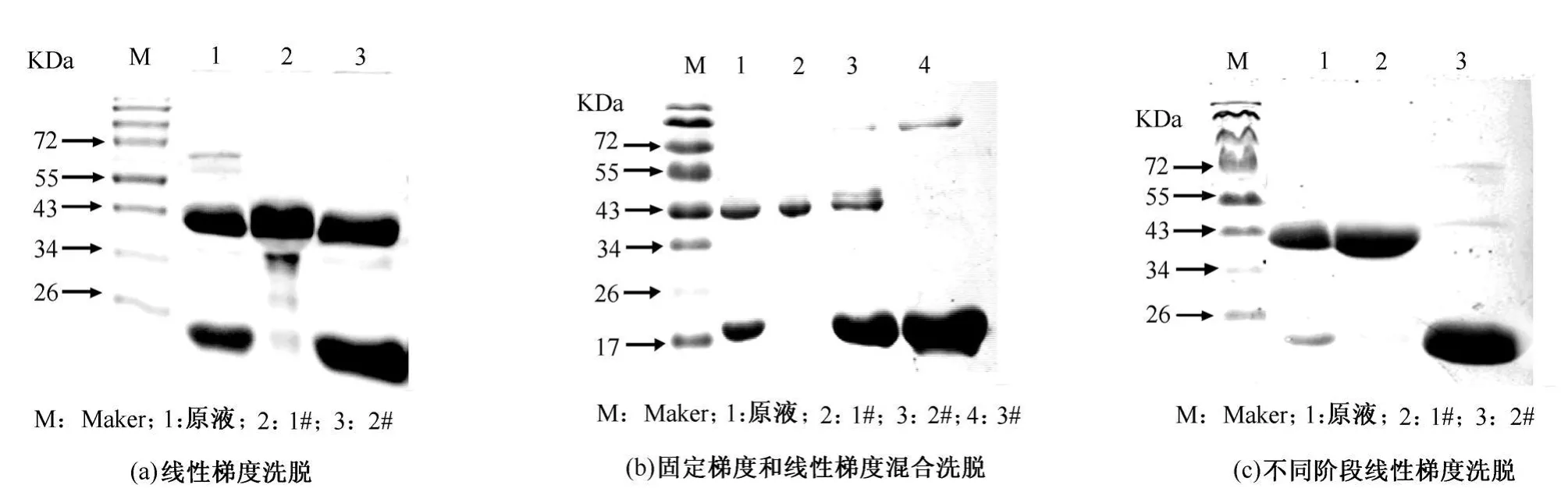
图2 SDS-PAGE电泳图
[1]薛文娇,范代娣,尚龙安,等.离子交换批量层析纯化重组类人胶原蛋白 [J].化学工程,2006,34(11):8~11.
[2]苏伟明,马润娣,于立坚,等.一种新的源自赤魟的强血管生成抑制剂福安泰-03的分离和鉴定 [J].中国生物化学与分子生物学报,2009,25(9):849~854.
[3]于立坚,马润娣,廖铭能,等.福安泰-03对肿瘤血管生成的抑制作用 [J].中国药理学通报,2008,24(11):1445~1449.
[4]廖铭能,徐海瑛,马润娣,等.福安泰-03对高转移人卵巢癌细胞HO-8910PM侵袭能力的影响 [J].细胞生物学杂志,2009,31:384~388.
[5]黄来珍,王长秀,马润娣,等.福安泰-03对小鼠癌细胞转移相关基因和转移行为的影响 [J].中国细胞生物学学报,2010,32(4):223~228.
[6]Lowry O H,Rosebrough N J,Farry A L,et al.Protein measurement with the folin phenol reagent[J].J Biol Chem,1951,193:265~275.
[7]李建武,余瑞元,袁明秀,等.生物化学实验原理和方法 [M].北京:北京大学出版社,1994.
