氧化还原反应类离子方程式的书写
2010-04-20盛恒兵
盛恒兵
(江苏省灌南高级中学江苏灌南222500)
氧化还原反应类离子方程式的书写
盛恒兵
(江苏省灌南高级中学江苏灌南222500)
氧化还原反应与离子方程式的书写是高中化学重要的知识点,单纯就某一个知识点学生掌握较好,而两者相结合考查氧化还原类离子方程式的书写,学生普遍感到较难,特别是在新情景陌生度较大的环境下,因学生基础不扎实加之阅读信息、提炼信息的能力欠缺,相当一部分学生感到无从下手,出错率较高。那么如何掌握正确的书写方法,减少出错的几率,下面就两个典型的例题谈谈氧化还原反应类离子方程式的书写方法:
案例1.(节选自2009年江苏17题)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O,在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是____ ______________。
分析:
书写氧化还原反应类离子方程式一般要遵循下列几步:
1.列出氧化剂、还原剂、氧化产物、还原产物,确定电子得失。
根据题干的表述列出氧化剂、还原剂、氧化产物、还原产物,标出化合价的变化。上题中CuSO4→CuCl铜元素化合价从+2价变化到+1价,因此CuSO4是氧化剂,CuCl还原产物,那么Na2SO3就是还原剂,其氧化产物应该是NaSO4,可以列出:
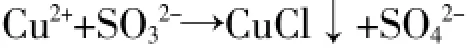
2.根据电子守恒,配氧化剂、还原剂、氧化产物、还原产物的系数。
Cu元素从+2价变化到+1价,转移1e-,S元素从+4价变化到+6价,转移2e-,根据电子守恒,可配出:
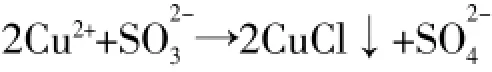
3.看环境,根据电荷守恒,配平其他物质的系数。
一般化学反应都要在一定的环境下才能进行,尤其是反应环境的酸碱性对氧化还原反应类离子方程式的书写有着至关重要的作用,同一个反应因环境的酸碱性不同,写出来的离子方程式也是不同的,因为有时要使一个离子方程式电荷守恒,有时需要在方程式的两边加H+和OH-以满足电荷守恒,有许多同学会不顾及反应环境的酸碱性,随意地在方程式里加上H+和OH-。本题有同学写出看似正确,好像也满足电荷守恒、电子守恒和元素守恒,但违背了客观事实,忽视了反应的酸碱性环境,Cu2+不可能存在于碱性环境与OH-共存,所以在酸性环境下的反应,离子方程式里不能出现OH-,同理在碱性环境下的反应,方程式里不能出现H+。CuSO4溶液呈酸性,本反应应该在酸性环境下进行,比较两边,要使电荷守恒应在右边加H+,左边对应加H2O,不难写出2H+。
案例2.(节选自2009年江苏18题)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子2001年我国卫生部规定,饮用水的含量应不超过0.2mg·L-1。饮用水中的含量可用连续碘量法进行测定。ClO2被I-还原为当pH≤2.0时,请写出pH≤2.0时,被I-反应的离子方程式为-------------------------。
1008-0546(2010)09-0081-01
G633.8
B
10.3969/j.issn.1008-0546.2010.09.0331
