BCR-ABL酪氨酸激酶抑制剂的研究进展
2010-04-19王伟邹志红
王伟,邹志红
(东南大学化学化工学院,江苏南京 210009)
人体9号染色体上的癌基因c-ABL链接到22号染色体上的断点簇集区(BCR),形成p210 BCR-ABL融合基因和p185 BCR-ABL融合基因,这两种融合基因使相应的BCR-ABL酪氨酸激酶持续激活,引起细胞增殖、黏附和生存性质的改变,分别导致产生慢性粒细胞白血病(CML)和急性粒细胞白血病(ALL)[1]。之前治疗这类疾病主要依靠单克隆抗体药物,直到2001年美国FDA批准了第一个治疗CML的BRCABL酪氨酸激酶抑制剂伊马替尼后,寻找小分子化合物抑制BRC-ABL酪氨酸激酶以治疗上述疾病逐渐成为人们关注的热点。本文拟就BRC-ABL酪氨酸激酶抑制剂的研究进展作一综述。
1 第一代BCR-ABL酪氨酸激酶抑制剂
20世纪90年代初,在Zimmermann的带领下,合成了一系列以2-苯氨基嘧啶为主体的小分子化合物,经过筛选发现伊马替尼(Imatinib,STI571)能够特异性的抑制BCR-ABL酪氨酸激酶的活性[2]。其结构式见图1。2001年5月10日美国FDA批准了诺华公司(Novartis)的伊马替尼用于治疗CML,这是首个治疗CML的BCR-ABL酪氨酸激酶抑制剂,具有划时代的意义,被美国《科学》杂志列入2001年度十大科技新闻[3]。现已明确,伊马替尼并非绝对特异的酪氨酸抑制剂,除抑制BCR-ABL酪氨酸激酶活力外,对血小板衍化生长因子 β(PDGF-β)受体酪氨酸激酶和干细胞因子(SCF)的c-kit配体酪氨酸激酶活力也存在同等程度的抑制[4]。然而,随后的临床研究表明,BCRABL基因发生了包括Y253H、E255V、E255K、F359V、T315I、G250E、F317L、E355G、H396P、M351T、M253H、L248V、Q252H、Y253H和Y253C等15种突变,BCRABL基因的突变导致伊马替尼出现耐药性[5]。
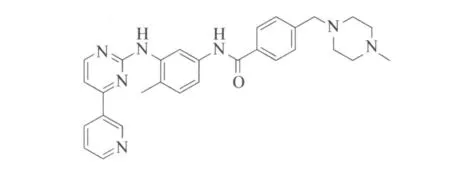
图1 Imatinib结构式
2 第二代BCR-ABL酪氨酸激酶抑制剂
由于伊马替尼耐药性的出现,开发新的BCR-ABL酪氨酸激酶抑制剂迫在眉睫。目前,第二代BCR-ABL酪氨酸激酶抑制剂已经上市,主要药物有达沙替尼和尼洛替尼。
2.1 达沙替尼
达沙替尼(Dasatinib,BMS-354825),结构式见图2,是由美国百时美施贵宝公司(Bristol-Myers Squibb)研发的一种口服BCR-ABL酪氨酸激酶抑制剂,于2006年6月28日通过美国FDA审批,用于治疗CML和费城染色体阳性的急性淋巴细胞性白血病(ph+ALL)[6]。人们认为该药既可以与ABL酪氨酸的活性部位又可与其非活性部位连接,比伊马替尼更有药效但不会致死静止的干细胞群[7]。在哺乳动物中,其口服生物利用度14%~34%,其差异可能是与药物的不能完全吸收以及首过效应有关。药代动力学数据显示达沙替尼主要是通过氧化代谢消除,对大部分伊马替尼耐药性的突变都有效[8]。
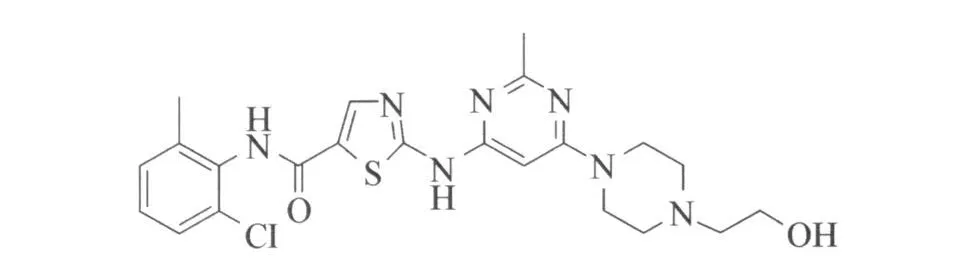
图2 Dasatinib结构式
2.2 尼洛替尼
苯胺嘧啶类衍生物——尼洛替尼(Nilotinib,AMN107)在临床上开发为一种单盐酸盐形式,结构式见图3。这个分子结构与伊马替尼相关并且是通过伊马替尼-ABL结合物的晶体结构与药物化学的关系研究而发现的[9]。尼洛替尼是一种选择性的BCR-ABL酪氨酸激酶抑制剂,其有效性是伊马替尼的20~50倍,能抑制除T315I外的伊马替尼耐药性BCR-ABL突变[10]。该药于2007年10月29日经美国FDA批准用于治疗CML。
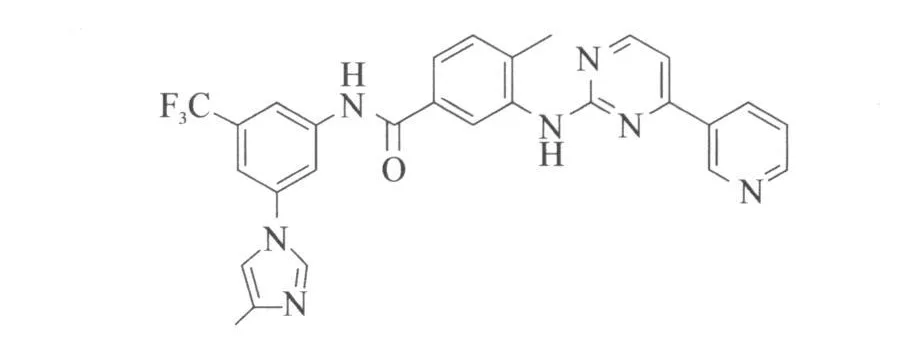
图3 Nilotinib结构式
虽然达沙替尼和尼洛替尼显示出令人鼓舞的初步成效,但一些研究者报道它们使用后将在ABL激酶区引发新的突变。Ray等[11]已鉴别出17种在该激酶区上的突变,其中包括6种已知的伊马替尼耐药性突变(L248V、Q252H、Y253/C、E255K和T315I)和11种另外增加的突变(K247N、E282K、K285N、V289L、L273F、E292K、N297T、H375P、T406I、W430L和E431G)。
3 新近开发的BCR-ABL酪氨酸激酶抑制剂
由于第二代BCR-ABL酪氨酸激酶抑制剂耐药性的出现,开发出更新的BCR-ABL酪氨酸激酶抑制剂是很有必要的,目前正在开发的主要有以下这些。
3.1 伯舒替尼
伯舒替尼(Bosutinib,SKI-606),结构式见图4,由惠氏制药(Wyeth)开发,是SRC和BCR-ABL双重抑制剂,该化合物对血小板源性生长因子的酪氨酸激酶没有活性[12],但能抑制BCR-ABL和LYN(一个芽殖期的内褶蛋白质)转磷酸化和细胞增殖作用。伯舒替尼对Y253H、E255V、E255K和F359V突变的BCR-ABL有效,在小鼠实验中显示出有抑制K562异种移植物增生的作用[13],但对T315I突变依然没有效果。在Ⅰ-Ⅱ期临床研究中,69位伊马替尼耐药的CML或ph+ALL病人用伯舒替尼治疗后症状都得到了好转,其副作用有腹泻、恶心和呕吐等[14]。
图4 Bosutinib结构式
3.2 INNO-406
INNO-406(CNS-9/NS-187),结构式见图5,由纽约因奴白制药公司(Innovive Pharmaceutical,Inc.)开发,该化合物对BCR-ABL酪氨酸激酶的抑制活性是伊马替尼的25~55倍,并且还能抑制达沙替尼耐药的T315A,F317L和F317V BCR-ABL突变[15-16]。然而,该化合物对T315I突变依然没有效果。INNO-406在大鼠模型中有口服活性并且是一种ATP竞争性抑制剂。在Ⅰ期临床试验中,受试病人至少有两种其它酪氨酸激酶抑制剂的耐药性,经过INNO-406治疗后已经有了血液学和细胞遗传学反应[17]。
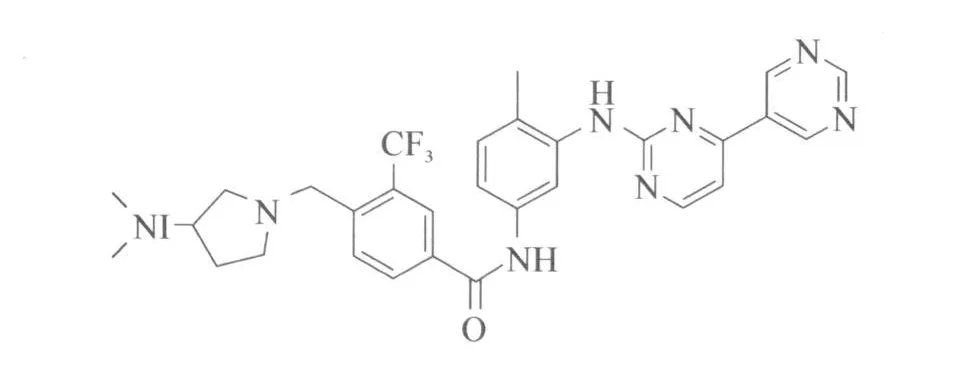
图5 INNO-406结构式
3.3 AP系列
Ariad公司研发的AP系列抗肿瘤化合物中,核心化合物AP23464已在临床前研究中,结构式见图6,该化合物在低浓度时就可以通过抑制BCR-ABL的自磷酸化和细胞增殖来抑制BCR-ABL酪氨酸激酶[18],并且能抑制发生了Q252H、Y253F、E255K、M351H和H396P突变的BCR-ABL酪氨酸激酶,但该化合物依然不能抑制T315I突变。可喜的是同系列化合物AP23846和AP24534能抑制T315I突变,这两种化合物临床效果还有待于进一步研究[19]。
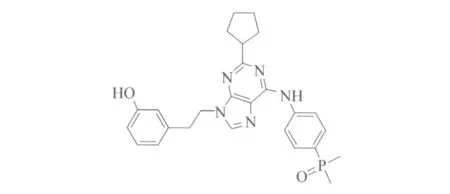
图6 AP23464结构式
3.4 PD系列
美国德州大学西南医疗中心的科学家对PD(乙酰吡啶[2,3-d]并嘧啶)系列化合物进行了研究,其中核心化合物有PD173955、PD180970和PD166326,结构式见图7。通过这些化合物与ABL激酶结合物的晶体结构,推理得出它们与激酶区的活性ATP连接点结合产生活性,但这类化合物与其他酶的类似活性位点也结合,所以也能抑制表皮生长因子(EGF)、EphB4、成纤维细胞生长因子(FGF)、c-Kit、PDGF和血管内皮细胞生长因子(VEGF)受体酪氨酸激酶[20]。
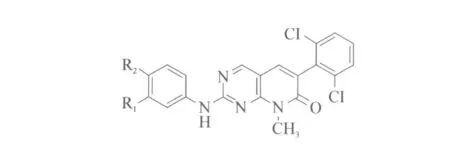
图7 PD系列结构式
这些化合物能够抑制许多伊马替尼耐药性的BCR-ABL突变,但对T315I突变依然难以控制。Bubnoff等[21]评价了PD166326引起的突变,研究表明PD166326的耐药性突变产生频率要比伊马替尼小,但其ABL激酶区的点突变却比伊马替尼多,第9位氨基酸残基涵盖了总共的14个点突变,包含最常见的G250E、Y253H、E255K(V)、T315I、F317L和E355G突变。然而,当PD166326的浓度达到500 nM时,这些突变了(除了T315I)的激酶活性能够被抑制。由于现在的PD系列化合物溶解性低,口服利用度小,该系列化合物还未进入临床研究,因此开发该类型中新的化合物来克服这些缺点也是有必要的。
3.5 AZD0530
阿斯利康制药公司(Astra Zeneca)开发的BCRABL/SRC双重酪氨酸激酶抑制剂AZD0530已进入Ⅱ期临床研究,其结构式见图8。结构里有一个5-取代的喹唑啉环使得该分子对SRC家族激酶有很好的选择性,也保持了抑制BCR-ABL的活性,并且抑制BCRABL激酶的耐药性变异还未见报道,Ⅰ期临床显示该化合物可以很好地被人体吸收,且耐受剂量高,药效持续时间长[22]。AZD0530对人类乳腺转移MDA-MB231细胞具有活性,在胰脏和膀胱癌的大鼠模型中,AZD0530能够在不影响源肿瘤细胞的情况下抑制肿瘤细胞转移和预防Y530F SRC-转染的NIH-3T3异种移植物的皮下转移生长[23]。目前,阿斯利康公司对AZD0530抑制SRC活性也做了临床前研究[24]。
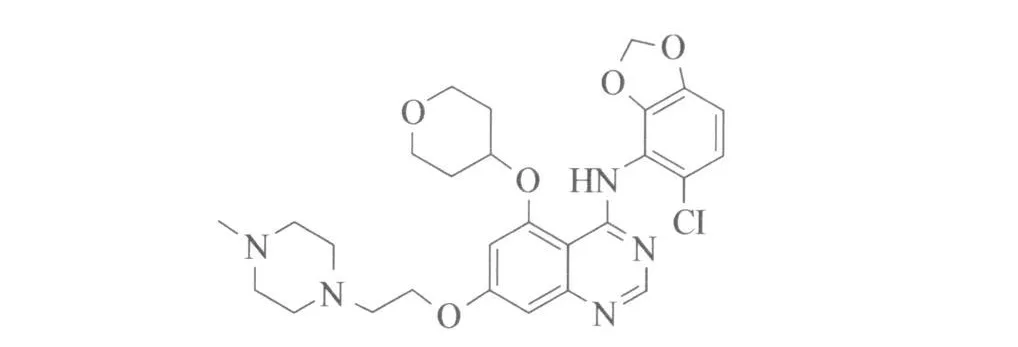
图8 AZD0530结构式
3.6 MK-0457
丝氨酸-苏氨酸激酶的极光家族对有丝分裂过程是必需的,该家族的所有成员有可以确认的ATP-连接位点并且通过遗传的不稳定性感应来连接到肿瘤基因。默克公司(Merck)和维泰士公司(Vertex)共同研发的MK-0457(VX680),结构式见图9,是极光激酶抑制剂的一种并且在一些肿瘤细胞系中产生了抗增殖和促凋亡活性[25]。例如,用MK-0457作用后的细胞能进入有丝分裂或通过S期继续分化,但不会分裂开。令人欣喜的是,MK-0457能与BCR-ABL活性部位连接并且有抗T315I突变的活性。这种抑制剂已经进入伊马替尼耐药性的CML和ph+ALL的Ⅱ临床研究中。初始报告显示3例有伊马替尼耐药性和T315I突变的病人出现了血液学反应,并且其中两例病人中,突变体克隆的浓度也下降了[26]。
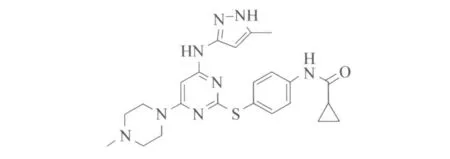
图9 MK-0457结构式
3.7 其他
Warmuth等[27]研究得出原来作为原癌基因SRC编码的非受体型酪氨酸激酶抑制剂的CGP70630也能阻止BCR-ABL酪氨酸磷酸化,减缓肿瘤细胞的生长和存活,但不能阻止T315I突变激酶的磷酸化。Lindsay等[28]研究了非-ATP竞争型抑制剂ON012380,研究表明该化合物能降低BCR-ABL的自磷酸化和下游层的磷酸化,并且不管是在体内还是体外该化合物抑制T315I突变的活性是伊马替尼的10 000倍。Adrian等[29]研究得出GNF-2可通过一种变构的非-ATP竞争性机制抑制BCR-ABL激酶。Carter等[30]研究表明BIRB-796与T315I突变连接,但是相对于其他突变的BCR-ABL蛋白没有活性。Chandra等[31]报道Adaphostin能诱导产生伊马替尼耐药性突变的BCR-ABL酪氨酸激酶氧化应激来抑制其活性。Radi等[32]报道,他们发现一系列噻二唑衍生物,这些化合物是有效BCR-ABL酪氨酸激酶抑制剂,能抑制伊马替尼耐药的独立BCR-ABL白血病细胞。Wang等[33]报道,一些新的N9-芳乙烯基嘧啶化合物可以作为有效的SRC/ABL酪氨酸激酶的双重抑制剂。
4 结 语
对伊马替尼耐药的BCR-ABL突变体生物学结构的了解使得BCR-ABL酪氨酸激酶抑制剂的研发有了新进展。在确定病人有伊马替尼耐药的BCR-ABL突变后仅仅3年时间,两种抑制该突变的新药物——达沙替尼和尼洛替尼已经上市。虽然这两个药物对T315I突变依然无效,但最近有抗T315I突变活性的化合物已被发现。随着抑制现有BCR-ABL突变的新药物不断被研发出来,分辨出不同类型病人的最适合药物变得越来越重要了。目前,新近开发的BCR-ABL抑制剂越来越有效,并且联合用药也可增强治疗效果,如Weisberg等[34]研究表明伊马替尼和尼洛替尼联合用于CML衍生的细胞系时有协同作用。进一步研究BCR-ABL酪氨酸激酶作用机制和耐药机制,开发出全面的BCR-ABL酪氨酸激酶抑制剂是人们所期盼的。
[1]白亚军.抗癌药物伊马替尼(Imatinib)碱的合成研究[D].西安:西北大学,2007.
[2]潘耀柱,白海,王存邦.酪氨酸激酶抑制剂抑制骨髓瘤细胞的增殖及粘附[J].中国现代医学杂志,2008,18(13):1863-1866.
[3]DAGHER R,COHEN M,WILLIAMS G,et al.Approval summary:imatinib mesylate in the treatment of metastatic and/or unresectable malignant gastrointestinal stromal tumors[J].Clin Cancer Res,2002,8(10):3034-3038.
[4]COHEN M H,WILLIAMSG,JOHNSONJ R,et al.Approval summary for imatinib mesylate capsules in the treatment of chronic myelogenous leukemia[J].Clin Cancer Res,2002,8(5):935-942.
[5]JABE F APPERLEY.Part II:Management of resistance to imatinib in chronic myeloid leukaemia[J].Lancet Oncol,2007,8(12):1116-1128.
[6]KANTARJIAN H,JABBOUR E,GRIMLEY,et al.Dasatinib[J].Nature Rev Drug Discov,2006,10(5):717-718.
[7]COPLAND M,HAMILTON A,EIRICK L J,et al.Dasatinib(BMS-354825)targets an earlier progenitor population than imatinib in primary CML but does not eliminate the quiescent fraction[J].Blood,2006,107(11):4532-4539.
[8]MULLER M C,ERBEN P,SCHENK T,et al.Response to dasatinib after imatinib failure according to type of preexisting BCR-ABL mutations[J].Blood,2006,108(1):225-260.
[9]CARLO G P,ROCCO P,MAURIZIO D.Bcr-Abl mutations,resistance to imatinib,and imatinib plasma levels[J].Blood,2003,102(5):1933-1935.
[10]KANTARJIANH,CORTESJ.New tyrosinekinaseinhibitors in chronic myeloid leukemia(CML)[J].Leukemia Res,2007,31(2):S16-S19.
[11]RAY A,COWAN-JACOB S W,MANLEY P W,et al.I-dentification of BCR-ABL point mutations conferring resistance to the Abl kinase inhibitor AMN107(nilotinib)by a random mutagenesis study[J].Blood,2007,109(11):5011-5015.
[12]GOLASJM,ARNDTK,ETIENNE C,et al.SKI-606,a 4-anilino-3-quinolinecarbonitrile dual inhibitor of Src and Abl kinases,is a potent antiproliferative agent against chronic myelogenous leukemia cells in culture and causes regression of K562 xenografts in nude mice[J].Cancer Res,2003,63(2):375-381.
[13]GRAFONE T,MANCINI M,OTTACIANI E,et al.A novel 4-anilino-3-quinolinecarbonitrile dual Src and Abl kinase inhibitor(SKI-606)has in vitro activity on CML Ph+blast cells resistant to imatinib[J].Proc Am Assoc Cancer Res,2005,46(5):1408-1413.
[14]GAMBACORTI-PASSERINI C,BLUMMEDORF T,KANTARJIAN H,et al.Bosutinib(SKI-606)exhibits clinical activity in patients with Philadelphia chromosome positive CML or ALL who failed imatinib[J].J Clin Oncol,2007,25(s1):33-47.
[15]DONATON J,WU JY,STAPLEY J,et al.BCR-ABL independence and LYNkinaseoverexpression in chronic myelogenous leukemia cells selected for resistance to STI571[J].Blood,2003,101(2):690-698.
[16]YASUYKI D A,SHINYA K,EISHI A.Comparison of imatinib,dasatinib,nilotinib and INNO-406 in imatinib-resistant cell lines[J].Leukemia Res,2008,32(6):980-983.
[17]NAITOH,KIMURA S,NAKAYA Y,et al.In vivoantiproliferative effect of NS-187,a dual Bcr-Abl/Lyn tyrosine kinase inhibitor,on leukemic cells harbouring Abl kinase domain mutations[J].Leukemia Res,2006,30(11):1143-1146.
[18]O'HARE T,POLLOCK R,STOFFREGEN E P,et al.Inhibition of wild-type and mutant Bcr-Abl by AP23464,a potent ATP-based oncogenic protein kinase inhibitor:implications for CML[J].Blood,2004,104(8):2532-2539.
[19]AZAM M,NARDIV,SHAKESPEARE WC,et al.Activity of dual SRC-ABL inhibitors highlights the role of BCR/ABL kinase dynamics in drug resistance[J].Proc Natl Acad Sci USA,2006,103(24):9244-9249.
[20]WISSING J,GODL K,BREHMER D,et al.Chemical proteomic analysis reveals alternative modes of action for pyrido[2,3-d]pyrimidine kinase inhibitors[J].Mol Cell Proteomics,2004,3(12):1181-1193.
[21]von BUBNOFF N,VEACH D R,MILLERW T,et al.Inhibition of wild-type and mutant Bcr-Abl by pyrido-pyrimidinetype small molecule kinase inhibitors[J].Cancer Res,2003,63(19):6395-6404.
[22]LOCKTON JA,SMETHURST D,MACPHERSON M,et al.Phase I ascending single and multiple dose studies to assess the safety,tolerability and pharmacokinetics of AZD0530,a highly selective,dual specific Src-Abl inhibitor[J].J Clin Oncol,2005,23(16S):3125-3130.
[23]HISCOX S,BARROW D,GREENT,et al.Adhesion-independent focal adhesion kinase activation involves Src and promotes cell adhesion and motility in tamoxifen-resistant MCF-7 cells and is inhibited by the Src/Abl kinase inhibitor,AZD0530[J].Proc Am Assoc Cancer Res,2005,46(3):62-63.
[24]TIMP G,MIKE F,RONINW.Preclinical anticancer activity of the potent,oral Src inhibitor AZD0530[J].Molecular Oncol,2009,3(3):248-261.
[25]SEIICHI O,TETSUZOT,JUNKO H O.Mechanism of MK-0457 efficacy against BCR-ABL positive leukemia cells[J].Biochem Biophys Res Commun,2009,380(4):775-779.
[26]GILESF J,CORTESJ,JONESD,et al.MK-0457,a novel kinase inhibitor,is active in patients with chronic myeloid leukemia or acute lymphocytic leukemia with the T315I BCRABL mutation[J].Blood,2007,109(2):500-502.
[27]WARMUTH M,SIMON N,MITINA O,et al.Dual-specific Src and Abl kinase inhibitors,PP1 and CGP76030,inhibit growth and survival of cells expressing imatinib mesylate-resistant Bcr-Abl kinases[J].Blood,2003,101(2):664-672.
[28]LINDSAY O K,CAMPBELL M.Non-ATP competitive protein kinase inhibitors as anti-tumor therapeutics[J].Biochem Pharmacol,2009,77(10):1561-1571.
[29]ADRIANF J,DINGQ,SIMT,et al.Allosteric inhibitors of Bcr-abl-dependent cell proliferation[J].Nat Chem Biol,2006,2(2):95-102.
[30]CARTER T A,WODICKA L M,SHAH N P,et al.Inhibition of drug-resistant mutants of ABL,KIT,and EGF receptor kinases[J].Proc Natl Acad Sci USA,2005,102(31):11011-11016.
[31]CHANDRA J,TRACY J,LOEGERING D,et al.Adaphostin-induced oxidative stress overcomes BCR/ABL mutationdependent and-independent imatinib resistance[J].Blood,2006,107(6):2501-2506.
[32]RADI M,CRESPAN E,BOTTA G,et al.Discovery and SAR of 1,3,4-thiadiazole derivatives as potent Abl tyrosine kinase inhibitors and cytodifferentiating agents[J].Bio&Med Chem Let,2008,18(3):1207-1211.
[33]WANG Y H,SHAKESPERAREW C,HUANGW S,et al.Novel N9-arenethenyl purines as potent dual Src/Abl tyrosine kinase inhibitors[J].Bio&Med Chem Let,2008,18(17):4907-4912.
[34]WEISBERG E,CATLEY L,WRIGHT R D,et al.Beneficial effects of combining nilotinib and imatinib in preclinical models of BCR-ABL+leukemias[J].Blood,2007,109(5):2112-2120.
