不同磷水平对Na+/PiⅡb转运载体蛋白mRNA表达和磷吸收的影响
2010-04-17曹满湖方热军
曹满湖 方热军 陈 娟
(湖南农业大学动物科学技术学院,长沙 410128)
磷(phosphate,Pi)是动物体内除钙以外含量最丰富的矿物质,对动物体内骨骼组织的形成与维持渗透压和酸碱平衡的相对稳定、能量利用、蛋白质合成、生长和细胞分化等各种代谢过程起着重要作用[1-2]。但磷的大量使用和低利用率导致了两大问题:一是磷资源的浪费;二是严重的生态环境破坏与污染[3]。因此,如何提高磷的吸收始终是磷研究的一个热点和难题。无机磷的吸收主要与Na+/Pi转运载体蛋白有关,在小肠中参与磷吸收的载体蛋白主要为Ⅱb型钠磷协同转运蛋白[4]。低磷状况下小肠Na+/PiⅡb转运载体蛋白m RNA表达量和磷的吸收关系如何,其在小肠各部位中的表达是否存在差异,国内尚少见报道。因此,本试验通过研究添加不同磷水平的饲粮对大鼠小肠Na+/PiⅡb转运载体蛋白m RNA表达量的影响,揭示低磷状态下,小肠Na+/PiⅡb转运载体m RNA表达量的变化和差异性,为低磷饲粮在生产上的利用提供科学依据。
1 材料与方法
1.1 主要试剂和仪器
Phosphorus-32 Radionuclide、反转录试剂盒、RT-PCR试剂盒、碱性磷酸酶试剂盒、ELISA试剂盒等,均为国产分析纯。超速冷冻离心机(H itachiSCR20BC,日本津岛)、AB7900HT Fast Real-Tim e PCR System(美国)、液体闪烁放射性仪(1450 M icrobeta,PerkinElmer)、Thermo Labsystems M uLtiskan M K3酶标仪。
1.2 试验动物与试验设计
选择120只体重在18~22 g的昆明大白鼠,随机分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4个组,分别饲喂含0.2%、0.4%、0.6%、0.8%磷(总磷)的饲粮;每个组设5个重复,每个重复6只大白鼠,饲粮参照大白鼠营养需要标准配制[5],基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diets(air-d ry basis,%)
1.3 样品采集
试验期为14 d。试验期结束,屠宰大鼠,取腿骨、血样、肠样、肾脏。腿骨剔除肉、软组织后待测骨钙及骨磷;血样于3 000 r/min离心后取血清并置-20℃冰箱保存,备测生化指标;截取十二指肠、空肠中段和回肠,排出内容物,外翻肠道,用生理冰盐水(0.9%NaCl)冲洗,置液氮中保存。
1.4 小肠刷状缘膜(brush-border membrane vesicles,BBMV)的制备
按照Schroder等[6]的方法制得BBMV,并测定BBMV中碱性磷酸酶(alkaline phosphatase, ALP)、Na+-K+-ATP酶的活性,以确定所制样品的纯度。
1.5 荧光定量PCR(real-time PCR)
Na+/Pi-Ⅱb引物参考已知大鼠(AF157026) CDS保守序列设计。上游引物为:5′-GTCCTCGTCAATCATCGTCAG-3′,下游引物为:5′-GCATAAGTGCCACAATCGTGTT-3′,PCR产物长度为123 bp;β-actin(NM 031144):上游引物为5′-CCGTAAAGACCTCTATGCCAACA-3′,下游引物为5′-GCTAGGAGCCAGGGCAGTAATCT-3′, PCR产物长度为112 bp。引物由上海生工生物技术有限公司合成。反应体系为:5μL 1×qPCR mix,上下游引物(10μmo l/L)各0.3μL,DNA溶液0.5μL,50×ROX 0.2μL,加灭菌蒸馏水至10μL。循环反应条件为:95℃预变性60 s;95℃PCR变性15 s;60℃下延伸30 s;退火温度60℃;40个循环。
1.6 BBMV对于磷转运吸收的测定
采用放射性32P技术,参考Schroder等[7]和孙杰[8]的方法并加以改进。将20μL囊泡悬浮液加到80μL含有1 uCi32P的转运缓冲液中,于25℃水浴锅中孵浴60 s,接着用2m L冰冷的终止缓冲液(含10 mm ol KH2 PO4的10 mmol HEPES-tris、100mmo l NaCl、100mmo l甘露醇,pH 7.4)终止反应。10 000 r/m in离心5 m in,弃上清液。加入1 m L甲醇溶液,加入0.36 m L闪烁液体,于β射线(液体闪烁计数)放射性测定仪测量放射强度,并测定80μL转运缓冲液中32Pi总放射性。钠依赖型磷的摄入量为NaCl存在的情况下磷的摄入量与KCl存在的情况下磷的摄入量的差值。
1.7 数据分析
mRNA表达量用2-△△Ct进行相对定量分析;试验数据采用SAS 8.1统计;采用Duncan氏法进行多重比较;结果用平均值±标准差表示;以P<0.05或P<0.01作为差异显著性判断标准。
2 结 果
2.1 不同磷水平对血液和骨骼中钙磷含量的影响
不同磷水平对血液和骨骼中钙磷含量的影响见表2。不同磷水平对骨钙、骨磷含量均无显著影响(P>0.05),但低磷组骨钙含量比其他3个处理分别高1.6%、2.4%和1.1%。血清中磷的含量随着添加磷水平的增加而升高,Ⅰ组与Ⅳ组、Ⅱ组与Ⅳ组比较差异均显著(P<0.05)。血清钙含量随磷水平的增高而升高,但各组间差异均不显著(P>0.05)。
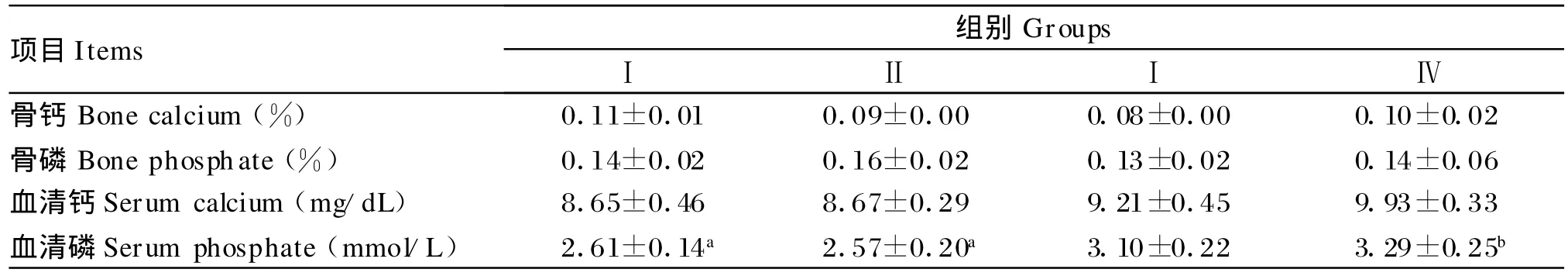
表2 不同磷水平对骨钙骨磷和血钙血磷的影响Table 2 Effects o f phosphate levels on calcium and phosphate in bone or serum
2.2 不同磷水平对血液生化指标的影响
不同磷水平对血清维生素D3(vitam in D3, VD3)、甲状旁腺素(parathyroid horm one,PTH)、ALP含量的影响均显著(P<0.05)。Ⅰ组血清中VD3的含量与其他3个处理比较,分别提高14.15%、12.44%、14.35%,差异显著(P<0.05)。Ⅰ组提高了血清中PTH含量,与Ⅳ组比较差异显著(P<0.05);Ⅰ组和Ⅱ组血清中ALP与Ⅲ组和Ⅳ组比较差异显著(P<0.05)。

表3 不同磷水平对血清维生素D3、PTH和ALP的影响Table 3 Ef fects of phosphate levels on VD 3,PTH and ALP in serum
2.3 磷水平对Na+/PiⅡb型转运载体蛋白mRNA表达量的影响
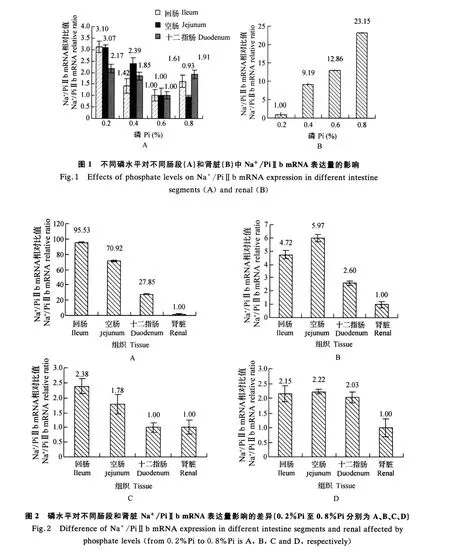
不同磷水平显著影响Na+/PiⅡb m RNA表达量(P<0.05)。Ⅰ组回肠、空肠、十二指肠Na+/PiⅡb m RNA表达量分别是Ⅲ组的3.10(P<0.01)、3.07(P<0.01)、2.17倍(P<0.05),但对十二指肠影响不显著(P>0.05),见图1(A)。Ⅰ组肾脏Na+/PiⅡb m RNA表达量比其他3个磷水平组分别低9.19、12.86、23.15倍,差异均极显著(P<0.01),但随着磷水平的增高有上升趋势,Ⅳ组分别比Ⅰ组、Ⅱ组、Ⅲ组高23.15(P<0.01)、2.15(P<0.05)、1.79倍(P<0.05),见图1(B)。不同的磷水平显著影响Na+/PiⅡb mRNA在小肠不同部位和肾脏中的表达。各组中均以回肠表达量最高;Ⅰ组中回肠Na+/PiⅡb m RNA表达量分别是空肠、十二指肠和肾脏的1.34(P>0.05)、3.43(P<0.05)和95.53倍(P<0.01);肾脏中Na+/PiⅡb m RNA的表达量最低,分别比空肠、十二指肠低70.92、27.85倍,差异极显著(P<0.01),见图2(A、B、C、D)。
2.4 不同磷水平对磷吸收的影响
不同磷水平显著影响磷吸收(P<0.05)。回肠中0.2%磷水平组分别与0.6%磷水平组、0.8%磷水平组比较差异均显著(P<0.05);肾脏对磷的重吸收随饲粮磷水平的降低有下降的趋势,但各组间差异不显著(P>0.05);可见,低磷对回肠中的磷吸收影响最大,回肠是小肠中磷吸收的主要肠段;肾、十二指肠磷吸收较少。

图3 不同磷水平对小肠BBMV中磷吸收的影响Fig.3 Effects of phosphate levels on Piup take o f BBMV
3 讨论
3.1 饲粮中钙磷比、血液生化指标与磷吸收的关系
钙磷比在1.5∶1~2∶1时对钙和磷的吸收利用率最佳[1]。本试验中各组饲粮钙磷比虽在正常的钙磷比范围内,但低磷饲粮并未降低骨组织和血清中的钙。血清钙和磷的含量均随处理中磷水平的增加而升高。这与王凤来等[9]的研究结果相一致。这说明低磷情况下只要保持钙磷比例适当,并不影响组织中钙磷的吸收。
血清ALP活性能够间接反映骨骼成骨细胞的ALP活性状况。血清A LP易受饲粮磷水平影响,但对饲粮钙磷比例反应相对较弱。饲粮低磷或磷缺乏时,导致骨组织成骨细胞增生且功能增强,使成骨细胞中的ALP大量释放进入血液,从而提高血清ALP活性[10]。PTH是一种调节磷酸盐含量的主要激素,通过抑制刷状缘膜上钠磷协同转运蛋白的表达,减少对磷的重吸收。它也能直接作用于肾小管细胞以增加肾小管对磷的重吸收[11-12]。1,25-(OH)2-D3能作用于甲状旁腺使其减少甲状旁腺素分泌[13]。本研究中,低磷提高了血液中VD3的含量,但并未降低PTH的浓度,这与高含量VD3能够抑制PTH的分泌、提高Na+/PiⅡb载体mRNA表达量的报道不一致,其机理可能与低磷情况下肾脏对磷重吸收的影响因素有关[14-15]。肾脏中磷的重吸收作用主要在于肾小管细胞cAM P水平,但低磷对该细胞是否有影响,还需要进一步研究。
3.2 Na+/PiⅡb转运载体蛋白m RNA表达量与磷吸收的关系
Na+/PiⅡb是Ⅱ型钠磷协同转运蛋白家族中的一种重要转运蛋白,即小肠顶端膜钠磷协同转运蛋白。它负责细胞内Pi的积累,维持细胞内外磷平衡[2,4]。本研究中发现,低磷条件下,大鼠回肠中Na+/PiⅡb蛋白表达最高,肾脏最低;磷的吸收也以回肠最高。这与Xu等[16]对小鼠Na+/PiⅡb转运蛋白的研究相类似。与小肠中低磷对Na+/PiⅡb影响相反的是:低磷组降低了肾脏中Na+/PiⅡb转运蛋白m RNA的表达,但肾脏中磷的吸收并非最低,这可能与肾脏中调节磷重吸收的因素相关。肾脏中磷的转运系统与肠道刷状缘膜中Na-Pi系统相似,磷通过刷状缘膜Na+/Pi转运进入肾脏近端小管,磷在肾脏中的重吸收部位主要是肾小管细胞[1]。本研究中肾脏中Na+/PiⅡb载体mRNA表达量最低,但对磷的吸收能力却比十二指肠强,这可能是因为低磷提高了肾脏中Na+/Pi转运细胞的活性。资料显示,肾脏对低磷适应的过程有2种:1)长期适应,涉及到新蛋白质的合成;2)短期适应,涉及到已存在的转运系统激活——钝化反应[2-4]。肾脏中磷重吸收的提高可能是其短期适应的一个反映。此外,可能与Na+/PiⅡa载体转运蛋白有关,肾脏中Na+/PiⅡa是钠磷转运系统中另外一种重要的转运蛋白[2]。但低磷是否对其有影响,有待进一步研究。
3.3 饲粮中维生素D3和低磷对磷吸收的影响
VD[1,25-(OH)2-D3]促进磷的吸收,其原因主要是其可促进小肠黏膜上皮细胞对磷的转运。通过治疗大鼠发现VD[1,25-(OH)2-D3]可以刺激刷状缘Na+/PiⅡb协同转运[14]。也有学者认为VD通过改变Na+/PiⅡb基因的表达而影响无机磷的转运效率[15]。本研究显示,只有0.2%低磷组提高了血清中VD3的浓度,其他几个水平组均无变化。这可能是机体在对低磷的适应性过程中,通过刺激血浆1,25-(OH)2-D3的增高而提高了对磷的利用率[1]。
低磷可降低动物血液和骨骼中的磷含量,血液和骨骼中的磷可作为机体磷平衡状况的评价指标。磷酸盐通过肠细胞膜主动运输的过程是通过Na+依赖型转运载体蛋白调控进行的“饱和过程”,其转运速度具有最大值,超负荷的吸收会超过载体的运载能力,从而导致粪磷排出[17]。这为生产上提倡采用低磷饲粮提供了理论基础。当动物机体不能利用过剩的磷时,磷将被排出体外,造成环境污染。低磷饲粮可提高Na+依赖型无机磷跨肠道上皮转运的流通速度以及提高肠道刷状缘膜对无机磷的最大转运速度[18]。本研究证明,饲粮中含总磷0.2%时,可提高Na+/PiⅡb转运载体蛋白m RNA的表达量,这可能与低磷提高了肠道刷状缘膜对无机磷的转运速度以及增加了肠膜对磷的吸收有关[19]。吴信等[20]通过总磷为0.36%、0.38%、0.45%的低磷水平饲粮对不同阶段生长猪生产性能和生态环境的影响的研究也发现,生长猪的生长性能并没有降低,但粪磷排放量减少了19%~25%。
4 结 论
①低磷提高了小肠中Na+/PiⅡb转运载体蛋白m RNA表达量和对磷的吸收。
②大白鼠Na+/PiⅡb转运载体蛋白m RNA表达量以回肠最高,肾脏最低。
[1] 霍启光.动物磷营养与磷源[M].北京:中国农业科技出版社,2002:22-37.
[2] 张永刚,李铁军,印遇龙,等.磷的吸收转运机制研究进展[J].广西农业生物科学,2006,25:363-368.
[3] 方热军.猪植物性饲料磷真消化率及其真可消化磷预测模型的研究[D].博士学位论文.雅安:四川农业大学,2003:1-8.
[4] W ang B,Y in Y L.Regulation of the typeⅡb sodium-dependent phosphate cotransporter expression in the intestine[J].Front Agriculture China,2009,3 (2):226-230.
[5] 何 诚.实验动物学[M].北京:中国科技出版社, 2006:55-58.
[6] Schroder B,Kappner H,Failing K.Mechanism of intestinal phosphate transport in small rum inants[J]. British Journal of Nutrition,1995,74(5):635-648.
[7] Schroder B,Hattenhauer O,Breves G.Phosphate transport in pig p roximal small intestines during postnatal development:lack o f modu lation by calcium[J]. Journal of Endocrinology,1998,139(4): 1 500-1 507.
[8] 孙 杰.大白猪和五指山猪小肠钠依赖型磷转运吸收的比较研究[D].硕士学位论文.青岛:山东理工大学,2006:8-9.
[9] 王凤来,张曼夫,陈清明,等.日粮磷和钙磷比例对小型猪(香猪)血清、肠、骨碱性磷酸酶及血清钙磷的影响[J].动物营养学报,2001,13(1):36-42.
[10] 刘海霞,王子轼,顾建红,等.磷对体外培养番鸭破骨细胞生成及骨吸收功能的影响[J].动物营养学报,2008,20(1):102-107.
[11] Teneni Q,Ouse H S.Regulation of phosphorus homeostasis by the type Na/phosphate cotransporter [J].Annual Review of Nutrition,2005,5:197-214.
[12] Elhalel M D,W ald H,Rubinger D,et al.Regulation of NaPi-Ⅱa m RNA and transporter p rotein in chronic renal failure:role o f parathyroid hormone (PTH)and dietary phosphate(Pi)[J].Pflügers Archiv-European Journal of Physiology,2004,449(3): 265-270.
[13] H ilfiker H,Hattenhauer O,Traebert M,et al.Characterization of a urine typeⅡsodium-phosphate cotransporter exp ressed in mamm alian sm all intestine [J].Process Natural A cadem ic Science,1998,95: 14 565-14 569.
[14] Meyer R A,Gray RW,Meyer M H.Abnorm al vitam in D metabo lism in the X-linked hypophosphatem ic m ouse[J].Endocrinology,1980,107: 1 577-1 581.
[15] Capuano P,Radanovic T,W agner C A,et al.Intestinal and renal adap tation to a low-Pi diet o f typeⅡNa/Pi co-transporters in vitam in D recep tor and 1-alpha OHase-deficientm ice[J].Animal Journal of Physiology Cell Physiology,2005,288(2):429-434.
[16] Xu H,Bai L Q,Co llins J F,et al.Age-dependent regulation of rat intestinal typeⅡb sodium-phosphate co-transporter by 1,25-(OH)2vitam in D3[J]. Animal Journal of Physiology—Cell Physiology, 2002,282:487-493.
[17] Radanovic T,W agner C A,M urer H,et al.Regulation o f intestinal phosphate transport I segmental expression and adaptation to low-Pidiet of the typeⅡb Na+-Pi co-transporter in mouse small intestine [J].Animal Journal of Physio logy—Gastrointest Liver Physio logy,2005,288(3):496-500.
[18] Sugiura SH,Ferraris N K.In vivofractional Piabsorp tion and Na/Pi-ⅡmRNA exp ression in rainbow trout are up regulated by dietary P restriction[J]. Animal Journal o f Physiology—Comparison Physiology,2003,285:770-781.
[19] Marks J,Srai S K,Biber J,et al.Intestinal phosphate absorp tion and the e ffect o f vitam in D:a comparison o f rats w ith m ice[J].Experimental Physiology,2006,91(3):531-537.
[20] 吴 信,印遇龙.低氮低磷日粮对生长育肥猪生产性能和生态环境的影响[J].安徽农业科学,2006,34 (22):5 870-5 876.
*Correspond ing au thor,p rofessor,E-m ail:fangr j63@126.net
(编辑 胡婷)
