葡萄糖对INS-1细胞活性氧及PTEN表达的调控
2010-04-13周湘兰周连华杨志红胡仁明刘珊林黎丹凤何建秋
肖 玲 周湘兰 周连华 杨志红 胡仁明 刘珊林 黎丹凤 何建秋
(1.复旦大学附属金山医院内分泌科,上海 200540;2.复旦大学附属华山医院内分泌科,上海 200040;3.复旦大学自由基调控与应用研究中心,上海 200032)
糖尿病是由于靶组织细胞对胰岛素敏感性降低合并胰岛β细胞功能不足引起,以慢性高血糖为特征的多因素疾病。其中胰岛β细胞数量及功能不足是导致糖尿病发生的最根本原因,因此胰岛β细胞功能调控是糖尿病研究的重要课题。
影响胰岛β细胞数量及功能的因素主要有高糖、高脂、遗传、年龄、胰高血糖素样肽I(GLP-1)、胰淀素、胰岛素抵抗。其中大多数因素均可导致机体氧化应激增加,包括活性氧(reactive oxygen species,ROS)的增多。ROS化学性质活泼,可直接攻击核酸、蛋白等生物分子,影响机体功能。低浓度ROS可以作为信号分子参与许多生理过程,如生理浓度的ROS作为信号分子之一参与葡萄糖刺激胰岛β细胞分泌胰岛素(GSIS)的信号通路[1-3]。ROS作为细胞内信号分子,其下游信号途径有多种[4],包括PTEN(phosphatase with sequence homology to tensin)及其他的线粒体通透转运孔道(PTPs)。目前,尚不清楚ROS是否对胰岛β细胞PTEN具有调节作用,ROS是否通过调控第10号染色体缺失的磷酸酶与张力蛋白同源物基因(PTEN)而参与葡萄糖刺激的胰岛素分泌(GSIS)信号通路。本研究通过不同浓度糖及H2O2对胰岛细胞系(INS-1)干预,探讨ROS调控胰岛素分泌机制。
1 资料与方法
1.1 材料 INS-1细胞由复旦大学附属华山医院内分泌研究所提供。RMPI1640培养基为GIBCO公司产品,胎牛血清为Hyclone公司产品;大鼠胰岛素酶联免疫吸附试验(ELISA)试剂盒为Mercodia公司产品;细胞ROS检测试剂盒为碧云天生物技术研究所产品;逆转录试剂盒为TOYOBO产品;2×Taq PCR MasterMix为 Tiangen公司产品;30%H2O2溶液为分析纯产品。
1.2 方法
1.2.1 INS-1细胞培养与干预 INS-1细胞(第75代),置20%FBS1640培养液培养,细胞贴壁生长。传至4~5代后,以1×106/孔接种在6孔板,培养贴壁后,弃培养液,用PBS洗2次,各孔分别加入终浓度为 0、3、7、11和20 mmol◦L-1的无菌葡萄糖和终浓度为 0、1 μmol◦L-1、2 μmol◦L-1、4 μmol◦L-1、6 μmol◦L-1和 8μmol◦L-1的 H2O2,在无血清培养液孵育30 min,收集细胞检测 ROS,抽提 RNA,留取培养液测胰岛素分泌。
1.2.2 INS-1细胞分泌胰岛素的检测 按ELISA试剂盒说明书操作。
1.2.3 INS-1细胞内ROS的检测 DCFH-DA荧光法,按试剂盒操作。
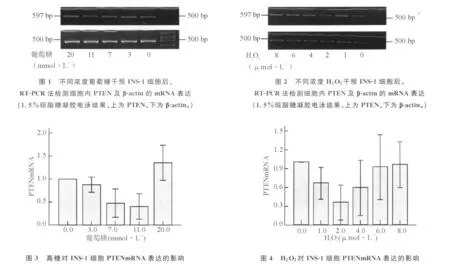
1.2.4 反转录-聚合酶链反应(RT-PCR)法测INS-1细胞PTENmRNA的表达 分别收集高糖和H 2 O2干预后的INS-1细胞,提取总 RNA,逆转录成cDNA,进行PCR扩增,产物用1.5%琼脂糖凝胶电泳分析。PTEN 引物序列:F:5′-TGGCTAAGTGAAGACGACAATC-3′;R:5′-CGCACGCTCTATACTACAAATG-3′;扩增长度:597 bp;变性温度94℃,退火温度为52.7℃,延伸温度72℃,25个循环 。β-actin 引物序列:F:5′-TGGCTAAGTGAAGACGACAATC-3′ R: 5′-CGCACGCT CTATACTACAAATG-3′扩增长度:500 bp;变性温度94℃,退火温度为52.7℃,延伸温度72℃,25个循环。
1.3 统计学分析 使用SPSS 13.0软件,采用单因素方差分析和两两比较的Dunnett方法分析数据,检测数据用(¯x±s)表示,P<0.05为差异有统计学意义。
2 结 果
2.1 葡萄糖对INS-1细胞胰岛素分泌、ROS的影响 随着葡萄糖干预浓度升高,INS-1细胞分泌胰岛素和胞内ROS水平逐渐增高。经Dunnett法检验,对照组与干预组之间差异有统计学意义,经干预后胰岛素分泌及胞内ROS水平均较对照组明显升高(表1)。
2.2 H2 O2对INS-1细胞胰岛素分泌、ROS的影响随着H2O2干预浓度升高,INS-1细胞分泌胰岛素和胞内ROS水平逐渐增高。经Dunnett法检验,对照组与干预组之间差异均有统计学意义(表2),经干预后胰岛素分泌及胞内ROS水平均较对照组明显升高。
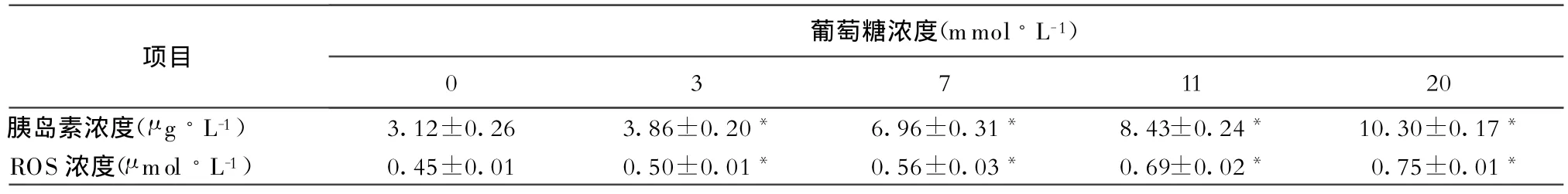
表1 不同浓度葡萄糖干预INS-1细胞后,细胞分泌胰岛素和胞内ROS变化(¯x±s)

表2 不同浓度H2 O2干预INS-1细胞后,细胞分泌胰岛素和胞内ROS变化(¯x±s)
2.3 葡萄糖对INS-1细胞PTENmRNA表达的影响 随着葡萄糖干预浓度升高,PTENmRNA表达受到抑制,呈下降趋势,但当葡萄糖浓度超过 11 mmol◦L-1时,抑制作用消失,PTENmRNA表达上升。经单因素方差分析法检验,各组细胞PTEN-mRNA表达不全相同(P<0.001);经Dunnett法检验各干预组与对照组,结果显示葡萄糖浓度为 7 mmol◦L-1和11 mmol◦L-1与对照组相比差异显著,提示葡萄糖浓度为7 mmol◦L-1和11 mmol◦L-1时,明显抑制PTENmRNA表达;Dunnett法检验各干预组与11 mmol◦L-1干预组,结果显示葡萄糖浓度为20 mmol◦L-1组与 11 mmol◦L-1组之间存在显著差异,提示葡萄糖浓度为 20 mmol◦L-1时,对PTENmRNA表达抑制作用消失(图1、图3)。
2.4 H2O2对INS-1细胞PTENmRNA表达的影响 随着H 2 O2干预浓度升高,PTENmRNA表达受到抑制,呈下降趋势,但当H2O2浓度超过 2μmol◦L-1时,抑制作用消失,PTENmRNA表达上升。经单因素方差分析法检验,各组PTENmRNA表达不全相同(P=0.006);经Dunnett法检验各干预组与对照组,结果显示 H 2O2浓度为2μmol◦L-1与对照组相比有显著差异,提示H 2O2浓度为2μmol◦L-1时,明显抑制PTENmRNA表达;Dunnett法检验各干预组与2μmol◦L-1干预组,结果显示H2O2浓度为 1 μmol◦L-1、6 μmol◦L-1、8 μmol◦L-1组与2 μmol◦L-1组之间差异均有统计学意义。提示低浓度H2O2抑制PTENmRNA表达,H2O2浓度为2μmol◦L-1时,抑制作用最强;随着H2O2浓度升高抑制作用减弱,当H2 O2浓度达 6 μmol◦L-1、8 μmol◦L-1时,对 PTEN-mRNA表达抑制作用消失(图2、图4)。
3 讨 论
2008年,糖尿病病理生理研究专家DeFronzo教授指出,β细胞衰退的进程比我们想象的要早得多。胰岛素和葡萄糖的比值在正常糖代谢的肥胖人群几乎已经下降了一半,胰岛β细胞功能损失在空腹血糖受损人群中可达50%,在糖耐量受损人群中可达 80%,而在新诊断的 2型糖尿病患者中达90%,β细胞存活量损失50%。
同其他细胞类型相比,胰岛β细胞的抗氧化酶表达低下,清除ROS减少,使得胰岛细胞更易遭受ROS损伤,同时也为 ROS参与胰岛β细胞代谢信号通路提供了便利[5]。ROS作为细胞内信号转导分子,其作用的下游信号途径包括以下几种:电压门控的 K+通道[6]和 Ca+通道[7-8];PTEN及其它的PTPs[4]、c-JUN NH2末端激酶[9]、细胞外信号调控激酶[10]和NFκB[11]等。其中,PTEN是蛋白酪氨酸磷酸酶(PTPs)家族的一员,它通过负向调控磷酯酰肌醇 3-激酶(PI3K)-蛋白激酶 B(AKT)信号通路[9],成为重要的肿瘤抑制因子。并成为很多细胞内信号通路的重要调控点。已有越来越多的研究者[10]开始对PTEN蛋白表达、稳定性及PTEN基因进行研究。迄今为止,尚无ROS是否对胰岛β细胞PTEN表达具有调节作用的报道,而葡萄糖是否通过诱导低浓度ROS生成,抑制胰岛β细胞PTEN表达而调控胰岛素分泌有待验证。本研究分别用不同浓度葡萄糖和H 2 O2干预INS-1细胞30 min,发现中低浓度葡萄糖和H2O2都可以促进细胞分泌胰岛素,同时,细胞PTENmRNA表达受到抑制,但随着刺激浓度进一步升高,这种抑制PTENmRNA表达作用消失,而胰岛素分泌继续增加。有很多其他研究也支持了本实验结果:Pi等[5]通过实验证实,在INS-1细胞和正常小鼠胰岛细胞,高糖刺激细胞分泌胰岛素时,细胞内ROS浓度升高,用低浓度H 2 O2刺激细胞也可使细胞分泌胰岛素增加。而用抗氧化剂则可抑制细胞分泌胰岛素。有研究[1-2]发现,H 2O2和可刺激细胞内产生H 2 O2的四氧嘧啶,都能刺激大鼠胰腺和INS-1细胞分泌胰岛素,并伴有细胞内Ca+升高。在神经母细胞瘤细胞内,胰岛素刺激的细胞内ROS升高,可以氧化抑制PTEN的活性,并引起细胞内PIP3升高[3]。在神经胶质细胞瘤细胞,H2 O2可以氧化抑制PTEN的活性,同时伴有细胞内PI3K活性增强和PIP3浓度升高;而在敲除PTEN基因的神经胶质细胞瘤细胞内,H2O2刺激则对PI3K活性和PIP3浓度无影响。在吞噬细胞的研究[10-11]也提示H 2O2可以氧化抑制PTEN的活性。但至今,除H2O2氧化抑制PTEN的活性外,对PTEN表达影响的报道少见。
本研究发现在高浓度葡萄糖和 H 2 O2水平,PTENmRNA表达不再受到抑制,而有上升趋势。随着干预INS-1细胞的葡萄糖和H2 O2浓度升高,PTENmRNA表达被抑制,但当葡萄糖和H2O2浓度升高超过一定程度时,这种抑制作用消失。ROS氧化抑制PTEN途径只是GSIS信号转导途径之一,而经典的ATP依赖胰岛素分泌途径仍然占主要地位;同时,在GSIS过程中,除 ROS外可能还存在很多其它因素影响PTENmRNA的表达。
很多转录因子在转录水平对PTEN基因表达起调节作用。早期生长反应-1(EGR-1)、过氧化物酶体增殖物激活受体γ(PPARγ)和p53都可以直接与PTEN基因的启动子部位结合,并诱导转录活化[12]。而核因子-κB(NF-κB)则可以抑制PTEN 表达。用药物活化 PPARγ可以诱导PTEN基因表达[13],而细胞因子诱导的 NF-κB活化则可以使PTEN基因表达下调。这些均提示有一个相当复杂的系统在转录水平对PTEN基因表达进行调节。
综上所述,在INS-1细胞内,中低浓度葡萄糖代谢会产生低浓度 ROS,ROS会抑制PTEN基因的转录,逆转其对PI3K/AKT信号通路的负向调控,从而介导胰岛素分泌。这种抑制PTEN表达作用在一定浓度范围内,随浓度升高抑制作用增强;但超过一定浓度范围后(如葡萄糖>11 mmol◦L-1,H 2O2>2 μmol◦L-1),则抑制PTEN 表达,介导胰岛素分泌的作用消失。这与临床观察一致,即血糖升高刺激胰岛素分泌增加,但血糖过高反过来对β细胞有毒性损害,而空腹血糖超过11.1 mmol◦L-1时高糖毒性明显。这种ROS对PTEN表达调控的双重性,体现了机体ROS作用的复杂性,对我们抗氧化剂临床应用研究有重要启示作用。同时也可能是PTEN转录受一个复杂的系统调控的结果反映。此外,ROS对PTEN在蛋白表达和功能水平上的氧化抑制作用对其下游信号调节也至关重要,葡萄糖刺激引起的ROS升高是否在蛋白表达和功能水平对胰岛β细胞PTEN有抑制作用,还有待于进一步研究。
1 Maechler P,Jornot L,Wollheim CB.Hydrogen peroxide alters mitochond rial activation and insulin secretion in pancreatic beta cells[J].Biol Chem,1999,274:27905-27913.
2 Janjic D,Maechler P,Wolheim CB,et al.Free radical modulation of insulin release in INS-1 cells exposed to alloxan[J].Biochem Pharmacol,1999,57:639-648.
3 Ebelt H,Peschke D,Bromme HJ,et al.Influence of melatonin on free radical-induced changes in rat pancreatic beta-cells in vitro[J].Pineal Res,2000,28:65-72.
4 Rhee SG,Kang SW,Jeong W.Intracellular messenger function of hydrogen peroxide and its regulation by peroxiredoxins[J].Curr Opin Cell Biol,2005,17:183-189.
5 Pi JB,Bai YS,Zhang Q,et al.Reactive oxygen species as a signal in glucose-stimulated insulin secretion[J].Diabetes,2007,56(7):1783-1791.
6 Archer SL,Wu XC,Thebaud B.O2sensing in the human ductus arteriosus:redox-sensitive K+channels are regulated by mitochondria-derived hydrogen peroxide[J].Biol Chem,2004,385:205-216.
7 Kraft R,Grimm C,Grosse K.Hyd rogen peroxide and ADP-ribose induce TRPM2-mediated calcium influx and cation currents in microglia[J].Physiol Cell Physiol,2004,286:129-137.
8 Krippelt-Drews P,Haberland C,Fingerle J.Effects of H2O2on membrane potential and[Ca+]I of cultured rat arterial smooth muscle cells[J].Biochem Biophys Res Commun,1995,209:139-145.
9 Myers MP,Pass I,Batty IH,et al.The lipid phosphatase activity of PTEN is critical for its tumor sup ressor function[J].Proc Natl Acad Sci USA,1998,95:13513-13518.
10 Vazquez F,Ramaswamy S,Nakamura N,et al.Phosp horylation of the PTEN tail regulates protein stability and function.Mol[J].Cell Biol,2000,20:5010-5018.
11 Leslie NR,Bennett D,Lindsay YE.Redox regulation of PI 3-kinase signalling via inactivation of PTEN[J].EMBO,2003,22:5501-5510.
12 Virolle T,Adamson E D,Baron V,et al.The Egr-1 transcription factor directly activates PTEN during irradiation-induced signaling[J].Cell Biol,2001,3:1124-1128.
13 Patel L,Pass I,Coxon P et al.Tumor sup pressor and anti-inflammatory actions of PPARgamma agonists are mediated via upregulation of PTEN[J].Cur r Biol,2001,11:764-768.
