红豆草ISSR体系优化及其在航天诱变种质鉴定中的应用
2010-03-31沈紫微陈本建康俊梅魏小兰张蕴薇
沈紫微,陈本建,康俊梅,魏小兰,张蕴薇
(1.甘肃农业大学草业学院,甘肃兰州 730070;2.中国农业科学院北京畜牧兽医研究所,北京 100193;3.中国农业大学动物科技学院,北京 100193)
随着航天技术的发展,空间生命科学的研究逐渐引起科学家的重视。我国从20世纪80年代才开始用返回式卫星和高空气球搭载种子进行航天诱变育种研究。1987年我国在发射的第9颗返回式卫星上首次进行了将蔬菜等农作物种子搭载上天的试验[1]。20世纪90年代以后报道[2-6]日趋增多。许多科技工作者通过航天搭载和地面选育相结合选育出了一批优良新品种[7-9],证实航天育种在新品种选育方面具有十分广阔的前景,是创造新突变型的一条新途径。
红豆草(Onobrychis viciaefolia)是豆科红豆属多年生草本植物,原产于欧洲,在我国许多地方引种栽培,效果良好。其适生于酸性土壤的森林草原,抗旱性、抗寒性和抗病虫害能力均较强。由于其富含蛋白质、氨基酸,且粗脂肪、钙和磷含量较高,茎叶繁茂,草质柔软,为各类家畜和家禽所喜食,因此具有“牧草皇后”的美誉。除此之外,红豆草根系极为发达,根瘤菌较多,对改良土壤有重要作用[10]。然而,目前对红豆草的遗传多样性和遗传结构所知甚少。
作为众多新型分子标记技术中的一种,简单重复序列间区(inter-simple sequence repeatI,SSR),是由Zietkiewicz等[11]1994年提出的微卫星分子标记基础上发展起来的一种分子标记,用于检测SSR间DNA序列差异。虽然ISSR技术提出时间不久,但已广泛应用于包括草业在内的很多领域。2005年Mcroberts等[12]用 ISSR对4个印度哈里亚纳邦一年生的某杂草种子进行多态性分析。2007年肖海峻和徐柱[13]用ISSR技术研究了90份鹅观草(Roegneria klamojii)材料,发现其遗传多样性指数的大小与其所处生境的纬度、海拔高度和年均降雨量的相关性达到显著或极显著。2007年Li等[14]用4种分子标记方法对中国东北的松嫩平原上的野大麦(Hordeum brevisubulatum)品种进行了多态性分析。另外,有关ISSR的分子标记技术在冰草属(Agropyron)和雀麦属(Bromus)中也有所应用[15]。可见,ISSR标记是揭示植物遗传多样性,进行QTL定位和分子作图的有效手段。但到目前为止,除有关于航天搭载红豆草生理生化变异方面研究[16]的报道外,运用分子标记技术研究航天搭载红豆草遗传物质变异情况鲜见报道。本研究以航天搭载的红豆草种子播种的植株为试验材料,利用正交试验设计,对红豆草ISSR反应体系进行优化分析,并对53个ISSR引物进行筛选,以期获得适合于红豆草的ISSR反应体系;同时利用已优化好的ISSR体系及筛选出的引物对航天搭载及对照材料进行分子标记,检测在空间环境影响下航天搭载材料的基因组DNA的变异情况,以期为今后构建红豆草ISSR图谱奠定基础,对今后深入研究红豆草航天诱变机理提供重要参考。
1 材料和方法
1.1 试验材料本试验所用红豆草材料来自北京海淀区中国农业大学上庄试验地。2006年精选红豆草种子,一部分搭载“实践八号”育种卫星,于9月9日在酒泉卫星发射中心升空,卫星在近地点187 km、远地点463 km的近地轨道运行,于9月24日返回地面。另一部分贮存于地面常温条件下,作为对照。于2008年温室育苗,移栽于试验地。2009年9月选取红豆草变异单株75株及地面对照14株,采集幼嫩叶片作为供试材料。用冰盒迅速带回,放置于-20℃冰箱保存。
1.2 基因组DNA的提取和检测采用十六烷基三甲基溴化铵(cetyl trimethyl ammonium bro-mide,CTAB)法提取基因组DNA,并用1%琼脂糖凝胶电泳检测DNA的纯度和浓度,最后将样品质量浓度稀释至50 ng/μ L,置于-20℃冰箱保存。其中75株变异植株采用单株提取DNA的方式,对照植株按单株提取DNA的方式提取了田间14株普通植株叶片。
1.3ISSR-PCR反应体系正交试验设计采用加拿大哥伦比亚大学(University of British Columbia,UBC)所设计的ISSR通用引物,其中808号引物适合于多种植物,以其为固定引物进行反应体系的构建[17-21]。采用L9(34)正交设计表,根据相关文献[17-20]的ISSR-PCR反应体系,首先对dNTP、引物浓度、Taq酶浓度、Mg2+浓度进行4因素 3水平的探索正交试验(表 1、表2),再根据探索正交试验的结果缩小各个因素的浓度梯度,进行细调正交试验。除表中变化因素外,每管(25 μ L体系)中还含有 1×buffer和 50 ng模板DNA,试验设2次重复,取对照植株叶片DNA作供试样本。ISSR引物购自上海生物工程技术服务有限公司,dNTP及TaqDNA聚合酶均购自大连宝生物(TaKaRa)工程技术服务有限公司。
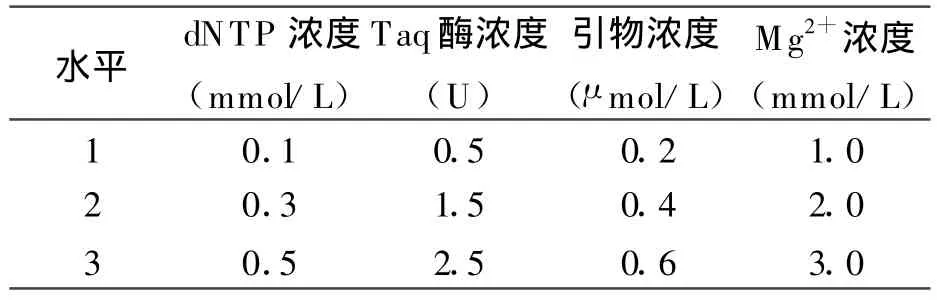
表1 探索正交试验水平—因素
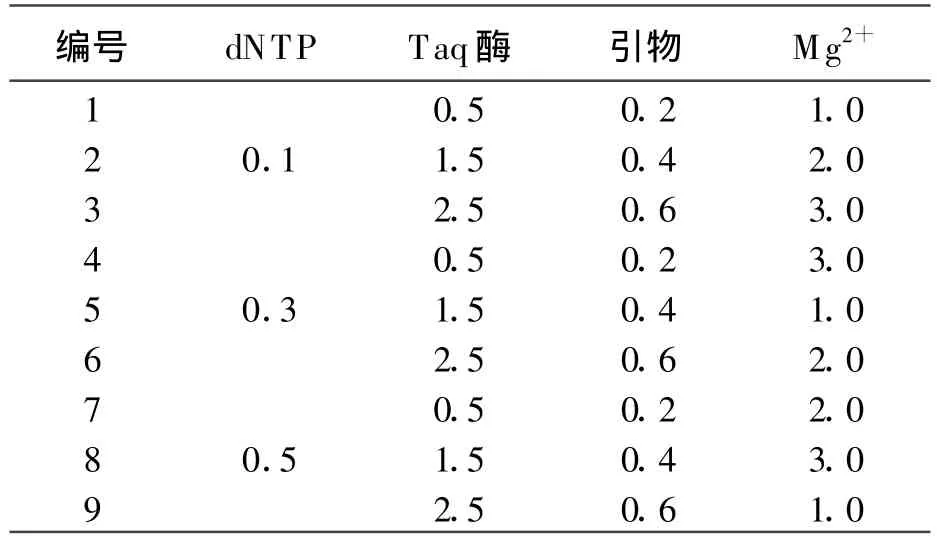
表2 探索正交试验设计表-L9(34) μ L
1.4PCR反应程序利用正交试验设计构建适合红豆草的ISSR-PCR最优反应体系。PCR扩增反应在PTC-200(MJ Research Peltier T hermal Cycler,USA)PCR仪上进行,扩增程序为:94℃预变性3 min,94℃变性30 s,52℃退火30 s,72℃延伸2 min,进行35个循环,最后72℃再延伸4 min,然后置于4℃保存。扩增反应结束后,取5.0 μ L 扩增产 物,加入 1.0 μ L 上 样缓冲液(6%溴酚蓝),然后在2%的琼脂糖凝胶上点样,5 V/cm电泳1~1.5 h,最后在紫外凝胶成像系统(美国BIO-RAD公司生产)上观察并照相。
1.5引物筛选与最佳退火温度的确定在已优化好的体系的基础上筛选引物及最佳退火温度。所用引物参照加拿大哥伦比亚大学公司公布的ISSR引物序列[22],从相关文献中找出较为适合红豆草的53个引物,经过PCR扩增筛选,选出扩增条带较多、信号强、背景清晰的引物,由上海生物工程公司(Sangon)合成。然后针对筛选出的引物,使用 T-Gradient(Biometra)梯度 PCR仪,对各个引物进行最佳退火温度的筛选。试验设 12 个退火温度梯度 :46.0、46.3、47.3、48.8、50.5、52.2、53.8、55.5、57.2、58.7、59.7和 60.0 ℃。
1.6 数据统计与分析电泳图谱中的每一条带均为1个分子标记,代表在模板上有1个引物结合位点,对凝胶上的带进行统计,按照电泳图谱中同一位置上带的有无进行统计,有带的记为1,无带的记为0,获得二元数据矩阵。利用 POPGENE32软件[23]计算多态位点百分率(P),Nei基因多样性指数(h),Shannon多态性信息指数(I)。
2 结果与分析
2.1ISSR-PCR反应体系的构建与优化
2.1.1ISSR-PCR正交试验设计的探索性正交试验结果与分析 各处理组合结果具有明显差异。1、3号处理均有1个重复未扩增出条带,2号处理扩增条带不清晰,5、8、9号处理重复性不太好,说明这些组合反应体系稳定性不高或不适宜组合(图1)。可能由于试验设计的各个因素梯度较大 ,有些处理偏离最优组合较远。但4、6、7号处理组合,尤其是4号处理组合重复性好,条带多且清晰(图1),说明距最优组合偏差不大。再以其为基点,缩小各个因素的浓度梯度进行细调正交试验。
2.1.2ISSR-PCR正交试验设计的细调性正交试验结果与分析 细调正交试验的各因素浓度范围调整为dNTP 0.1~0.3 mmol/L,Taq酶0.5~2.5 U,Mg2+2.0~3.0 mmol/L,引物 0.2~0.4 μ mol/L。结果显示,每一处理组合基本都可扩出数条条带。其中1、2、3和 9号条带较弱,且多态性不高;4、6、9号处理重复性不好,说明其反应体系不太稳定。试验效果最好的是5和8号处理组合,扩增条带较清晰、重复性也好,为最佳的处理组合(图2)。
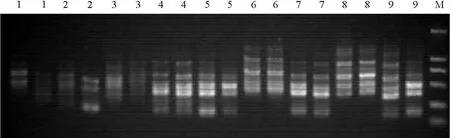
图1 ISSR-PCR探索正交试验结果
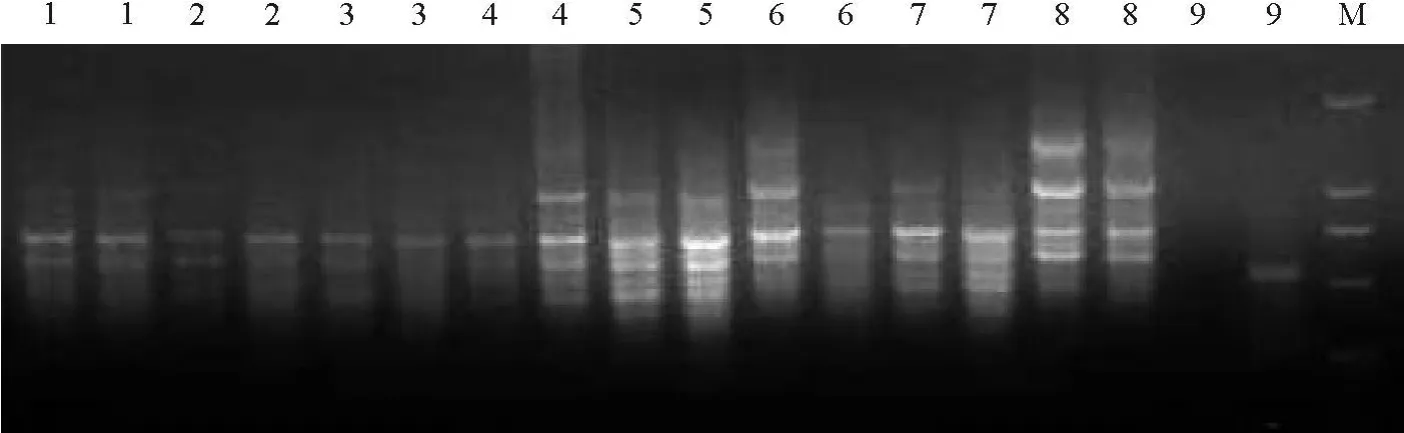
图2 ISSR-PCR细调正交试验结果
参照张丽等[24]的方法,对各组分浓度组合的正交试验结果进行了正交直观统计分析(表3),结果显示,在选定的3个水平范围内,Mg2+、dNTP、引物和Taq DNA聚合酶4个因素对结果的影响依次为引物>dNTP>TaqDNA聚合酶>Mg2+。从最佳浓度确定值结果来看,dNTP以水平2好,Taq DNA聚合酶以水平2好,引物以水平3好,Mg2+以水平3好,由此可得最佳理论处理组合为:dNTP 0.2 mmol/L、Taq DNA 聚合酶1.5 U 、引物0.4 μ mol/L 、Mg2+3 mmol/L 。
该组合与细调正交试验结果选出的最佳组合5最接近,仅Mg2+的浓度有差异,其他各组分浓度均一致;其次与组合8也较接近,二者的Mg2+浓度和Taq DNA聚合酶浓度均一致,仅dNTP和引物存在差异。为了进一步验证,将该理论组合与5号及8号处理组合进行比较,所用的DNA模板为随机选取的6份诱变材料DNA。结果显示(图3),这3个扩增体系条带基本一样,但5号组合扩增出的有些条带明显较亮,且扩增条带数较多。因此,进一步确定组合5为最优组合,选用其为正式试验的ISSR-PCR反应体系。
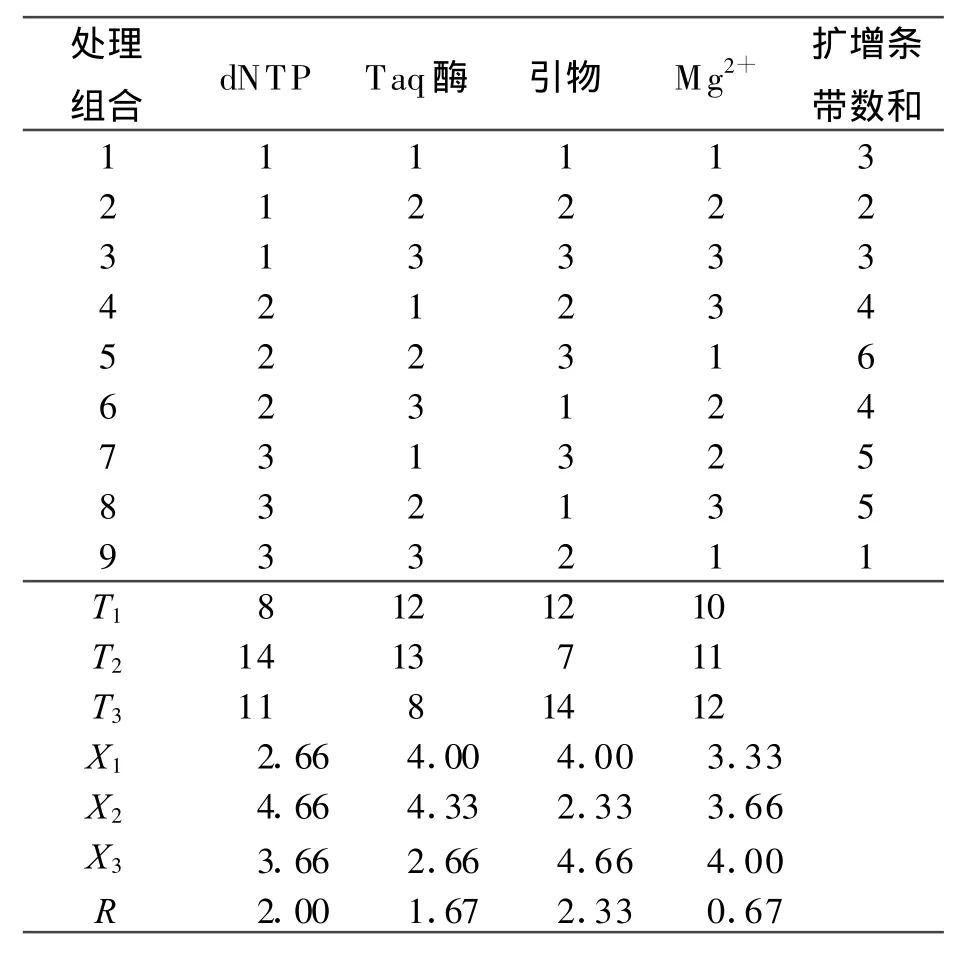
表3 ISSR-PCR细调正交试验结果直观分析

图3 3种反应体系结果的比较
2.2 引物及其最佳退火温度的筛选对53个引物进行筛选,最终筛选出12个条带清晰,多态性较好的引物,同时确定了各引物的最佳退火温度(表4),部分结果见图 4、5。在这 12条引物中(AG)n有5条,(GA)n有1条,(AC)n有2条,说明红豆草基因组中存在大量的(AG)、(GA)、(AC)二核苷酸重复序列。
2.3ISSR初步分析遗传多样性利用已优化好的红豆草ISSR-PCR反应体系对试验材料进行遗传多样性分析。通过琼脂糖凝胶电泳检测分析,经过12个引物扩增,记录的条带大小范围为300~1 000 bp,共获得193个扩增位点(表5),其中多态性位点142个,多态性比率为73.6%,每个引物的扩增位点为10~23个,平均16.1个,其中多态性位点7~18个,平均11.8个,部分结果见图6。
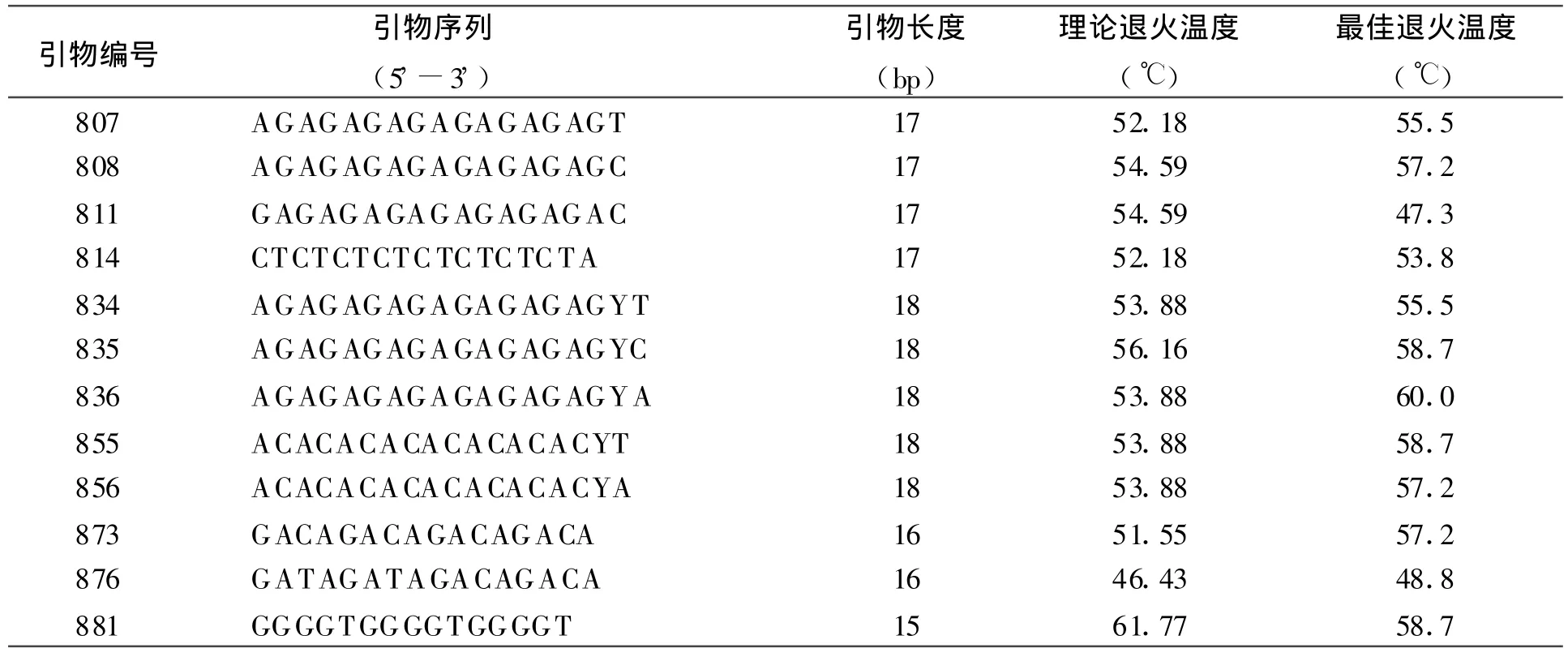
表4 引物及最佳退火温度筛选结果

图4 引物834最佳退火温度的确定

图5 引物836最佳退火温度的确定
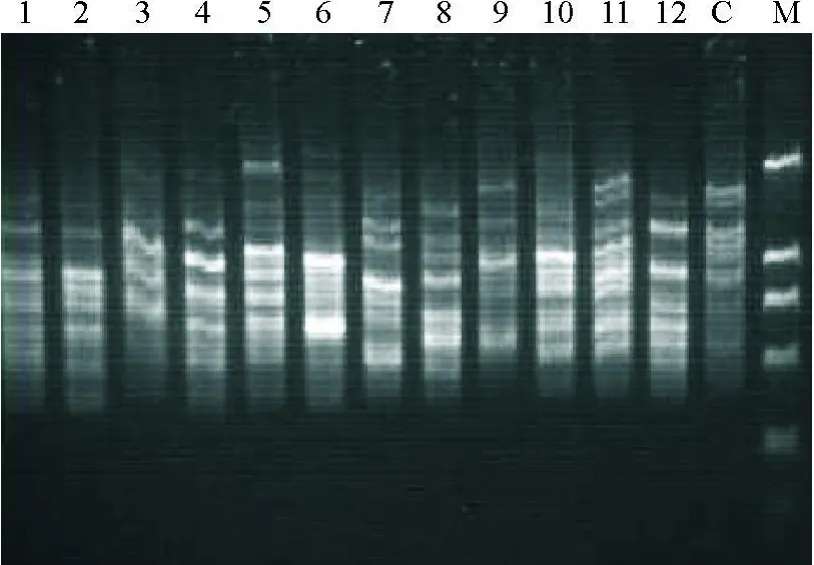
图6 引物UBC808对红豆草部分样品基因组DNA的ISSR-PCR扩增结果
为了进一步分析搭载和对照之间遗传变异的差别,在75株变异单株中随机抽取14株,与14株对照植株一起获得搭载植株与对照植株的二元数据矩阵,利用POPGENE32软件分析。航天诱变植株多态位点百分率为(P)68.60%,Nei基因多样度为0.374 3,Shannon多样性指数为0.555 6;而地面对照多态位点百分率为41.50%,Nei基因多样度为0.256 8,Shannon多样性指数为0.414 7,均低于航天诱变种,表明航天诱变增加了红豆草遗传变异。

表5 ISSR分子标记扩增结果
3 讨论
空间环境中的强辐射、微重力和超真空等特殊环境可引起植物及其后代发生变异,包括形态学变异、细胞学变异、生理生化变异及遗传物质的变化等[25]。ISSR是由SSR(simple sequence repeats)发展而来的一种新的分子标记,操作简单,检测结果方便,并具有SSR的稳定性,比RAPD具有更高的多态性,是检验分子水平上遗传变异的好手段[26-27]。
ISSR标记虽然结合了RAPD和SSR等分子标记技术的优点,具有较高的可重复性和稳定性,但在PCR反应中受反应条件、扩增程序、供试材料不同的影响,其扩增结果差异也很大。如体系中各个因素间都会发生相互作用,从而影响试验结果。因此,在试验过程中必须采用稳定的PCR反应体系。本研究证明采用不同的体系组合对红豆草ISSR-PCR扩增结果影响很大。通过对前人[28-30]所做的一些植物资源的ISSR-PCR反应体系优化研究的总结,在 Taq DNA聚合酶的用量上,本研究最后结果确定的用量为1.5 U。但大多数研究者[28-31]在考虑到Taq DNA聚合酶价格的基础上,在节省成本的情况下均选择1 U的用量。本研究在细调正交试验设计中本欲缩小 Taq DNA聚合酶用量到1 U,但由于扩增条带不理想,大多数泳道条带较弱,有的甚至无条带,故仍选择1.5 U的用量。在dNTP的用量上,大多数研究结果的范围均在0.15~0.30 mmol/L,并以0.2 mmol/L的用量居多[28,32-33],这与本研究的结果一致。在引物的用量上,各研究结果不一,但大多数体系的用量范围在 0.2~0.5 μ mol/L[29-30,32-34]。本研究最终确定的引物浓度(0.4 μ mol/L)在此范围之内。在 Mg2+的用量上,大多数研究报道的用量范围在 1.5~2.5 mmol/L[35],其中大多数体系对于Mg2+的用量最终确定为2.0 mmol/L,这与本研究结果一致。本研究最终利用正交试验设计对红豆草ISSRPCR反应体系进行优化,在扩增结果相差不大的情况下,尽可能选择药品使用量少、条带清晰的泳道,从而确定了最佳反应体系。
对53个引物进行筛选,最终筛选出12个条带清晰、多态性较好的引物。由于影响ISSR分析中的PCR扩增的因素比较复杂,尤其是扩增程序中的退火温度。较低的退火温度允许适当错配,扩大了引物在基因组中配对的随机性,而较高的退火温度虽可提高配对的专一性,却会影响引物与模板的结合程度。因此,随机设置12个退火温度梯度对各个引物进行最佳退火温度的筛选,最终确定各引物的最佳退火温度。
周桂元等[36]通过返回式卫星搭载后的花生(Arachis hypogaea)种子,返回地面经过多年的种植和选择,在试验中获得21个变异株系。用SSR技术检测21个变异株系的基因位点,发现多个基因位点发生了变异,并通过与形态变异的联系,表明太空处理能够诱导花生产生变异。类似的结果在水稻(Oryza sativa)、菜豆(Phaseolus vulgaris)和番茄(Lycopersicon esculentum)航天育种研究上也有报道[37-40]。本研究经过12个引物扩增后,证明了空间环境对植物基因位点的影响,同时说明航天诱变的方法确实可引起植株分子水平上的遗传变异,而非仅仅表面上的暂时性变异。说明航天诱变可作为今后红豆草种质资源创新和品种选育的方法之一。
4 结论
1)红豆草ISSR-PCR最佳反应体系为:2.5 μ L 10×PCR buffer、50 ng 模板 DNA 、dNTP 0.2 mmol/L、Taq DNA 聚合酶 1.5 U、引物 0.4 μ mol/L 、Mg2+2.0 mmol/L,总体积为 25 μ L 。
2)通过琼脂糖凝胶电泳检测分析,共获得193个扩增位点,其中多态性位点142个,多态性比率为73.6%,每个引物的扩增位点为10~23个,平均16.1个,其中多态性位点7~18个,平均11.8个。
3)搭载植株的多态位点比率、Nei基因多样度和Shannon多样性指数均高于地面对照。
[1]喻志军.我国航天育种的进展[J].中学生物教学,2003(5):33-34.
[2]李金国,刘敏,王培生,等.空间条件对番茄诱变作用及遗传的影响[J].航天医学与医学工程,2000,13(2):114-118.
[3]李源祥.航天育种新成果赣早籼47[J].中国种业,2001(3):42.
[4]王慧,张建国,陈志强.航天育种优良水稻品种华航一号[J].中国稻米,2003(6):18.
[5]密士军,郝再彬.航天诱变育种研究的新进展[J].黑龙江农业科学,2002(4):31-33.
[6]杜连莹,韩微波,张月学,等.“实践八号”搭载8个苜蓿品种细胞学效应研究[J].草业科学,2009,26(12):46-49.
[7]李建彬,洪亚辉,周树良,等.棉花种子航天搭载主要经济与农艺性状变异的研究[J].湖南农业科学,2008(1):25-26,31.
[8]刘录祥,郭会君,赵林姝,等.我国作物航天育种 20年的基本成就与展望[J].核农学报,2007,21(6):589-592.
[9]刘录祥,赵林姝,郭会君.作物航天育种研究现状与展望[J].中国农业科技导报,2007,9(2):26-29.
[10]翟桂玉.高产优质豆科牧草红豆草[EB/OL].(2007-07-04)[2010-03-15].http://lagri-jzst.cn/ReadNews.asp(NewsID=17711).
[11]Zietkiewicz E,Rafslski A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[12]Mcroberts N,Sinclair W,Mcpherson A,et al.An assessment of genetic diversity within and between populations ofPhalarisminorusing ISSR markers[J].Weed Research,2005,45(6):431-439.
[13]肖海峻,徐柱.鹅观草种质资源遗传多样性研究[M].北京:中国农业科学院,2007:5-6.
[14]Li M,Guo W L,Hu L J,et al.Genetic variationin natural populations ofHordeumbrevisubulatumnative to the SongnenPrairie in northeasternChina:Comparison of four nuclear DNA markers[J].Canadian Journal of Plant Science,2007,87(4):773-790.
[15]Gyulai G,Dweikat I,Janovszky J,et al.Application of ISSR/SSR-PCR for genome analysis ofAgropyron,Bromus,andAgropyron×Bromus[A].In:Staszewski Z,Mlyraec W,Osinski R.Ecological aspects of breeding fodder crops and amenity grasses[C].Radzikow,Poland:PBAI,1997:306-312.
[16]徐云远,王呜刚,贾敬芬.卫星搭载红豆草后代中耐盐细胞系的筛选及鉴定[J].实验生物学报,2001,34(1):11-15.
[17]谢甫绨,Takahata Y.利用ISSR分子标记进行不同来源大豆品种的分类[J].大豆科学,2005,24(3):161-165.
[18]王玉民,姜昱,康岭生,等.利用ISSR技术探讨大豆属植物的亲缘关系[J].吉林农业科学,2007,32(6):30-32,38.
[19]Jin Y,Zhang W J,Fu D X,et al.Sampling strategy within a wild soybean population based on its genetic variation detected by ISSR markers[J].Journal of Integrative Plant Biology,2003,45(8):995-1002.
[20]谢甫绨,Takahata Y,Yasuo O.利用ISSR标记进行菜用大豆和普通大豆的分类[J].大豆科学,2008,27(5):732-739.
[21]刘美华,李忠超,陈海山.昆仑锦鸡儿(豆科)的遗传多样性研究[J].广西植物,2005,25(1):53-57.
[22]解新明,卢小良.SSR和ISSR标记及其在牧草遗传与育种研究中的应用前景[J].草业科学,2005,22(2):30-37.
[23]Yeh F C,Yang R C,Boyle T,et al.POPGENE,the user friendly shareware for population genetic analysis[M].Edmonton,Canada:Molecular Biology and Biotechnology Center,University of Alberta,1997.
[24]张丽,周兰英,肖千文.正交试验设计在建立杜鹃花RAPD-PCR反应体系中的应用[J].北方园艺,2007(5):124-126.
[25]Planel H,Ganbin Y,Pianezzi B,et al.Space environment factors affecting response to radiation at the cellular level[J].Advances in Space Reserch,1989,9(10):157-160.
[26]罗海燕,陈业渊.ISSR分子标记及其应用[J].安徽农学通报,2008,14(19):45-46,27.
[27]袁昭岚,沈颂东,黄鹤忠,等.SSR和ISSR分子标记技术及其在遗传多态性方面的应用[J].水产养殖,2005,26(2):10-13.
[28]桂腾琴,乔爱民,孙敏,等.果梅ISSR-PCR反应体系的建立和优化[J].西南大学学报(自然科学版),2007,29(10):124-128.
[29]郭凌飞,邹明宏,曾辉,等.澳洲坚果ISSR-PCR反应体系的建立与优化[J].林业科学,2008,44(5):160-164.
[30]罗玥佶,伍贤进,彭帅,等.翻白草总 DNA的提取与ISSR-PCR体系的建立与优化[J].安徽农业科学,2008,36(3):895-897,901.
[31]林新坚,江秀红,蔡海松,等.姬松茸ISSR特异扩增体系的研究[J].食用菌学报,2007,14(4):25-30.
[32]权俊萍,袁菊红,穆红梅,等.百里香属植物 ISSRPCR和SRAP-PCR体系的确立及优化[J].植物资源与环境学报,2008,17(2):1-8.
[33]林郑和,陈荣冰,陈常颂.茶树 ISSR-PCR反应体系优化研究[J].福建农业学报,2006,21(3):247-252.
[34]刘忠辉,刘国道,黄必志,等.云南猪屎豆属遗传多样性的ISSR分析[J].草业学报,2009,18(5):184-191.
[35]张青林,罗正荣.ISSR及其在果树上的应用[J].果树学报,2004,21(1):54-58.
[36]周桂元,洪彦彬,林坤耀,等.花生空间诱变及SSR标记遗传多态性分析[J].中国油料作物学报,2007,29(3):238-241.
[37]周峰,易继财,张群字,等.水稻空间诱变后代的微卫星多态性分析[J].华南农业大学学报,2001,22(4):55-57.
[38]张 健,李金国,王培生,等.菜豆空间突变品系的分子生物学分析[J].航天医学与医学工程,2000,13(6):410-413.
[39]鹿金颖,刘敏,薛淮,等.俄罗斯“和平”号空间站搭载的番茄随机扩增多态性DNA分析[J].航天医学与医学工程,2005,18(1):72-74.
[40]印红,陆伟,谢申猛.搭载后红曲霉菌突变株的染色体DNA随机扩增多态性分析研究[J].航天医学与医学工程,2004,17(5):374-376.
