柱分离法自动化合成18F-FLT
2010-03-24文富华邓怀福唐刚华吴克宁
文富华 邓怀福 唐刚华 易 畅 吴克宁
(中山大学附属第一医院核医学科PET-CT 广州 510080)
3'-脱氧-3'-18F-氟代胸苷(3'-deoxy-3'-18F-fluorothymidine,18F-FLT)是一种PET显像剂,其用胸苷激酶催化的磷酸化作用评价 DNA复制过程,能准确评估肿瘤细胞 DNA合成和细胞增殖活性,在肿瘤早期诊断、鉴别诊断及疗效监测等方面具有重要价值,是目前最有发展前景的PET药物之一,其放射合成成为研究热点。Buck等[1]的研究表明,18F-FLT比18F-FDG能更好反映恶性肿瘤的增殖情况。结合18F-FDG PET显像,可提高肿瘤诊断的准确性。
然而,现有18F-FLT合成方法产率低,合成时间较长(~60 min),产物分离过程繁琐,分离时间长(30 min左右),设备要求制备型HPLC分离仪,所用前体量大,成本较高。鉴此,我们对18F-FLT的合成及分离进行了研究。
1 材料与方法
1.1 仪器和试剂
Cyclone 10/5(比利时IBA公司);PET-MF-2VIT-I型氟-18多功能合成模块(北京派特生物有限公司);1200 Series 高效液相分析色谱仪(HPLC, 美国Agilent公司);流动相放射性检测仪(华盛顿BIOSCAN公司);MiniGita放射性TLC扫描仪(德国Raytest公司)。
前体 3-N-t-叔丁氧羰基-1-[5’-O-(4,4’-二甲氧基三苯甲基) -2’-脱氧-3’-O-(4-硝基苯磺酰基-β-1)-苏戊呋喃糖]胸腺嘧啶和标准品 3’-脱氧-3’-氟代胸苷(19F-FLT, 德国 ABX 公司);4,7, 13,16,21,24-六氧杂-1,10-二氮杂双环[8,8,8]二十六碳烷(Kryptofix2.2.2,K222,德国 ABX 公司);乙腈(英国 ACROS 公司);Sep Pak QMA、Sep Pak C18 小柱、Sep Pak Al2O3小柱和 Sep Pak SCX 小柱(美国 Waters 公司);HCl(美国 Aldrich 公司);碳酸钾(美国 Sigma-Aldrich公司);无水乙醇(天津市福晨化学试剂厂);氢氧化钠(天津市大茂化学试剂厂);注射用水(安徽双鹤药业有限责任公司)。
1.2 合成方法
以 3-N-t-叔丁氧羰基-1-[5’-O-(4,4’-二甲氧基三苯甲基)-2’-脱氧-3’-O-(4-硝基苯磺酰基-β-1)-苏戊呋喃糖]胸腺嘧啶脱氧核苷为前体,溶于1 mL无水乙腈中,在 105℃密闭状态下与干燥18F–进行亲核反应5 min;然后冷却,加入1 mL 1 mol/L HCl,100℃水解反应5 min;冷却,再加入0.5 mL 1 mol/L NaOH 进行中和;最后,反应液过小柱进行分离纯化并过无菌滤膜得到18F-FLT注射液,合成路线见图1。
2 实验内容
2.1 自动化合成前准备
18F-FLT自动化合成在PET-MF-2V-IT-I型氟-18多功能合成模块中完成,由图2,在V0的六通阀处安装活化后的QMA柱,并将QMA柱放入活度计内;在V7与V10间安装Sep Pak SCX 小柱、Sep Pak Al2O3小柱;在V15与V17间安装Sep Pak C18 小柱。在V1中加入1.5 mL K2CO3(30 mg/6 mL水)和K222混合液(130 mg/5 mL乙腈);V2中加入2 mL无水乙腈;V3中加入溶于1 mL无水乙腈的前体15 mg;V4加入1 mol/L HCl 1 mL;V5加入1 mol/L NaOH 1mL;V6加入30 mL 注射用水;V11加入2 mL乙醇。在产品出口接无菌滤膜和产品收集瓶,并放入活度计。
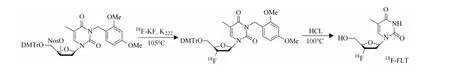
图1 18F-FLT的合成路线Fig.1 Scheme of 18F-FLT synthesis.

图2 18F-FLT自动化合成流程图Fig.2 Schematic diagram of the automated synthesis of 18F-FLT at PET-MF-2V-IT-I system.
2.2 18F-FLT自动化合成步骤
(1)18F–由Cyclone 10/5通过18O(p, n)18F反应生产;(2)18F–被QMA捕获后,用V1中的K2CO3和K222混合液将其洗脱,进入第一个反应管;(3) 反应管中溶液在105℃蒸发干燥6 min;加入V2中的乙腈,105℃蒸发干燥至反应管中无液体残留;(4)加入V3中的前体,105℃下密闭反应6 min;116℃下蒸发乙腈;(5) 冷却反应管;(6) 加入V4中的HCl溶液,在100℃下水解反应5 min;(7) 冷却反应管;(8) 加入V5中的NaOH溶液进行中和反应;(9) 从V6中的水吸取10 mL到第一反应管,稀释反应液。将反应液通过V7与V10间相连的Sep Pak SCX 小柱、Sep Pak Al2O3小柱,进入第二反应管,再从第二反应管转移并通过V15与V17间的Sep Pak C18 小柱,淋洗液进入废液瓶中;(10) 从V6中吸取10 mL水到第一反应管,将反应管中残留的反应液溶入水中,并将洗液通过V15与V17间的Sep Pak C18 小柱,重复此操作一次;(11) 将V11中的乙醇加入第二反应管,经Sep Pak C18 小柱将产品洗脱到瓶中。
2.3 化学纯度和放射化学纯度的测定
用放射性高效液相色谱(HPLC)系统测定18F-FLT注射液的化学纯度和放射化学纯度。HPLC分析条件:乙醇:水=10:90(V/V),流速为1 mL /min,254 nmUV检测。TLC 展开剂:二氯甲烷:甲醇=90:10(V/V)。
用精密pH试纸测定18F-FLT注射液的 pH值,目测溶液的颜色和澄清度;取一定量的18F-FLT注射液,用活度计测定不同时间的活度值,用半对数作图法计算其半衰期和核纯度;按中国药典 2005年版所载无菌检查法(肉汤法)对18F-FLT溶液进行无菌检查,用鲎试剂法进行细菌内毒素检查,并用5只昆明小白鼠尾静脉注射18F-FLT注射液各 0.5 mL进行异常毒性检查。其中无菌检查及内毒素检查由本单位检验科协助完成。
2.4 小鼠肝细胞癌模型制备及PET/CT显像
C57BL/6J小鼠10只,雌性,5周龄,体质量20–25 g。将Hepa1-6肝癌细胞株常规传代培养,收集对数生长期的细胞,用1×PBS溶液配成2×107个/mL的细胞悬液,无菌条件下在小鼠右肋腰部皮下注射0.1 mL瘤细胞悬液。7 d后可扪及皮下结节,待肿瘤长径至15–25 mm时进行实验。由尾静脉注射生理盐水稀释的18F-FLT 15 MBq (0.2 mL),1 h后固定于小鼠架上,行全身PET/CT扫描,经衰减校正后,迭代重建获得横断面、矢状面、冠状面断层图像及MIP(maxmium-intensity projection)图像。
3 结果与讨论
3.1 18F-FLT的合成
自 Grierson等[2]合成无载体18F-FLT以来,放化工作者尝试用多种前体、不同合成路线、不同纯化条件等进行18F-FLT的合成及分离,以提高合成产率。前体可分为两大类:(1) 2,3’-anhydrothymidine类似物,(2) 胸苷母体的3、3'位有保护基的类似物,以第二类中的3-N-Boc类前体的方法研究较多,其合成产率相对较高 (表 1)。本工作选用 3-N-t-叔丁氧羰基-1-[5’-O-(4,4’-二甲氧基三苯甲基)-2’-脱氧-3’-O-(4-硝基苯磺酰基-β-1)-苏戊呋喃糖]胸腺嘧啶作起始原料,合成18F-FLT。Oh等[5]以40 mg N-Boc-前体与18F–在150℃加热100 s,然后在85℃加热反应450 s,再加HCl水解,中和后经HPLC分离得18F-FLT,总合成时间~60 min,放化产率34.5%。考虑到原料价格,我们选用15 mg前体进行合成。
取15 mg前体与18F-在105℃加热反应6 min,再加HCl水解,最后用NaOH中和反应液并过柱纯化产品。该‘一锅法’合成18F-FLT共耗时35 min,产率为 12%–15%。与文献[5]合成方法相比,虽产率稍低,但反应较温和,程序简单且合成时间短;与国内现有技术相比,产率较高;特别是柱分离的方法大大缩短了合成时间。傅喆等[6]用柱分离法进行18F-FLT 合成,但其方法是半自动化合成,操作人员接触照射较多,不能满足日常临床需求。Lee等[7]在质子溶剂中用20 mg前体与18F–在120℃加热反应10 min,再加HCl水解,中和后经HPLC分离得18F-FLT,总合成时间~70.5 min,放化产率51.0%,是目前产率最高的合成方法,但我们按其方法进行合成,并未得到18F-FLT。

表1 3-N-Boc类前体法合成18F-FLTTable 1 The method of synthesis 18F-FLT with 3-N-Boc analogues as precursor.
3.2 产品的纯化
我们用两种方法进行产品分离(表2),两种方法相比,显然第二种方法更加合理、优化,不但 pH值较适宜,而且放射性纯度高,产率也较高,可以满足临床的需要。
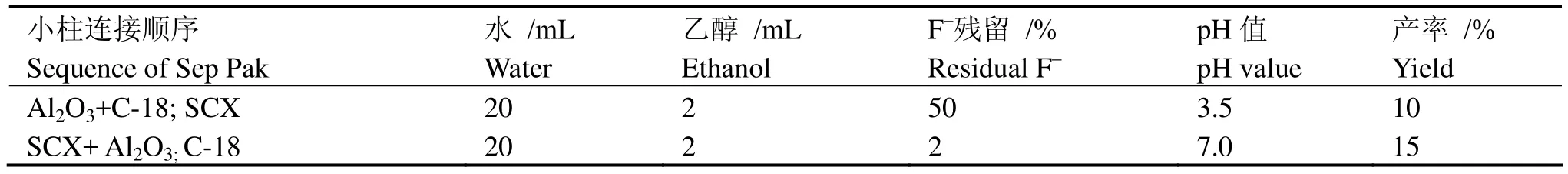
表2 小柱连接顺序对18F-FLT的影响Table 2 The effect of Sep Pak cartridges sequence on 18F-FLT.
该合成方法主要优点如下:(1) 使用 Sep Pak小柱分离纯化代替HPLC分离,不仅简化了分离纯化过程,更便于实现18F-FLT自动化合成,而且大大缩短了总合成时间,比传统合成工艺节省了15–25 min,这对于半衰期为109.8 min的18F–意义重大。(2) 使用较少化学量的前体,节约了成本。
柱分离后的产品经无菌滤膜进入无菌真空瓶,即得18F-FLT注射液,pH值~7.0,无色透明、稳定的液体,用时间衰变法测定18F半衰期~110 min,放射性核素纯度>99%,HPLC测定其放射化学纯度>95% (图3),254 nm紫外吸收只检测到溶剂峰和FLT标准品峰,TLC扫描Rf~0.66(图4),细菌内毒素检查、无菌检查均符合国家药典规定,异常毒性试验中无小白鼠死亡发生。

图3 18F-FLT 柱分离后的HPLC放射性及紫外图谱Fig.3 HPLC chromatogram of Sep-Pak purified 18F-FLT.
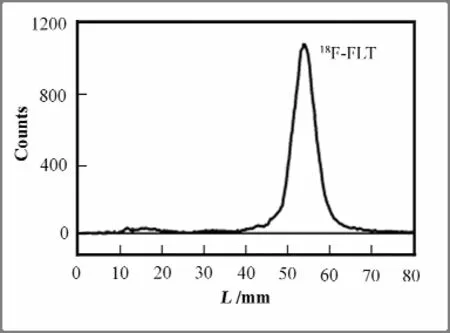
图4 18F-FLT的TLC层析图Fig.4 TLC chromatogram of 18F-FLT.
3.3 荷肝细胞小鼠18F-FLT显像结果
注射18F-FLT后1 h荷肝细胞癌小鼠PET/CT显像结果如图 5,可见小鼠肝细胞癌肿瘤明显放射性摄取,高于周围正常组织。全身显像图可见双肾及肝脏显影,膀胱内可见放射性滞留,脑组织摄取较低。
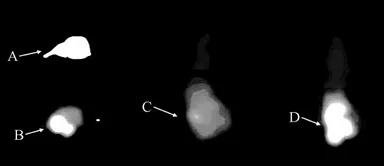
图5 荷肝细胞癌小鼠18F-FLT PET/CT显像图A.横断面CT图像 B.横断面PET图像C.冠状面PET图像 D.MIP图像Fig.5 18F-FDG PET/CT imaging of mice models bearing hepatocellular carcinoma.A.Axial CT imaging B.Axial PET imaging C.Coronal PET imaging D.MIP PET imaging.
4 结论
以 3-N-t-叔丁氧羰基-1-[5’-O-(4,4’-二甲氧基三苯甲基)-2’-脱氧-3’-O-(4-硝基苯磺酰基-β-1)-苏戊呋喃糖]胸腺嘧啶为前体,使用自动化合成装置PET-MF-2V-IT-I型氟-18多功能合成模块,经氟化、水解两步反应“一锅法”制备了 3’-脱氧-3’-氟代胸苷(18F-FLT),并经柱分离制得18F-FLT注射液,共耗时35 min。放化产率12%–15%,放化纯度>95%,该法生产的18F-FLT更便于其在临床中推广应用。
1 Buck A K, Schirrmeister H, Hetzel M, et al.Cancer Research, 2002, 62(12): 3331–3334
2 Grierson J R, Shields A F, Eary J F.J Labelled Compd Radiopharm, 1997,40: 60–62
3 Martin S J, Eisenbarth J A, Wagner-Utermann U, et al.Nucl Med Biol, 2002, 29: 263–273
4 Yun M, Oh S J, Ha H J, et al.Nucl Med Biol, 2003,30:151–157
5 Oh S J, Mosdzianowski C, Chi D Y, et al.Nucl Med Biol,2004, 31: 803–809
6 傅 喆, 腾 宝, 吴战宏, 等.同位素, 2005, 18(4):233–236 FU Zhe, TENG Bao, WU Zhanhong, et al.J Isotopes,2005, 18(4): 233–236
7 Lee S J, Oh S J, Chi D Y, et al.Eur J Nucl Med Mol Imaging, 2007, 34: 1406–1409
8 Suehiro M, Vallabhajosula S, Goldsmith S J, et al.Appl Radia Isotopes, 2007, 65:1350–1358
9 辛 军, 李宏利, 郭启勇, 等.中国临床医学影像杂志,2007, 18(5): 348–350 XIN Jun, LI Hongli, GUO Qiyong, et al.J Chin Med Imaging, 2007, 18(5): 348–350
10 陆春雄, 王正武, 蒋泉福, 等.核化学与放射化学,2009, 31(1): 52–56 LU Chunxiong, WANG Zhengwu, JIANG Quanfu, et al.J Nucl Radiochem, 2009, 31(1): 52–56
11 范文博, 彭添兴, 颜和平.应用化工, 2008, 37(1):80–82 FAN Wenbo, PENG Tianxing, YAN Heping.Appl Chem Industry, 2008, 37(1): 80–82
12 唐刚华, 唐小兰, 王明芳, 等.核技术, 2009,32(2):154–160 TANG Ganghua, TANG Xiaolan, WANG Mingfang, et al.Nucl Tech, 2009, 32(2): 154–160
13 柴黎明, 吴 君, 梁秀艳, 等.中国临床医学影像杂志,2009, 20(1):46–50 CHAI Liming, WU Jun, LIANG Xiuyan, et al.J Chin Med Imaging, 2009, 20(1):46–50
