报告基因系统HSV1-sr39tk/FIAU监测治疗基因表达的体外研究
2010-03-24张国鹏兰晓莉陈铨曹卫何勇张永学
张国鹏 兰晓莉 陈铨 曹卫 何勇 张永学
(华中科技大学同济医学院附属协和医院核医学科,湖北省分子影像重点实验室 武汉 430022)
基因治疗缺血性疾病已进入临床I-II期试验,并取得一定效果。但是,对于这种治疗方式,缺乏理想的监测手段。核素报告基因显像技术为在活体水平监测基因在体内的表达位置、表达数量和持续时间等提供有效手段。
本文应用以酶/底物的核素报告基因/报告探针系统 HSV1-sr39tk/131I-FIAU,监测治疗基因表达情况。系统中酶底物FIAU经核素131I标记后,可穿透细胞膜进入细胞内。细胞经过转导 HSV1-sr39tk基因后成功表达酶蛋白,可将核素标记酶底物磷酸化,磷酸化后的产物不能再次穿过细胞膜而内陷在被感染细胞中,导致局部放射性浓聚。本研究中,构建包含报告基因 HSV1-sr39tk (mutant herpes simplex virus type 1 thymidine kinase)与治疗基因VEGF165(human vascular endothelial growth factor 165)的重组腺病毒载体 Ad5-sr39tk-IRES-VEGF165(Ad5-SIV),将其感染至MSCs后,MSCs摄取报告探针131I-FIAU的情况可间接反映HSV1-sr39tk报告基因的表达情况,将细胞摄取实验结果与ELISA检测所得VEGF165蛋白分泌情况作对比分析,观察感染病毒后 MSCs对报告探针131I-FIAU摄取与VEGF165基因表达的相关性,探索 HSV1-sr39tk报告基因监测治疗基因表达情况的可行性,为在体报告基因显像监测基因治疗提供理论基础。
1 材料与方法
1.1 材料
1-(2-deoxy-2-fluoro-β-D-arabinofuranosyl)-5-(tri methylstannyl)-2,4-(1H,3H)-Pyrimidinedione (FTAU)购自德国ABX公司;无载体Na131I 液体成品由北京原子能高科股份有限公司提供;Sep-Pak C-18反相色谱层析柱购自美国 Waters公司;DMEM-F12干粉培养基、胎牛血清购自美国Gibco公司;人淋巴细胞Ficoil分离剂购自中国天津市灏洋生物制品科技有限责任公司。Opti-MEM 无血清培养基及Trizol试剂购自美国Invitrogen公司;ITLC-SG层析纸购自美国Gelman Science公司;鼠抗人VEGF165单克隆抗体及兔抗人 TK 单克隆抗体购自美国Abcom公司;兔抗CD34、CD44多克隆抗体,SABC试剂盒均购自武汉博士德生物工程有限公司。正常SD大鼠(SPF级,雄性,150–200 g)由华中科技大学同济医学院实验动物中心提供。
1.2 方法
1.2.1 Ad5-SIV的构建
利用限制性内切酶BglII单酶切PDC316-BMP7-IRES-VEGF165-IRES-EGFP质粒,回收片段,利用BglII单酶切PDC316-sr39tk,回收线性化片段。将PDC316-sr39tk质粒片段和IRES-hVEGF165目的片段通过T4 DNA连接酶作用连接起来,构建成重组质粒PDC316-sr39tk-IRES-VEGF165。经酶切、PCR及测序鉴定其构建正确与否。重组质粒经鉴定后与骨架质粒pBHGlox_E1共感染HEK-293细胞,同源重组生成重组腺病毒Ad5-sr39tk-IRES- VEGF165(Ad5-SIV)。Ad5-SIV经包装鉴定及纯化后测定其滴度。构建以腺病毒包装的Ad5- EGFP为对照组。
1.2.2 MSCs培养
SD大鼠麻醉后处死,75%酒精中浸泡20 min,无菌条件下剪开股骨及胫骨干骺端,用无血清DMEM/F12培养基反复冲洗骨髓腔,将骨髓冲洗液加至装有密度为1.077的Ficoll分离剂的离心管中,使液面分界清楚,细胞悬液和离心液的体积比为1:1–1:2,采用密度梯度离心法,收集单核细胞层,含15%GIBCO胎牛血清的DMEM/F12培养基重悬,吹打均匀后将细胞以3×105/mL密度接种于25 cm2玻璃培养瓶中,37℃、5%CO2饱和湿度培养箱中培养。3–4 d后首次换液,之后每3天换液1次。细胞培养达70%–80%融合时传代培养。收集第四代细胞用CD34、CD44抗体免疫组织化学染色鉴定细胞。
1.2.3 Ad5-SIV感染MSCs
取2–4代MSCs细胞2×105/孔接种于24孔板,细胞融合度达70%–80%后,取3孔细胞计数,其余孔弃掉培养基,PBS洗涤细胞2遍,每孔加入无血清培养基Opti-MEM 150 μL(盖满细胞表面即可),将特定感染复数(multiplicity of infection, MOI)的Ad5-SIV及Ad5-EGFP加入培养孔,混匀,每15 min摇动一次,37℃感染2 h,补足完全培养基至需求量,继续培养48 h。
1.2.4 免疫激光共聚焦监测 HSV1-sr39tk蛋白与VEGF165蛋白表达
取用第4代MSCs制备细胞爬片,感染Ad5-SIV后48 h,感染滴度为MOI=100。PBS (0.01 mol/L,pH 7.2) 冲洗两遍,4%多聚甲醛固定30 min,0.5%Triton X-100破膜10 min,5%BSA封闭1.5 h,抗体稀释液稀释的鼠抗人 VEGF165单克隆抗体工作液(1:100)与兔抗人 TK蛋白单克隆抗体工作液(1:100)制成混合液,将混合液滴加到细胞爬片上,4℃孵育过夜,随后加入 1:100二抗混合液(FITC标记的羊抗兔IgG 与CY3标记的羊抗兔IgG),37℃孵育1 h,Hoechst33342复染细胞核,漂洗、封片。以未感染病毒细胞为对照,在激光共聚焦扫描显微镜下观察两种蛋白表达情况。
1.2.5 细胞感染 Ad5-SIV后 ELISA检测VEGF165蛋白分泌
Ad5-SIV以感染复数(MOI=0、10、25、50、75、100 IU/per cell)感染MSCs,培养48 h,收集细胞培养上清,离心去除细胞碎片,按照ELISA试剂盒说明书进行实验,最后在450 nm条件下用酶标仪测量每孔计数,用CurveExpert 1.3软件计算培养上清VEGF165蛋白含量。
1.2.6131I-FIAU的制备与纯化
FTAU为合成FIAU的前体,经131I标记后,形成131I-FIAU。标记过程如下[1]:FTAU溶于甲醇制成5 mg/mL溶液,将其分装为每EP管50 μL。将40 μL 0.1 mol/L HCL 加入 100 μL131I-NaI(185 MBq)溶液,与50 μL FTAU甲醇溶液振荡混匀~20 s,加入30%H2O2/CH3CO2H(1:3)约20 μL至EP管,振荡混匀30 s,室温静置约3 min,再加入100 μL偏重亚硫酸钠(Na2S2O5)饱和溶液终止反应。标记产物用Sep-Pak C-18反向色谱层析柱分离纯化,洗脱液为甲醇。将131I-FIAU峰管点样于ITLC-SG层析纸,以V(乙酸乙酯):V(丙酮):V(水)=12:8:1混合液为展开剂层析测量其放化纯。标记物于室温放置 6、12、24 h,观察其体外稳定性。
1.2.7 细胞摄取实验
(1) 时间相关摄取实验:实验组为Ad5-SIV感染细胞组(MOI=50),对照组为Ad5-EGFP感染细胞组(MOI=50)。病毒感染 MSCs后48 h进行摄取131I-FIAU实验,每孔细胞用PBS洗涤2次,加入300 μL 新鲜培养基。随之每孔加入131I-FIAU 370 kBq,37℃分别孵育 30、60、90、120、150、180、240 min后取样(每时间点取3个平行孔)。取样时吸去每孔中放射性培养基,用 PBS洗涤 2次,以 1 mol/L NaOH溶液400 μL裂解贴壁细胞,收集各孔放射性培养基及细胞裂解产物至测量管,用γ计数仪测量各管的放射性,计算细胞摄取率Uptake% =细胞悬液计数/(细胞悬液计数+培养液计数)×100%。(2) 病毒MOI相关摄取实验:用Ad5-SIV和Ad5-EGFP按照 MOI=0、10、25、50、75、100分别感染细胞,48 h后每孔加入370 kBq131I-FIAU,37℃培养3 h进行细胞摄取实验,其余步骤同上。
1.3 统计学分析
2 结果
2.1 Ad5-SIV的构建
不同组合酶切鉴定分析证实pDC316-sr39tk-IRES-VEGF165重组质粒构建正确,所得腺病毒产物纯化后滴度达7.9×109U/mL(TCID50法,半数组织培养感染剂量),对照组病毒 Ad5-EGFP滴度为1.4×1010U/mL。
2.2 MSCs 培养及鉴定
细胞接种24 h后开始贴壁,细胞呈圆形,3–4天后形态向短梭形或短棒状转变。一周左右细胞呈梭形,放射状或同心圆状排列,两周左右长满瓶底。细胞传代后形态呈梭形,较为均一。取第4代MSCs免疫组织化学结果显示:MSCs CD34抗体染色阴性,而CD44抗体染色阳性(图1)。

图1 MSCs (P4)免疫组织化学方法鉴定结果(a) 光镜下观察第4代细胞,可见细胞呈梭形,放射状排列,(b) PBS代替一抗作为阴性对照,(c) CD34抗体染色细胞内未见明显棕褐色颗粒,(d) CD44抗体染色大部分细胞内可见棕褐色颗粒Fig.1 Immunocytochemical staining of the4th passage MSCs.(a) The normal cells in fibroblast-like appearance were uniformly distributed, (b) The negative control, (c) Surface antigens expressed in cells were negative for CD34, (d) Surface antigens expressed in cells were positive for CD44.
2.3 病毒感染后共聚焦显微镜监测免疫荧光结果
Ad5-SIV以MOI=100滴度感染MSCs后,通过免疫荧光共聚焦显微镜检测 VEGF165蛋白及HSV1-sr39tk蛋白在MSCs中的表达。如图2,激光共聚焦显微镜下可见感染Ad5-SIV组MSCs胞浆中有 VEGF165(红色荧光)及 HSV1-sr39tk蛋白表达(绿色荧光),而未感染病毒组胞浆则未观察到红色及绿色荧光,仅有蓝色HOCHEST核染色。由此证明,Ad5-SIV可在MSCs细胞中成功感染且可正常表达VEGF165及HSV1-sr39tk蛋白。
2.4 VEGF蛋白分泌与HSV1-sr39tk蛋白酶活性间相关性分析
ELISA结果证实VEGF165蛋白分泌随病毒滴度增加,二者呈线性正相关(图3,P<0.05),也即Ad5-SIV感染MSCs后VEGF165蛋白可正常表达及分泌。
2.5 131I-FIAU的制备
标记产物经纯化后可见两个放射性计数峰,第2峰为131I-FIAU,标记率为(86.19±2.2)%,经ITLC-SG层析测定放化纯为(94.16±2.93)%,标记物放置6、12、24 h后,放化纯均≥90%,说明标记物体外稳定。

图2 免疫荧光激光共聚焦检测结果, 上层为Ad5-SIV感染细胞组,下层为未感染病毒细胞组结果Fig.2 Results of immunofluorescence.The upper and lower layers are Ad5-SIV-infected and non infected cells, respectively.
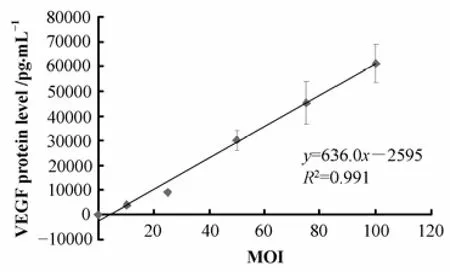
图3 VEGF165蛋白分泌与病毒MOI间相关性分析Fig.3 Relationship of VEGF165 secretion and MOI.
2.6 细胞感染Ad5-SIV后不同滴度及不同时间摄取131I-FIAU的实验研究
时间相关摄取实验结果(图4a)显示,随时间延长,感染Ad5-SIV组细胞摄取率逐步升高,150 min后细胞摄取率升高缓慢,150 min摄取率为(20.06±1.33)%,实验组与对照组摄取率在各个时间点差异显著(t=18.43–54.83, P<0.05)。
病毒MOI相关摄取实验结果显示,细胞摄取率随MOI增加(图4b),二者间呈线性正相关(图4c,P<0.05),除 MOI为 0组外,感染 Ad5-SIV与Ad5-EGFP两组的摄取率之间差异具有统计学意义(t=10.91–16.83,P<0.05)。

图4 细胞摄取实验结果(a) 时间相关摄取实验结果,(b) 感染复数相关摄取结果,(c)摄取率与感染复数相关性分析Fig.4 Results of the cellular uptake of 131I-FIAU.(a) Cellular uptake of 131I-FIAU vs time, (b) Cellular uptake of 131I-FIAU vs MOI,(c) Relationship between the 131I-FIAU uptake rate and MOI
2.7 VEGF165蛋白分泌与HSV1-sr39tk酶蛋白活性相关性分析
摄取结果反映HSV1-sr39tk酶的功能活性,ELISA结果反映VEGF165蛋白的表达及分泌情况,不同 MOI病毒感染后,ELISA结果与摄取结果作相关性分析,可间接反映VEGF165蛋白及HSV1-sr39tk酶活性间关系(图5),可见二者间呈线性正相关(P<0.05)。
3 讨论
因VEGF强大的促进血管新生作用,基因治疗在缺血性疾病治疗临床I、II期试验中已获得良好效果[2,3],但是,试验中发现经VEGF作用产生的血管通透性增加,导致血管源性水肿及血管瘤产生[4]。这些均由于缺乏对治疗基因表达程度、持续时间、表达位置等有效监测。

图5 VEGF165蛋白分泌与HSV1-sr39tk酶蛋白活性相关分析结果Fig.5 Relationship of VEGF165 secretion and HSV1-sr39tk activity.
分子影像是一种有效的监测手段[5],在分子影像中,与直接分子影像需合成针对性显像探针相比,报告基因显像由于其并不改变所研究系统的生物学过程,报告探针无需重新合成而有利于广泛推广[6]。放射性核素报告基因显像灵敏度高、可重复性好、无创性及可定量分析,是最合适的显像技术[7]。目前核素报告基因主要包括:酶-底物系统、受体-配体系统、转运体-底物系统等[8–10]。
酶/底物报告基因显像系统中,I型单纯疱疹病毒胸腺激酶基因(HSV1-tk)是目前应用最广的报告基因[11],本研究采用突变单纯疱疹病毒 tk基因(HSV1-sr39tk),该基因编码的酶与野生型 HSV1-tk编码的酶相比,对底物的磷酸化作用更强[12]。
内部核糖体切入位点(Internal Ribosomal Entry Site, IRES)是一种不依赖5 端帽的结构,其优势在于所连接的双基因可在同一启动子驱动下于同一条mRNA上翻译,其上下游两种基因可独立表达,表达水平可保持恒定比例。研究中,利用该技术将报告基因HSV1-sr39tk与治疗基因VEGF165连接起来,构建成功Ad5-sr39tk-IRES-VEGF165。
免疫激光共聚焦显微镜下可观察到病毒感染后,报告基因HSV1-sr39tk及治疗基因VEGF165均可在MSCs中成功表达。滴度相关摄取实验结果显示,摄取率与病毒滴度呈正相关关系,表明HSV1-sr39tk酶活性与病毒滴度间表达具有很好的相关性。ELISA结果显示,不同 MOI感染 MSCs后 VEGF165蛋白的分泌呈逐步增高趋势,VEGF165蛋白分泌量与病毒感染复数间亦具有较好的相关性。这些结果表明,Ad5-SIV感染后,HSV1-sr39tk及VEGF165蛋白均可独立表达,表达程度均与病毒的感染复数呈正相关关系。
将不同感染复数摄取结果与 ELISA结果作相关性分析,二者之间具有较好的相关性,由此说明病毒感染后HSV1-sr39tk酶活性与VEGF165蛋白分泌间具有较好相关性。可以推论,通过HSV1-sr39tk基因的表达可间接反映 VEGF165蛋白的表达,HSV1-sr39tk/FIAU报告基因系统可被用来监测治疗基因。
本研究阐明了 IRES连接的报告基因及治疗基因间表达具有较好的相关性,但是 IRES载体下游基因的表达较上游基因表达减弱,可在实际基因治疗中,根据基因治疗效果要求与报告显像的灵敏度要求来选择两者的位置或通过构建“super-IRES”来增加下游基因的表达[13]。
本研究中使用了腺病毒载体,尽管腺病毒载体制备简易、感染效率高、携带 DNA容量较大[11],但是其并不能整合入宿主染色体中,不能稳定长期表达,因而不利于报告基因显像长期监测治疗效果。我们采用MSCs细胞,由于其具有多向分化功能,也可以用作治疗。故本实验应用报告基因显像监测治疗基因的同时也可对感染细胞的情况作实时监测,为细胞/基因联合治疗的监测提供了体外研究依据[14]。
本研究成功构建了重组腺病毒系统Ad5-SIV,通过体外研究证实感染 Ad5-SIV的 MSCs细胞对131I-FIAU摄取与 VEGF165表达呈正相关。说明HSV1-sr39tk/FIAU报告基因系统可被用来监测治疗基因VEGF165表达,为进一步的活体核素报告基因显像提供了理论支持。
致谢 本课题中病毒构建及鉴定由北京北元正阳基因技术股份有限公司合作完成,在此表示感谢。
1 Vaidyanathan G, Zalutsky M R.Nucl Med Biol, 1998,25(5):487–496
2 Wu J C, Bengel F M, Gambhir S S.Radiology, 2007,244(2): 337–355
3 Kilarski W W, Samolov B, Petersson L, et al.Nat Med,2009, 15(6): 657–664
4 Peters S, Cree I A, Alexander R, et al.Cytokine, 2007,40(2): 144–150
5 Tran T D, Caruthers S D, Hughes M, et al.Int J Nanomedicine, 2007, 2(4): 515–526
6 Wu J C, Bengel F M, Gambhir S S.Radiology, 2007,244(2): 337–355
7 Acton P D, Zhou R.Q J Nucl Med Mol Imaging, 2005,49(4): 349–360
8 Chin F T, Namavari M, Levi J, et al.Mol Imaging Biol,2008, 10(2): 82–91
9 Aung W, Okauchi T, Sato M, et al.Nucl Med Commun,2005, 26(3): 259–268
10 Shin J H, Chung J K, Kang J H, et al.Eur J Nucl Med Mol Imaging, 2004, 31(3):425–432
11 Lan X, Yin X, Wang R, et al.Nucl Med Biol, 2009, 36:207–213
12 Gambhir S S, Bauer E, Black M E, et al.A mutant herpes simplex virus type 1 thymidine kinase reporter gene shows improved sensitivity for imaging reporter gene expression with positron emission tomography, Proc Natl Acad Sci.USA, 2000, 97: 2785–2790
13 Chen I Y, Wu J C, Min J J, et al.Circulation, 2004,109(11): 1415–1420
14 Willmann J K, Paulmurugan R, Rodriguez-Porcel M, et al.Radiology, 2009, 252(1): 117–127
