基于天然蚕丝及蜘蛛丝蛋白的生物材料研究进展*
2010-03-22赵晓张袁松曾峥吴大洋
赵晓 张袁松 曾峥 吴大洋
(西南大学纺织服装学院,重庆 400716)
丝蛋白(silk protein)是由自然界中的节肢动物,如蚕、蜘蛛、蝎子等分泌的一种蛋白质聚合物。丝蛋白通常是在上皮细胞进行生物合成而得到的,所得到的丝蛋白可存储于分泌腺的腔体中,进而通过吐丝管或其它导管纺制成纤维,最终得到蚕丝、蜘蛛丝等天然的具有特殊功能的材料[1]。无论是研究及应用五千多年的蚕丝还是近十年来成为材料科学领域研究热点的蜘蛛丝,均具有较高的弹性、拉伸强度等力学性能及生物适应性能,尤其是机械性能甚至优于以高强力著称的芳纶及尼龙等化学纤维,其中蚕丝、蜘蛛丝与其他材料的力学性能比较见表1。由于丝纤维突出的机械性能及生物相容性能,该材料目前已被广泛应用于药物可控释放、生物材料及组织工程框架材料。
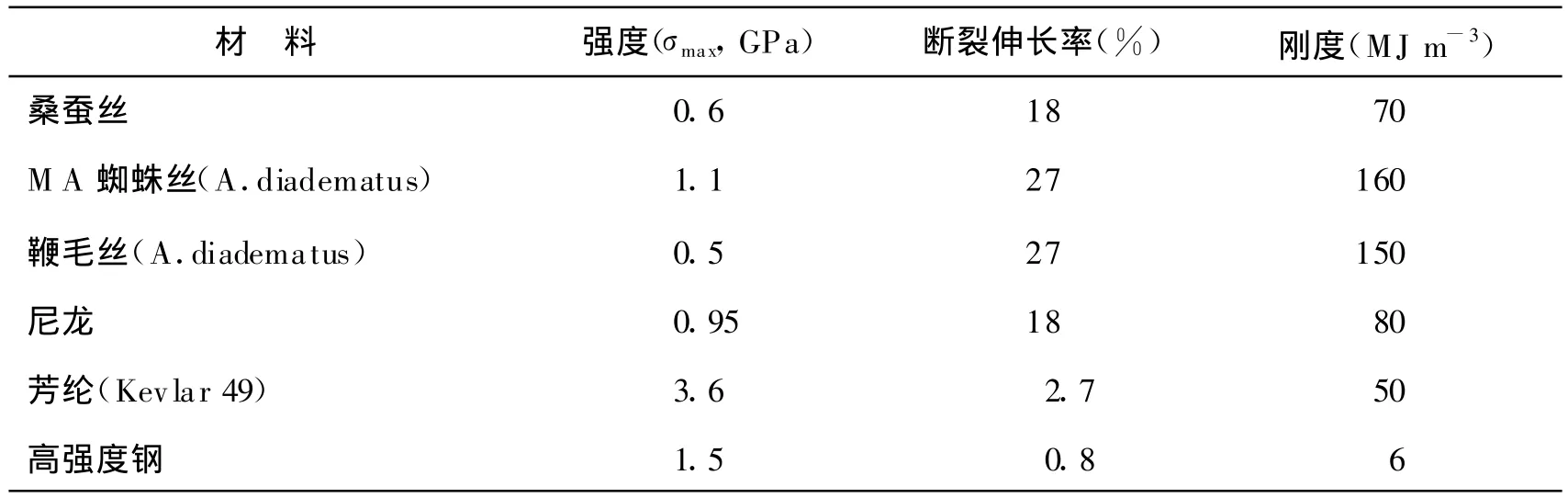
表1 丝纤维及人造纤维的力学性能[2]
之所以基于丝蛋白的天然丝纤维材料具有优良的力学及生物适应性能,是由其分子结构及成纤过程所决定的。如蚕丝和蜘蛛丝的化学组成均为蛋白质,相似的结晶区和非结晶区交替排列的结构使其均具有较高的拉伸强度及良好的弹性[3]。除了蚕丝、蜘蛛丝等天然丝纤维的研究外,近年来,基于丝蛋白的其它生物材料也日渐成为材料科学领域的研究热点。本文从蚕丝及蜘蛛丝结构与性能研究入手,对近年来基于丝蛋白的生物材料的最新研究进展做一全面的概述,以期揭示材料结构及性能的相关规律。
1 基于丝蛋白的天然生物材料
1.1 蚕丝
在所有能生产丝纤维的节肢动物中,桑蚕丝最具经济价值,其应用历史也可以追溯到几千年前,而其最初用于生物材料,主要是用作医用缝合线,随着医学技术及材料开发技术的逐渐进步,桑蚕丝也已被广泛应用于许多临床领域[4]。由于家蚕可大规模饲养,长期以来,其分子结构的研究也已较完善。桑蚕丝具有如图1所示的核壳结构,核层的主要成分为丝心蛋白(fibroin),丝心蛋白主要由3种蛋白质成分组成,分别为350kd的H-链蛋白、25kd的L链蛋白及30kd的P25蛋白,其中H-链蛋白∶L链蛋白∶P25蛋白的摩尔比为6∶6∶1。H-链蛋白为疏水性蛋白质,主要为丝纤维提供类结晶结构,决定丝线强度;L链蛋白为亲水性蛋白,弹性相对较强。在丝纤维形成之前,三种蛋白质的溶液分别由家蚕的两个腺体分泌出来,然后由头部吐丝口喷出,最终所得到的核层丝心蛋白结构为各向异性的以β-折叠为主的纳米晶体,并沿纤维轴向排列。丝心蛋白外层由一系列丝胶蛋白组成,以保证丝纤维之间能粘连成为蚕茧。另外如图1所示,蚕丝的壳层主要由其它蛋白质组成,保护蚕茧,使其免受微生物及捕食蚕茧的其它生物侵袭。
如上所述,丝心蛋白的构成既含有以β-折叠为主的结晶区,又有亲水性蛋白构成的无定形区,这种交替排列的结构使得蚕丝既具有较高的拉伸强度,又具有优良的弹性,因此蚕丝可被广泛应用于生物材料领域,下文将着重论及蚕丝纤维在近年来合成生物材料中的广泛应用。
1.2 蜘蛛丝
蜘蛛丝,尤其是由大囊状腺分泌的蜘蛛拖丝具有非常高的拉伸强度及较好的弹性,与蚕丝类似,蜘蛛丝也具有核壳结构[4,5](图2)。其中,核层主要为两种蛋白质(MA spidroin,主要为来自于络新妇属蜘蛛(N.clavipes)的MaSp1和MaSp2以及来自于十字园蛛(A.diadematus)的ADF-3H和ADF-4),紧邻核层的分别为小囊状腺蛋白质层(MI-like spidiroin)、糖蛋白层及最外层的类脂壳层。由于蜘蛛天性的限制,无法大规模饲养,使蜘蛛丝的相关研究及应用滞后于蚕丝,其突出的机械性能近年来得到材料学与分子生物学领域研究者们的关注,然而由于蜘蛛丝产量并不高(一个完整的蜘蛛网只能纺制出12m蜘蛛丝,而一颗蚕茧能纺制出600~900m蚕丝),目前对于蜘蛛丝的研究着重于通过基因工程技术来增加蜘蛛丝的产量。
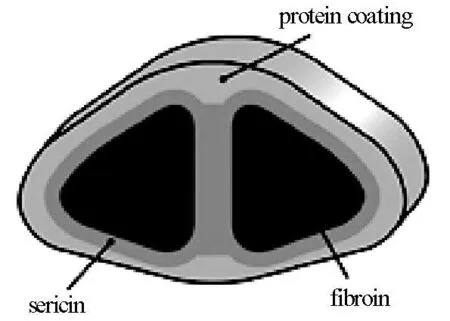
图1 桑蚕丝的核壳结构[4]
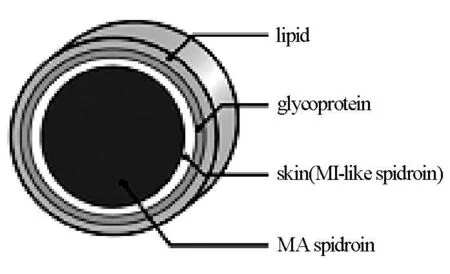
图2 蜘蛛丝的结构[4]
蜘蛛丝的形成过程如图3所示,氨基酸重复单元序列组成的蜘蛛丝蛋白在氢键、疏水作用等弱化学作用力的驱动下自聚集成β-折叠结构的结晶体(β-sheet crystals);随之β-折叠结构进一步自聚集形成胶束(micelles),其中亲水端朝向边缘;随着蛋白质的浓度增加,胶束转变为凝胶状的液晶态(Liquid crystals);最后,所形成的亚稳态的液晶结构蛋白质通过喷丝口,在应力作用下进一步牵伸排列形成更稳定的β-折叠结构,从而使所形成的蜘蛛丝具有超强的拉伸强度。
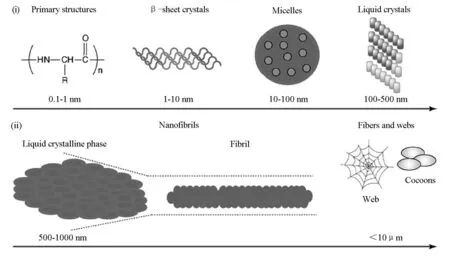
图3 蜘蛛丝的形成过程[6]
从目前对于蜘蛛丝的研究现状来看,开发多样化性能,用来设计及加工新型生物材料是蜘蛛丝最具前景及吸引力的应用之一,如已有相关研究单位将蜘蛛丝用于医疗器械及组织工程领域[7]。具体的应用方式可采用和蚕丝在生物医学领域应用的相似的方法,比如,将蜘蛛丝用于干细胞及韧带细胞的再造。最近也有相关报道,以大囊状腺拖丝为原料,人工搜集蜘蛛丝,将其接种于人类的神经鞘细胞并进行生物相容性表达,这在未来将是治疗神经末梢损伤的一种有效的途径[8]。除了天然的蜘蛛丝蛋白可直接应用在生物医学领域之外,借助表面功能化的方法还可赋予蜘蛛丝更多样化的功能,如在蛛丝蛋白的氨基酸基团表面接枝羧酸等功能基团,从而可以进一步改善蛋白质与细胞之间的相互作用,进一步拓宽了蜘蛛丝在生物材料领域的应用范围。
2 基于丝蛋白的合成生物材料
丝蛋白在水、有机溶剂及离子液体中具有一定溶解度,因此,除了上文所述的蚕丝、蜘蛛丝等天然丝蛋白可用作生物材料之外,还可用人工的方法,将丝蛋白在体外进行合成,并赋予其特殊的性能,制作成新型的生物材料,包括纳米纤维、薄膜、水凝胶、多孔海绵、微球及微胶囊等(见图4),最终可应用于药物可控释放、组织工程框架等材料[4,6]。
2.1 不同形貌及结构的基于丝蛋白的人工合成生物材料
在人工合成丝蛋白的过程中,需先将天然丝蛋白溶解,再通过环境因素的控制,获取具有不同形貌的材料。研究发现,对材料最终结构及形貌影响显著的环境因素包括溶剂类型、pH值、蛋白质浓度、离子浓度及温度等,这些环境因素的改变,直接影响丝蛋白β-折叠结晶结构的分布及最终所形成材料的形貌与性能,下文将针对目前研究较多的几种不同形貌的基于丝蛋白的人工合成材料进行综合概述。

图4 基于丝蛋白的合成生物材料
2.1.1 纤维
从仿生学的角度来看,将天然丝蛋白加工制作成纤维状材料可模仿蚕丝及蜘蛛丝的成纤过程,即蛋白质溶液经过喷丝口再牵引拉伸成型的过程。事实上,目前所采用的方法也确实是模仿蚕及蜘蛛吐丝的方法,通过湿法纺丝、手工牵引、静电纺丝或借助微流控制器的方法等[4],将天然丝蛋白纺制成纤维。
以蚕丝蛋白为例,在加工蚕丝蛋白纤维时,先将丝蛋白溶于溴化锂(LiBr)或N-甲基吗啉氧化物(NMMO)水溶液中,然后轻度拉伸处理30min,水洗、空气烘干制得纤维[9-10]。使用该方法制得的蚕丝纤维机械性能较差,与天然蚕丝纤维相比质地较脆。近年来,采用静电纺丝的方法制作的蜘蛛丝纤维被认为是一种有应用前景的加工方法。将通过基因工程技术表达的蜘蛛丝蛋白(MaSpⅠ蛋白)置于含有Tris缓冲液及盐的尿素中制得纺丝原液,然后通过静电纺丝法制得蜘蛛丝纤维,所得到的成品直径约在10~60μ m,分子取向及机械性能与天然的蜘蛛丝相当[11]。
2.1.2 薄膜
将合成的蜘蛛拖丝蛋白ADF-3及ADF-4溶于六氟异丙醇(HFIP)溶液中,则可得到厚度为0.5~1.5μ m的透明薄膜状材料,通过添加磷酸钾及甲醇等,还可将蛛丝蛋白的二级结构由α-螺旋转变为β-折叠,从而制得疏水薄膜[12-13]。另外通过基因克隆技术,还可对薄膜表面进行功能化处理,从而使所得到的材料广泛用作创伤敷料及固定化酶框架材料。
2.1.3 水凝胶及多孔海绵
在合成的蜘蛛拖丝蛋白ADF-4中添加甲醇,蜘蛛丝会自聚集形成直径为3nm左右,长度不少于1μ m的纳米纤维,数天之后,这些纳米纤维回转变为具有纤维网状结构的水凝胶,所形成的水凝胶为一种非线性粘弹性材料,其强度及刚度相对较低。而用该方法得到的水凝胶还可以进一步交联,使材料的模量和强度有较大程度的提高,并能用来制作具有多孔结构的稳定的组织框架材料[14]。另外,蚕丝及蜘蛛丝均还可用来制作多孔的三维海绵状材料,其方法为,将丝蛋白溶于混有盐及甲醇的溴化锂溶液中,经处理后得到海绵状材料[15]。所得到三维海绵材料在组织工程领域有极其重要的应用价值,可作为框架起到支撑细胞、运送养及代谢废物的作用,从而促进组织发育。
2.1.4 微球及微胶囊
通过控制丝蛋白,如ADF-4蛛丝蛋白,在油水界面的聚集行为,可得到β-折叠结构占主导的薄的聚合物壳,最终形成壳的厚度为50nm左右,直径为1~30μ m的丝蛋白聚合物微球或空心微胶囊[16]。由于所得到的微胶囊壳层主要为β-折叠结构的丝蛋白,因此具有较强的机械性能,另外其可降解性能也很容易控制,因此,在药物可控释放及微反应器设计方面具有极好的应用前景。
2.2 丝蛋白与其他材料合成的生物材料
如上文所述,天然丝蛋白可通过人工合成的方法得到具有不同形貌的生物材料,此外,通过与其它材料合成的方法,还可以得到功能多样化的生物材料。近年来研究较多的着重于丝蛋白与有机聚合物及无机纳米颗粒合成材的生物材料的研究,下面也将对其研究进展作一概述。
2.2.1 丝蛋白与有机聚合物合成的生物材料
目前基于丝蛋白与有机聚合物的新型材料种类繁多,本文着重概述丝蛋白与更具有应用前景的可降解有机聚合物合成的生物材料的相关研究。
聚天冬氨酸(Poly(aspartic acid))和桑蚕丝复合可制得泡沫材料,具体方法为将桑蚕丝蛋白与聚天冬氨酸的混合物置于加有氯化钠的容器中,室温下放置24h,经水洗后形成β-折叠结构为主的多孔材料,孔径为750μ m左右[17],通过这种方法形成的复合材料在生物矿化领域具有极有利的应用空间。
聚己内酯(Poly(ε-caprolactone))是经美国食品及药品管理局(FDA)认证的一种可生物降解的聚合物。将天然桑蚕丝与聚己内酯通过熔融混合的方法可加工制作成薄膜状材料,所得到的薄膜材料含有的丝纤维组分约为35%~45%,因此具有优良的机械性能。另外,最近的研究还发现,利用电子束对所形成的复合生物材料作用,所产生的自由基还可以促使聚合物链段之间的交联,从而进一步改善材料的拉伸强度[18]。
聚乳酸(polylactic acid)是一种在生物医学领域应用及其广泛的可降解聚合物,将聚乳酸与蚕丝蛋白复合可加工制作成薄膜、泡沫及纤维状复合生物材料[19]。此外,丝蛋白还可与多种可降解聚合物包括聚氨酯丙烯酸酯、聚乳酸聚乙二醇酸及多种生物聚合物包括酶、丝心蛋白等进行复合制备既具有优良的机械性能又具备生物降解性能的复合生物材料。
2.2.2 丝蛋白与无机纳米颗粒合成的生物材料
与有机聚合物相比,无机纳米颗粒以其独特的光学、电学、力学及磁学性能,近年来吸引了研究者们的广泛关注,利用有机丝蛋白与无机纳米颗粒复合的方法更是可以制备出在生物化学、生物技术及医药领域极具应用潜力的复合生物材料。丝蛋白与无机纳米颗粒的复合工艺非常简单,可直接将无机纳米颗粒溶胶与丝蛋白溶液混合搅拌而得。目前研究较多的基于丝蛋白与无机纳米颗粒合成的材料包括桑蚕丝蛋白与银、金、过渡金属纳米颗粒及纳米二氧化钛、二氧化硅的复合材料的制作[4]。与纯的蚕丝相比,所制作的复合生物材料的性能得到不同程度的改善,如采用蚕丝与银纳米颗粒制作的纤维或薄膜表现出抗菌性能的改善,而桑蚕丝与金纳米颗粒制作的纤维表现出更好的导电性等,从而有利于基于丝蛋白生物材料的应用领域的进一步拓展。
[1]Altman G H.,Diaz F.,Jakuba C.,Calabro T.,Horan R L.,Chen J S.,Lu H L.,Richmond J.,Kaplan D L.Silk-based biomaterials[J].Biomaterials.2003,24:401-416.
[2]Hardy J G.,Scheibel T R.Composite materials based on silk proteins[J].Progress in Polymer Science.2010,doi:10.1016/j.progpolymsci.2010.04.005.
[3]彭卫平.蚕丝和蜘蛛丝蛋白基因结构极其表达[J].蚕业科学.1998,24(4):231-243.
[4]Hardy J G.,Röman L M.,Scheibel T R.Polymeric materials based on silk proteins[J].Polymer.2008,49:4309-4327.
[5]Poza P.,Rigueiro J P.,Elices M.LLorca J.Fractographic analysis of silkworm and spider silk[J].Engineering Fracture Mechanics.2002,69:1035-1048.
[6]Kluge J A.,Rabotyagova O.,Leisk G G.,Kaplam L.Spider silks and their applications[J].Trends in Biotechonology.2008,26(5):244-252.
[7]Altman,G H.et al.Silk matrix for tissue engineered anterior cruciate ligaments[J].Biomaterials.2002,23:4131-4141.
[8]Allmeling,C.et al.Use of spider silk fibres as an innovative material in a biocompatible artificial nerve conduit[J].Journal of Cellular and Molecular Medicine.2006,10:770-777.
[9]Sofia,S.et al.Functionalized silk-based biomaterials for bone formation[J].Journal of Biomeidical Materials.2001,54:139–148.
[10]Xu,Y.et al.Studies on spinning and rheological behaviors of regenerated silkfibroin/N-methylmorpholine-N-oxide H2O solutions[J].Journal of Materials Science.2005,40:5355-5358.
[11]Arcidiacono,S.et al.Aqueous processing and fiber spinning of recombinant spider silks[J].Macromolecules.2002,35:1262-1266.
[12]Huemmerich,D.et al.Processing andmodification of filmsmade from recombinant spider silk proteins[J].Applied Physics A 2006,82:219-222.
[13]Junghans,F.et al.Preparation and mechanical properties of layers made of recombinant spider silk proteins and silk from silkworm[J].Applied Physics A 2006,82:253-260.
[14]Rammensee,S.et al.Rheological characterization of hydrogels formed by recombinantly produced spider silk[J].Applied Physics A 2006,82:261-264.
[15]Gellynck,K.et al.Chondrocyte growth in porous spider silk 3D-scaffolds[J].European Cells and Materials Journal.2005,10(Suppl.2):45.
[16]Hermanson,K.D.et al.Engineered microcapsules fabricated from reconstituted spider silk[J].Advance Materials.2007,19:1810-1815.
[17]Kim H J,Kim U J,Kim H S,Li C M,Wada M,Leisk G G,et al.Bone tissue engineering with premineralized silk scaffolds[J].Bone 2008,42:1226-1234.
[18]Qiao X Y,Li W,Sun K,Xu S,Chen X D.Nonisothermal crys-tallization behaviors of silk-fibroin-fiberreinforced poly(epsilon-caprolactone)biocomposites[J].Journal of Applied Polymer Science.2009,111:2908-2916.
[19]Zhu H L,Feng X X,Zhang H P,Guo Y H,Zhang J Z,Chen J Y.Structural characteristics and properties of silk fibroin/poly(lactic acid)blend films[J].Journal of Biomaterials Science,Polymer Edition 2009,20:1259-1274.
