超抗原 SEA原核表达及诱导淋巴细胞杀伤人肺腺癌细胞效果观察
2010-03-07冯艳敏孙嘉琳胡坤张世奇朱秀珊张云陈自辉
冯艳敏 孙嘉琳 胡坤 张世奇 朱秀珊 张云 陈自辉
放射治疗、化学治疗等传统治疗肿瘤的方法虽然杀伤作用强,但选择性很弱,在杀伤肿瘤细胞的同时也大量杀伤正常细胞,导致治疗效果难以令人满意。提高细胞免疫能力以达到治疗肿瘤的目的,是目前肿瘤生物治疗研究的重要方向。把超抗原(superantigen,SAg)应用于肿瘤的免疫治疗,是在抗肿瘤实验研究的基础上发展起来的一种新的肿瘤免疫治疗研究模式[1-3]。超抗原是一类能直接激活某些T细胞亚型或 B细胞亚型的结构上相似的一类蛋白质,引起众多细胞因子释放,激活 T、B、抗原呈递细胞(APC)、杀伤细胞(NK)等细胞;另一方面,也可导致免疫抑制、免疫耐受和无能应答[4]。金黄色葡萄球菌肠毒素 A(SEA)是金黄色葡萄球菌的产物,可直接与APC膜上的主要组织相容性复合体 MHCⅡ类分子的肽结合沟外侧的高度保守区结合,使表达有T细胞抗原受体TCRV区的 T细胞大量激活[5],强烈诱导细胞毒性T淋巴细胞(CTL)活性及细胞因子的产生。由于 SEA诱导的CTL对肿瘤细胞有强大的杀伤作用,因此应用 SEA进行抗肿瘤治疗得到了人们的热切关注[6]。外周血单核细胞(PBMC)是不均一的细胞群体,包括CD4T细胞、CD8T细胞、NK等免疫活性细胞。CD4T和 CD8T细胞亚群发挥特异性杀肿瘤效应,而NK细胞的杀瘤活性不具特异性,这些免疫细胞在肿瘤免疫中发挥主要作用。免疫细胞表面受体和相应配体结合后,通过信号转导,活性增强,其杀瘤活性提高。超抗原为多克隆细胞激活剂,能在极低的浓度下激活免疫细胞[7]。
1 材料与方法
1.1 材料 大肠杆菌BL21(DE3)为本实验室保存;重组质粒pET22b-SEA由大连宝生物工程公司合成;IPTG为 Solarbio产品;His◦Bind Buffer Kit蛋白纯化试剂盒购于 Novagen公司;DNA及蛋白分子质量标准为 Promega公司产品;人肺腺癌细胞A 549购自中国科学院上海细胞所;人外周血白膜购自天津市血液中心;DMEM高糖培养基和胎牛血清(FBS)均购自 Gibco公司;四甲基偶氮唑盐(MTT)为上海生工生物工程公司产品;胰蛋白酶、G 418、二甲基亚砜(DMSO)均为 Promega公司产品;
1.2 方法
1.2.1 目的蛋白的诱导表达:将重组质粒 pET22b-SEA转化至大肠杆菌 BL21(DE3),挑取单菌落于 LB培养基中,37℃培养至 A 600≈0.5时,加 IPTG至终浓度 1mmol/L,30℃振荡过夜培养,收集菌体,将菌体用 50mmol/L Tris-HCl pH 8.0悬浮,冰浴中超声破菌,14 000 r/min离心10min分离上清液与沉淀,进行SDS-PAGE分析。
1.2.2 SEA蛋白的分离纯化:将超声波破菌后得到的沉淀用含 2mmol/L尿素的 50mmol/L、Tris-HCl pH 8.0洗涤 2次后,加入变性剂(8 mmol/L尿素,3mmol/L EDTA,50mmol/L Tris-HCl pH 8.0)溶解包涵体,14 000 r/min离心 10min,收集上清液,将变性后的上清液装入透析袋中,在 50 mmol/L Tris-HCl pH 8.0中,4℃下过夜透析。将透析后所得溶液 14 000 r/min离心 10m in,去掉透析过程中形成的沉淀,上清液用 His◦Bind Buffer Kit进行纯化,胶床先用 1×Binding Buffer平衡后,将之与样品蛋白进行结合,用 1×Washing Buffer漂洗 3遍,1×Elute Buffer洗脱 4遍。收集洗脱液,用 SDS-PAGE对产物进行鉴定。
1.2.3 PBMC的分离:取健康成人外周血(含抗凝剂),用0.9%氯化钠溶液 1∶1稀释成血液稀释液,将稀释液缓慢加至含淋巴细胞分离液的离心管中(稀释液与淋巴细胞分离液的比例为 2∶1),2 000 r/min,离心 20min。小心吸取单核细胞层,加入 4倍体积的 DMEM高糖培养基,混匀,2 000 r/m in,离心10min,弃去上清,重复 1次,最后加入 DMEM完全培养基制备成细胞悬液,细胞密度为 2×106/ml,于 5%CO2、37℃孵育培养。
1.2.4 SEA蛋白诱导 PBMC杀伤人肺腺癌细胞 A549:取对数生长期的 A549细胞胰酶消化成单细胞悬液,用含 10%FBS的DMEM完全培养基将肿瘤细胞浓度调至 2×105/ml,100μl/孔铺于 96孔板中;将纯化后的 SEA蛋白原液用 20 mmol/L HEPES进行 10倍顺序稀释,使 96孔板每孔 SEA终浓度分别为10、1、0.1、0.01 g/ml,加入相应孔中与细胞共育,每组设 6个复孔;同时效靶比设 5∶1、10∶1和 20∶1 3组对照,加 PBMC 100μl/孔与癌细胞混合;将 96孔板置于 37℃、5%CO2培养箱中孵育培养,分别于 12、36、60h后测定 PBMC的杀瘤活性。另设空白、效应细胞、靶细胞对照。
1.2.5 MTT法测定杀瘤活性:每孔加入 MTT(5 g/L)11 L,继续孵育 4 h,取出离心,弃上清,加入 150μl DMSO,以 490 nm波长检测各孔吸光度(A)值,根据公式计算杀伤率:杀伤率(%)=[1-(实验组A值 -效应细胞对照A值)/靶细胞对照 A值]×100%。
1.3 统计学分析 应用 SPSS 13.0统计软件,计量资料以±s表示,采用单因素方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 SEA的诱导表达 将重组质粒 pET22b-SEA转入大肠杆菌 BL21(DE3),加入终浓度 1mmol/L ITPG过夜诱导,离心收集菌体,超声波破碎细胞后分离上清与沉淀,SDS-PAGE电泳分析结果见图 1。表达产物的蛋白分子量约 30 kDa,与理论值大小一致,而转入空质粒 pET22b的大肠杆菌总蛋白抽提液中未出现这一条带。说明重组质粒 pET22b-SEA在大肠杆菌 BL21(DE 3)中成功表达。
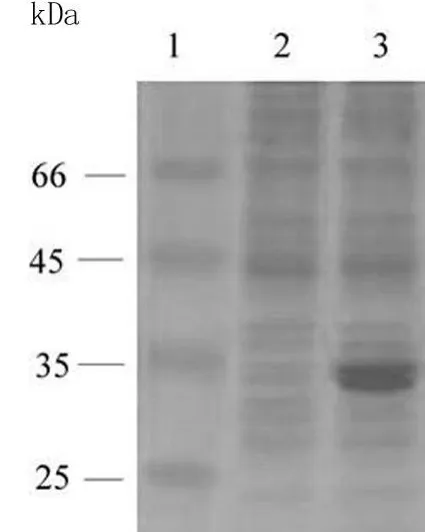
图 1 SEA在大肠杆菌 BL21(DE 3)中的表达
2.2 目的蛋白的纯化 将获得的包涵体经洗涤、变性、复性后,用 His◦Bind Bu ffer Kit试剂盒进行纯化,所得洗脱液进行SDS-PAGE分析(图 2)。蛋白电泳结果表明目的蛋白已经得到了较好的纯化。

图 2 SEA的纯化
2.3 SEA诱导 PBMC杀伤人肺腺癌细胞A 549的显微观察
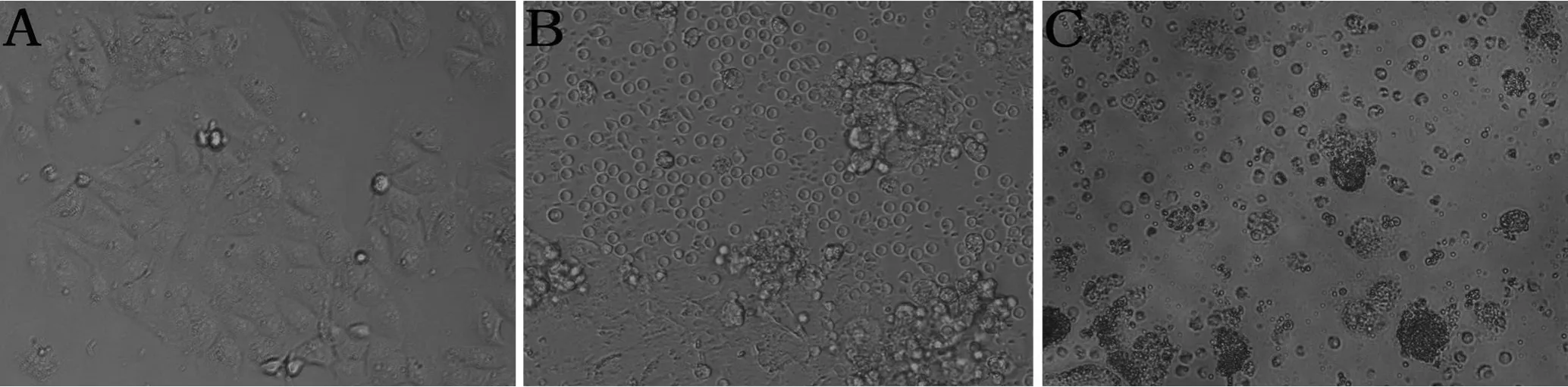
图 3 SEA诱导 PBMC杀伤 A549的显微观察(×200)
表1 不同浓度SEA诱导不同效靶比人PBMC在不同作用时间杀瘤活性比较%,±s
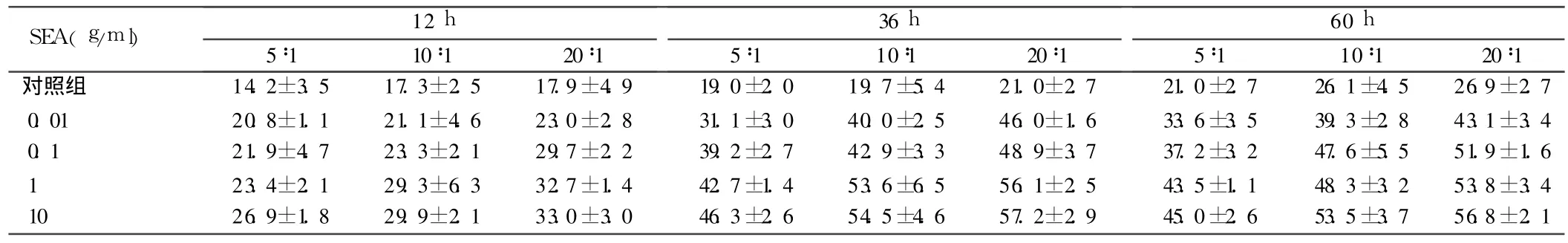
表1 不同浓度SEA诱导不同效靶比人PBMC在不同作用时间杀瘤活性比较%,±s
SEA(g/m l) 12 h 5∶1 10∶1 20∶1 36 h 5∶1 10∶1 20∶1 60 h 5∶1 10∶1 20∶1对照组 14.2±3.5 17.3±2.5 17.9±4.9 19.0±2.0 19.7±5.4 21.0±2.7 21.0±2.7 26.1±4.5 26.9±2.7 0.01 20.8±1.1 21.1±4.6 23.0±2.8 31.1±3.0 40.0±2.5 46.0±1.6 33.6±3.5 39.3±2.8 43.1±3.4 0.1 21.9±4.7 23.3±2.1 29.7±2.2 39.2±2.7 42.9±3.3 48.9±3.7 37.2±3.2 47.6±5.5 51.9±1.6 1 23.4±2.1 29.3±6.3 32.7±1.4 42.7±1.4 53.6±6.5 56.1±2.5 43.5±1.1 48.3±3.2 53.8±3.4 10 26.9±1.8 29.9±2.1 33.0±3.0 46.3±2.6 54.5±4.6 57.2±2.9 45.0±2.6 53.5±3.7 56.8±2.1
将抽提出的 SEA蛋白原液经滤膜过滤除菌(0.2μm),并用20mmol/L HEPES将其浓度稀释成 10、1、0.1、0.01 g/m l,设效靶比为 5∶1、10∶1、20∶1和对照共 4组,加 PBMC 100 μm/孔与癌细胞 37℃、5%CO2共育。从图 3中可以看出,A为未加入SEA和 PBMC的 A549细胞;B为加入 SEA和 PBMC 12 h后的照片,可见 PBMC在 SEA的诱导下聚集在 A 549的周围,对其进行免疫攻击;C为加入 SEA和 PBMC 60 h后的情况,PBMC在SEA的诱导下对 A549细胞进行杀伤,图中黑色团状物质即为经 SEA诱导后 PBMC杀死的 A 549细胞。
2.4 不同浓度SEA诱导人PBMC不同时间杀瘤活性的结果
总体上随着 SEA浓度的升高,PBMC对肿瘤细胞的杀伤率也随着升高,0.01、0.1、1 g/ml组间差异有统计学意义(P<0.05),而 SEA浓度 10g/ml与 1g/ml组间无统计学意义(P>0.05),所以在一定范围内 PBMC的杀瘤活性随 SEA浓度的升高而增强;在与SEA作用36h后PBMC对肿瘤的杀伤作用明显高于短作用时间组(12h),杀伤率在12 h和36 h组间差异有统计学意义(P<0.05);而随着作用时间延长至 60 h时,杀伤率并未出现显著升高,与 36 h组间无统计学意义(P>0.05),说明过长的诱导时间对增强杀瘤活性没有明显的作用;随着效靶比的增加,杀瘤活性也随之提高(P<0.05)。见表 1。
3 讨论
超抗原是一种强大的免疫激活因子,无须 APC的加工处理,可直接结合 APC的 MHCⅡ类分子和 TCRV链,激活大量 T细胞,通过细胞毒作用(SDCC)和细胞因子的直接和间接杀伤作用起到抑瘤作用。超抗原活化的 CD8+T细胞 MHCⅡ类分子与 MHCⅡ类阳性的肿瘤细胞相偶联,即可对后者发挥强烈的杀伤作用。另一方面,超抗原活化的CD4+T细胞也具有直接杀伤表达 MHCⅡ类分子肿瘤细胞功能,而且可增强肿瘤细胞表达 MHCⅡ抗原分子,增强癌细胞刺激宿主免役系统的能力;同时,这些细胞因子又刺激 T细胞进一步增殖分化,又产生更多的细胞因子与 SDCC作用共同导致肿瘤细胞的溶解。以SE等细菌性超抗原诱导免疫细胞的杀瘤活性,是近年来应用超抗原进行肿瘤生物治疗的基本研究思路[8,9]。
本实验结果可以得出,在总体趋势上,随着加入SEA浓度的升高,PBMC的杀伤活性也随着提高,而浓度高于 1 g/m l时,单纯增加浓度不会对提高杀伤效率产生明显作用。有可能由于高浓度的SEA与PBMC作用,诱导出无能 T细胞的形成,也可能由于PBMC无法与过量的SEA作用,此机制尚不清楚。在作用时间方面,SEA与 PBMC作用初期延长作用时间可以明显增强杀瘤效果,而当诱导时间延长至 60 h后,杀瘤活性并未继续增强,所以当作用时间达一定程度时,单纯延长反应时间也无法提高杀瘤活性。同时杀伤效果还与效靶比呈正相关。
1 Alexander Rosendah,Karin Kristensson,Johan Hansson,et al.Perforin and IFN-Ale involved in the antitumor effects of antibody-targeted superantigens.JBacteriol,1998,170:34-41.
2 Schwartz RH.Modelsof T cellanergy:is there a commonmolecularmechanism.JExp Med,1996,184:1-8.
3 Riesbeck K,Billstrm A,Tordsson J,et al.Endothelial cells expressing an inflammatory phenotype are lysed by superantigen-targeted cytotoxic T cells.Clin Diagn Lab Immunol,1998,5:675.
4 Baker MD,Acharya KR.Superantigens:structure-function relationships.Int JMed Microbiol,2004,293:529-537.
5 金伯泉主编.细胞与分子免疫学.第 1版.北京:科学出版社,2001.372-374.
6 Ren S,Terman DS,Bohach G,etal.Intrapleuralstaphylococcalsuperantigen induces resolution ofmalignantpleural effusionsand a survivalbenefit in non-small cell lung cancer.Chest,2004,126:1529.
7 Baum D,Yaron R,YeUin MJ.TNF,not CD 154(CD 40L),plays a major role in SEB-dependent,CD 4(+)T cell-induced endothelial cell activation in vitro.Cellular Immunology,1998,190:12-22.
8 Hedlund G,Dohlsten M,Petersson C,et al.Superantigen-based tumor therapy:In vivo activation of cytotoxic T cells.Cancer Immunol Immunother,1993,36:89.
9 王艺丹.超抗原及其在肿瘤治疗中的作用研究.临床免疫学杂志,1998,8:36.
