抗人红细胞单链抗体与猪瘟E2蛋白双功能融合蛋白的构建及生物学活性检测
2010-02-26覃绍敏白安斌吴健敏廖文军袁书智华俊关忠谊
覃绍敏,白安斌,吴健敏,廖文军,袁书智,华俊,关忠谊
1 广西兽医研究所,南宁 530001
2 惠朋动物药业有限责任公司,南宁 530001
猪瘟 (Classical swine fever,CSF) 是由猪瘟病毒(Classical swine fever,CSFV) 引起的危害养猪业最严重的传染病,是我国计划要消灭的四大动物传染病之一。在猪瘟综合防制措施中,定期抗体监测是了解猪群免疫状况和评价疫苗免疫效果的根本保证。目前临床上常用的猪瘟抗体检测方法有酶联免疫吸附试验 (ELISA) 和间接血凝试验 (IHA),然而,这两种方法都有其不足之处。ELISA方法需要辅助仪器,且成本较高,耗时相对较长,限制了该方法在基层的进一步普及;IHA 虽然不需要特殊的辅助仪器,且简便、快捷、易操作,但此方法稳定性不高,不同批次生产的猪瘟病毒抗原在检测同一份血清样品时,获得的结果往往差异较大,很难准确反映猪群抗体水平的高低。因此,有必要建立一种快速、简便、准确、稳定的猪瘟抗体检测方法应用于临床。
近年来,以红细胞作为指示细胞的一类快速检测方法——红细胞凝集试验发展迅速,有望应用于快速检测领域[1-7]。该方法简便、快速、敏感、特异,又不需要任何特殊仪器,它使检测工作像测血型一样简便,尤其适合于基层和现场使用。其基本原理是:以红细胞作为指示细胞,利用基因工程方法构建一种重组双功能融合蛋白 (目标肽抗原或抗体与红细胞非凝集型抗体联结而形成的肽抗原-抗体或抗体-抗体结合物),该融合蛋白既能与红细胞结合又能与被检抗体/抗原结合,通过样品中被检抗体/抗原的桥联作用,使指示红细胞发生凝集,根据指示红细胞的凝集现象达到快速检测的目的。
抗人红细胞抗体是一类针对人红细胞表面各种抗原的单克隆抗体,其中 IgG 类抗体因其在盐水介质中能与红细胞结合但不使红细胞凝集,被称为抗人红细胞非凝集型单抗。近年来的研究证实,该类单抗无论是在疾病诊断还是临床治疗方面,都具有很大的潜力。将抗人红细胞单抗改造成重组的单链抗体,会进一步拓展该类单抗的应用范围。
红细胞 H血型抗原是除稀有的孟买 (Bombay)型红细胞外,分布在所有人红细胞表面的共有抗原。本研究在抗人红细胞 H抗原单链抗体 (2E8ScFv)[8]的基础上,通过重叠延伸 (SOE) PCR方法,将经过定点突变的CSFV E2蛋白主要抗原编码区 (mE2)[9]与其融合,成功构建了2E8mE2融合蛋白,并在大肠杆菌中获得了表达。对融合蛋白进行纯化和复性,通过人红细胞凝集试验检测,证实该融合蛋白既具有凝集性 (与人红细胞结合) 又具有免疫反应性(与CSFV抗体反应),是一种双功能的融合蛋白,为下一步建立猪瘟抗体快速检测方法奠定了基础。
1 材料与方法
1.1 重组质粒、载体、菌株和血清
重组质粒 pMD-2E8ScFv (含有抗人红细胞 H抗原单链抗体基因)[8]由军事医学科学院野战输血研究所章金刚研究员惠赠;重组质粒 pETmE2 (含有CSFV E2蛋白主要抗原编码区基因mE2)[9]和CSFV高免血清均由军事医学科学院军事兽医研究所涂长春研究员惠赠;原核表达载体pET-DsbA、表达菌株BL21(DE3)PlysS由本实验室保存;20份CSFV阳性血清、20份CSFV阴性血清、猪繁殖与呼吸综合征病毒PRRSV阳性血清、猪流感病毒SIV阳性血清、猪圆环病毒2型PCV2阳性血清、猪伪狂犬病病毒PRV阳性血清和猪细小病毒PPV阳性血清均由本实验室保存。
1.2 主要试剂
T4 DNA连接酶、限制性内切酶BamH I和Nhe I、Taq DNA聚合酶均为TaKaRa公司产品;Wizard PCR产物纯化试剂盒、IPTG均为Promega公司产品;鼠源抗6 × His单克隆抗体为Merck公司产品;辣根过氧化物酶 (HRP) 标记羊抗鼠IgG为进口分装产品;HRP标记羊抗猪IgG为Santa公司产品;Ni-NTA蛋白纯化树脂为Qiagen公司产品;氧化型谷胱甘肽和还原型谷胱甘肽均为 Sigma公司产品;其他试剂均为国产分析纯。
1.3 重组PCR引物设计
根据重叠延伸PCR的原理和mE2与2E8ScFv基因序列,设计4条重组PCR引物 (表1)。其中引物2E8ScFv-F/2E8ScFv-R用于扩增合成 2E8ScFv基因,引物 mE2-F/mE2-R用于扩增合成 mE2 基因。2E8ScFv 3′末端15个碱基和mE2 5′端15个碱基为互补序列 (阴影部分) 用于基因的拼接,拼接顺序为2E8ScFv-mE2。2E8ScFv-F和mE2-R中的下划线部分为便于克隆分别引入的BamH I、Nhe I酶切位点。引物均由北京博迈德公司合成。

表1 重组PCR引物Table 1 Recombinant PCR primers
1.4 2E8mE2融合蛋白原核表达载体的构建及鉴定
分别从重组质粒pMD-2E8ScFv和pETmE2上扩增目的基因2E8ScFv和mE2。PCR扩增条件均为:95℃预变性3 min;95℃变性30 s,56℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min。以纯化后的2E8ScFv和mE2基因为模板,采用重叠延伸PCR方法拼接2E8mE2融合基因。第一轮PCR反应体系为:2E8ScFv和mE2基因各0.3 µL、10 mmol/L dNTPs 1 µL、10 × Buffer 2.5 µL、5 U/µL Taq 酶0.3 µL,用灭菌双蒸水加至总体积25 µL。 PCR反应条件为:95℃预变性3 min;95℃变性1 min,58℃退火1 min,72℃延伸2 min,7个循环。当第一步反应结束后,在反应体系中加入引物2E8ScFv-F和mE2-R各0.3 µL,然后95℃预变性3 min;95℃变性1 min,61℃退火1.5 min,72℃延伸2 min,30个循环;最后72℃延伸10 min。将上述 PCR 产物纯化回收后与 pMD18-T Simple载体连接,转化TOP 10F'感受态细胞,提取质粒,经PCR及酶切鉴定后再测序验证序列是否正确。用BamH I和Nhe I双酶切重组质粒,将2E8mE融合基因亚克隆到原核表达载体pET-DsbA中,构建双功能融合蛋白表达载体,将该表达载体转化TOP 10F'感受态细胞,提取质粒,经PCR及酶切鉴定后测序,以确证其读码框是否正确。
1.5 2E8mE2融合蛋白的诱导表达及 SDS-PAGE分析
将 pET-DsbA-2E8mE2 融合蛋白表达载体转化BL21 (DE3) PlysS,取阳性转化菌,以37℃、200 r/min振荡培养至OD600值为0.5~1.0时,加入IPTG至终浓度为1.0 mmol/L进行诱导培养,离心收集1 mL菌体进行SDS-PAGE分析,并用BandScan软件测定目的蛋白相对含量。同时取表达菌液进行超声波破碎处理,分别收集沉淀和上清,沉淀用1 mol/L NaCl和0.5% Tritonx-100初步洗涤,再用8 mol/L尿素溶解,将上述尿素溶解液和上清样品进行SDS-PAGE分析,检测目的蛋白表达情况。
1.6 2E8mE2融合蛋白的纯化与复性[10]
根据 1.5中的方法对收集的沉淀进行洗涤和尿素溶解,因表达的融合蛋白上带有6个组氨酸标签,因此用Ni-NTA-His-Bind 树脂对其进行纯化,具体操作参照Qiangen公司的Ni-NTA蛋白纯化说明书。洗涤缓冲液为:100 mmol/L NaH2PO4·H2O,10 mmol/L Tris-Cl,8 mol/L尿素,pH 6.3;洗脱缓冲液I为:100 mmol/L NaH2PO4·H2O,10 mmol/L Tris-Cl,8 mol/L尿素,pH 5.9;洗脱缓冲液 II为:100 mmol/L NaH2PO4·H2O,10 mmol/L Tris-Cl,8 mol/L尿素,pH 4.5。SDS-PAGE对纯化后蛋白进行分析。采用Bradford法测定纯化后融合蛋白浓度,用缓冲液(20 mmol/L Tris-HCl,2 mmol/L EDTA,pH 8.5) 稀释蛋白浓度至100 µg/mL以下,并使溶液中的尿素浓度保持在 l mol/L,然后加入还原型谷胱甘肽和氧化型谷胱甘肽,使其终浓度分别达到 l mmol/L和0.1 mmol/L,充分混匀,置于带胶塞的瓶中用注射器抽气后于16℃放置 20 h进行复性。复性完成后,用20 mmol/L Tris-HCl (pH 8.5) 缓冲液透析复性48 h,每6 h换液一次。用PEG20000浓缩复性蛋白,并测定其浓度。
1.7 Western blotting检测
表达的融合蛋白经SDS-PAGE电泳分析后,转移至NC膜上进行Western blotting鉴定。一抗选择两种,分别为鼠源抗6 × His单克隆抗体 (2E8mE2融合蛋白带有6个组氨酸标签) 和CSFV高免血清,对应二抗分别为 HRP标记的羊抗鼠 IgG和羊抗猪IgG,经底物二氨基联苯胺 (DAB) 显色后分析。以诱导表达的空载体菌体蛋白为阴性对照。同时用PRRSV、SIV、PCV2、PRV和PPV阳性血清对融合蛋白进行Western blotting检测。
1.8 红细胞凝集试验检测2E8mE2融合蛋白的生物学活性
取 20份 CSFV阳性血清 (经 IDEXX CSFV ELISA 抗体检测试剂盒验证),按50 µL/每孔依次加入血凝板中,然后再向每个孔中依次加入20 µL双功能蛋白 (500 µg/mL) 和 20 µL 2% O型人红细胞,混匀,静置30 min,观察结果。分别设阴性蛋白 (经过同样处理的 PET-DsbA空载体表达蛋白DsbA)、20份CSFV抗体阴性血清 (经IDEXX CSFV ELISA抗体检测试剂盒验证) 和其他常见猪病阳性血清为对照。分别取A、B和AB型人红细胞代替O型人红细胞,体系中其余成分及其加入量保持不变,按上述方法进行操作,30 min观察凝集现象。
2 结果
2.1 2E8mE2融合蛋白原核表达载体的构建及鉴定
以重组质粒 pMD-2E8ScFv 和 pETmE2 为模板分别扩增出目的基因2E8ScFv和mE2。扩增产物大小分别为732 bp和393 bp,与预期扩增片段一致。以2E8ScFv和mE2基因片段为模板,通过重叠延伸PCR 将2E8ScFv和mE2拼接成2E8mE2融合基因(1125 bp)。将2E8mE2片段克隆到pMD18-T Simple载体上,鉴定正确后插入表达载体pET-DsbA,经酶切及PCR鉴定,均可获得大小约1125 bp的片段 (图1),测序结果表明该片段与融合基因2E8mE2一致,且已正确插入表达载体的阅读框中。
2.2 2E8mE2融合蛋白的表达、纯化及复性
选取pET-DsbA-2E8mE2转化菌和pET-DsbA空载体对照菌进行 IPTG 诱导表达,结果在 37℃、IPTG浓度为0.3 mmol/L、诱导3 h时获得最大表达,表达量占菌体蛋白总量的30%左右。经SDS-PAGE分析,该融合蛋白表达以包涵体为主,有少量的可溶性蛋白表达 (图略),相对分子质量约65 kDa (图2),与预期蛋白相符。表达产物经包涵体洗涤、过柱纯化后,蛋白纯度能达到95%左右 (图2)。纯化后的包涵体经谷胱甘肽法复性可得到具有生物学活性的蛋白质。Bradford法检测复性浓缩后蛋白终浓度约为500 µg/mL。
2.3 Western blotting检测
表达的2E8mE2融合蛋白经SDS-PAGE电泳后,转移至 NC膜上,分别用抗 6×His单克隆抗体和CSFV高免血清进行Western blotting检测,结果在65 kDa处均出现一条特异性的抗原-抗体结合带 (图3A),而同时用PRRSV、SIV、PCV2、PRV和PPV阳性血清对2E8mE2融合蛋白进行Western blotting检测,结果无任何免疫印迹带出现 (图3B),说明表达的融合蛋白能分别与抗 6×His单克隆抗体及CSFV高免血清发生特异性反应。

图1 重组质粒pET-DsbA-2E8mE2的双酶切鉴定Fig. 1 Identification of pET-DsbA-2E8mE2 by enzyme digestion. M: DNA marker 15000; 1: PET-DsbA-2E8mE2 digested with BamH I and Nhe I; 2: PCR product of 2E8mE2 fusion gene.
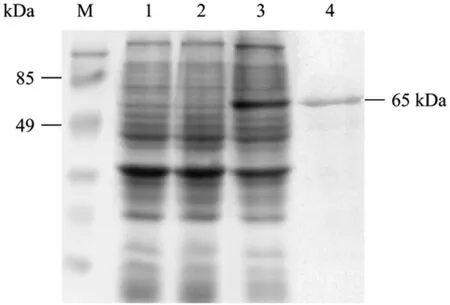
图2 SDS-PAGE检测纯化的2E8mE2融合蛋白Fig. 2 SDS-PAGE analysis of purified 2E8mE2 fusion protein. M: protein marker; 1: negative protein control; 2: recombinant bacterium protein before being induced by IPTG; 3: recombinant bacterium protein after being induced by IPTG; 4: purified 2E8mE2 fusion protein.

图3 2E8mE2融合蛋白的Western blotting检测Fig. 3 Western blotting detection of 2E8mE2 fusion protein. (A) 6×His monoclonal antibody. M: protein marker; 1: recombinant bacterium protein after being induced by IPTG; 2: negative protein control. (B) Positive sera. M: protein marker; 1: PRRSV positive serum; 2: SIV positive serum; 3: PCV2 positive serum; 4: PRV positive serum; 5: PPV positive serum; 6: negative protein control; 7: CSFV positive serum.
2.4 红细胞凝集试验检测2E8mE2融合蛋白的生物学活性
采用2E8mE2融合蛋白、2% O型人红细胞、CSFV阳性血清进行红细胞凝集试验,结果20份样品均可观察到强凝集现象 (图4A),而以空载体表达蛋白DsbA代替2E8mE2融合蛋白进行同样的试验,未观察到凝集现象 (图4B)。用20份CSFV阴性血清与 2E8mE2融合蛋白作用后,均未发生凝集 (图4C)。以A、B和AB型人红细胞进行上述同样的试验,结果也观察到强凝集现象 (图4D)。用PRRSV、SIV、PCV2、PRV和PPV阳性血清分别与2E8mE2融合蛋白作用,均未发生凝集 (图4E)。说明2E8mE2融合蛋白具有与人红细胞结合特性,无血型特异性,且只与CSFV阳性血清发生特异性结合。
3 讨论

图4 红细胞凝集试验Fig. 4 Erythrocyte agglutination test. (A) Erythrocyte agglutination test of 2E8mE2 fusion protein and CSFV positive sera and O type human red blood cells. (B) Erythrocyte agglutination test of negative protein and CSFV positive sera and O type human red blood cells. (C) Erythrocyte agglutination test of 2E8mE2 fusion protein and CSFV negative sera and O type human red blood cells. (D) Erythrocyte agglutination test of 2E8mE2 fusion protein and CSFV positive serum and human red blood cells. 1: A type human red blood cell; 2: B type human red blood cell; 3: AB type human red blood cell; 4: O type human red blood cell; 5: negative control. (E) Erythrocyte agglutination test of 2E8mE2 fusion protein and positive sera and O type human red blood cells. 1: PRRSV positive serum; 2: SIV positive serum; 3: PCV2 positive serum; 4: PRV positive serum; 5: PPV positive serum.
澳大利亚学者Kemp等于1988年在Science上发表文章首次提出了自体红细胞凝集试验的概念[1]。其主要原理是以被检者自身的红细胞作为指示细胞,加入通过化学交联法制备的双功能分子 (抗红细胞单抗与HIV-1 gp4抗原肽的交联蛋白),如出现肉眼可见的红细胞凝集现象,就可判断该被检者已被HIV病毒感染,即血液中存在抗HIV-1 gp41的抗体。由于化学交联法操作繁琐,试剂不稳定,易破坏抗体功能,使其应用受到了限制。1994年,Lilley等[11]首次利用DNA重组技术,将抗人红细胞单链抗体基因与编码HIV-1 gp41蛋白中35个氨基酸的DNA片段重组,成功地制备出了可用作HIV-1快速诊断的双功能试剂,弥补了化学交联法的不足,此后被广泛应用于双功能试剂的制备[12-14]。
由于目前对猪红细胞表面抗原的种类及分布情况仍不十分清楚,因此本研究拟借助表面抗原背景清楚的人红细胞作为指示剂,利用基因工程的方法将抗人红细胞表面H抗原的单链抗体CSFV E2主要抗原区融合,构建一种既能够与人红细胞结合、又能够与CSFV抗体反应的双功能融合蛋白,建立红细胞凝集试验,用于猪瘟抗体的快速检测。
近年来由于采用了分子内伴侣技术 (如 Trx和DsbA等) 使得许多功能基因能在 E. coli中正确折叠,就连结构复杂的 tPA等也获得了正确折叠的重组可溶性活性蛋白[15]。因此本研究选取 pET-DsbA表达载体,期望能够获得可溶的有活性的目的蛋白。然而试验并未达到预期的效果,融合蛋白表达大部分是以不溶的包涵体形式存在。究其原因可能有二:其一,pET-DsbA载体并不适用于所有蛋白的可溶性表达;其二,本研究还未筛选到适合融合蛋白可溶性表达的最佳条件,有待进一步研究。
融合蛋白以包涵体形式表达,虽然给后续工作带来一定的困难,必须对表达产物进行复性来恢复其生物学功能。但也有其优点:可以避免菌体蛋白酶对外源蛋白的降解;降低了胞内外源蛋白的浓度,有利于表达量的提高;包涵体对超声破碎和机械搅拌不敏感,易于破壁并与细胞膜碎片分离;包涵体中杂蛋白含量较低,通过离心就可以和可溶性蛋白分离,有利于分离纯化[16]。
通过Western blotting与红细胞凝集试验已经证实,本研究构建的2E8mE2融合蛋白具有既与人红细胞结合又与CSFV抗体反应的双功能性,为下一步建立猪瘟抗体的快速检测的红细胞凝集试验打下了基础。此外,在红细胞凝集试验中出现凝集现象的时间较长,与人血型检测的速度仍有一段距离,估计与2E8mE2融合蛋白活性不高有关,这是否与本研究在构建双功能融合蛋白时,是将两个功能区直接拼接,使得功能结构域之间的相互遮掩而导致融合蛋白的活力下降有关?为此,将尽快开展下一步研究,在2E8ScFv与mE2免疫原性肽段之间连接一段 CHI片段 (来源于 2E8株单抗轻链恒定区序列),以克服空间障碍,使与抗原肽紧密相连的单链抗体不再阻碍结合到红细胞表面的双功能融合蛋白与血清中相应抗体之间的有效结合。
[1] Kemp BE, Rylatt DB, Bundesen PG, et al. Autologous red cell agglutination assay for HIV-l antibodies: simplified test with whole blood. Science, 1988, 241(4871): 1352−1354.
[2] Niu JZ, Liao XR, Yu QL, et al. Application of rapid whole-blood agglutination assay (RWBA) in detection of HBsAg in different populations of China. J Hebei Univ (Natl Sci Edi), 2002, 22(4): 366−369.
[3] Gupta A, Chaudhary VK. Whole-blood agglutination assay for onsite detection of human immunodeficiency virus infection. J Clin Microbiol, 2003, 41(7): 2814−2817.
[4] Siedenr M, Zapirz V, Ishida M, et al. Performance of rapid syphilis tests in venous and fingerstick whole blood specimens. Sex Transm Dis, 2004, 31(9): 557−560.
[5] Nie J, Zhao HL, Tan XH, et al. Detection of antibodies against Hantaan virus in patients’ blood by autologous red cell agglutination assay. Chin J Zoonoses, 2003, 19(6): 66−68.聂晶, 赵洪礼, 谭笑红, 等. 用自身红细胞凝集试验检测肾综合征出血热病人全血中病毒特异性抗体. 中国人兽共患病杂志, 2003, 19(6): 66−68.
[6] Meng WX, Wang RT, Zhang YF, et al. Preparation of bispecific monoclonal antibody against HIV p24 and human group A erythrocytes. Chin J Cell Mol Immunol, 2004, 20(5): 582−584.孟文霞, 王润田, 张玉芬, 等. 抗HIV p24和人A型红细胞双特异性单克隆抗体的研制. 细胞与分子免疫学杂志, 2004, 20(5): 582−584.
[7] Hu Y, Yang JY, Zhu L, et al. Expression, purification, and characterization of an antihuman RBC ScFv-HIV gp160 fusion protein for hemagglutination based rapid detection of antibodies to HIV in whole blood. Chin J Exp Clin Virol, 2007, 21(1): 76−78.胡燕, 杨健洋, 朱雷, 等. 抗人红细胞抗体和 HIV抗原融合蛋白的构建及活性鉴定. 中华实验和临床病毒学杂志, 2007, 21(1): 76−78.
[8] Shao CL, Shi LJ, Yao ZX, et al. Cloning and expression of the variable region genes of the monoclonal antibody against H antigen on human erythrocyte. J Immunol, 2008, 24(2): 238−242.邵长利, 史利军, 姚站馨, 等. 抗人红细胞 H抗原单链抗体基因克隆和表达. 免疫学杂志, 2008, 24(2): 238−242.
[9] Yu XL, Tu CC, Xu XR, et al. Site-directed mutagenesis of the major antigen E2 gene of CSFV, its high level expression in Escherichia coli and the immunogenicity of recombinant E2 protein. Chin J Biotech, 2003, 19(4): 439−443.余兴龙, 涂长春, 徐兴然, 等. 猪瘟病毒E2基因的定点突变、在大肠杆菌中的高效表达及表达产物的免疫原性.生物工程学报, 2003, 19(4): 439−443.
[10] Liu BH, Yu XL, Zhang ML, et al. Renaturation and purification of E. coli-expressed CSFV antigenic polypeptide. Chin J Vet Sci, 2003, 23(2): 145−148.刘伯华, 余兴龙, 张茂林, 等. 原核表达的猪瘟病毒E2 蛋白抗原多肽的复性和纯化. 中国兽医学报, 2003, 23(2): 145−148.
[11] Lilley GG, Dolezal O, Hillyard CJ, et al. Recombinant single-chain antibody peptide conjugates expressed in Escherichia coli for the rapid diagnosis of HIV. J Immunol Methods, 1994, 171(2): 211−226.
[12] Dolezal O, Coia G, Guthrie RE, et al. Escherichia coli expression of a bi-functional Fab-peptide epitope reagent for the rapid diagnosis of HIV-1 and HIV-2. Immunotechnology, 1995, 1: 197−209.
[13] Coia G, Hudson PJ, Lilley GG, et al. Construction of recombinant extended single-chain antibody peptide conjugates for use in the diagnosis of HIV-1 and HIV-2. J Immunol Methods, 1996, 192: 13−23.
[14] Gupta A, Gupta S, Chaudhary VK, et al. Recombinant fusion proteins for hemagglutination-based rapid detection of antibodies to HIV in whole blood. J Immunol Methods, 2001, 256: 121−140.
[15] Qiu J, Swartz JR, Georgiou G, et al. Expression of active human tissue-type plasminogen activator in Escherichia coli. Appl Environ Microbiol, 1998, 64(12): 4891−4896.
[16] Skerra A, Pfitzinger I, Pluckthun A, et al. The functional expression of antibody Fv fragments in Escherichia coli: improved vectors and a generally applicable purification technique. Biotechnology, 1991, 9: 273−278.
