不同长度茎部shRNA表达载体构建与鉴定
2010-02-09刘中华乔宪凤肖红卫刘西梅王华岩郑新民
刘中华,乔宪凤,肖红卫,刘西梅,王华岩,郑新民
1 西北农林科技大学动物医学院 陕西省干细胞工程技术研究中心 陕西省农业分子生物学重点实验室,杨凌 712100
2 湖北省农业科学院畜牧兽医研究所 动物胚胎工程及分子育种湖北省重点实验室,武汉 430064
双链RNA (dsRNA) 引起的基因沉默或者RNA干扰 (RNAi) 是一种古老并且进化上保守的序列特异性转录后基因沉默现象,广泛存在于各种动物中[1-2]。目前在哺乳动物细胞中,主要应用两种相关的技术来实现RNAi。一种方法是向哺乳动物细胞直接转染人工合成的长度为19 bp并且 3′末端具有2个突出碱基的小干扰 RNA (siRNA)[3],另一种方法是利用表达质粒或者病毒载体在哺乳动物细胞中表达小发夹RNA (shRNA)[4-8]。前者只能引起短暂的干扰效应,而后者可以获得稳定而持久的基因沉默。
哺乳动物细胞转入的siRNA超过30 bp时即会引起干扰素 (IFN) 效应和激活 RNA依赖的蛋白激酶 (PKR) 通路,从而导致细胞增殖受阻甚至凋亡[9]。自RNA干扰现象发现以来,人们已经对不同长度 (19~29 bp) 的siRNA沉默效应进行了相关研究。早期研究认为茎部长度为21 bp 的发夹结构与细胞内源的MicroRNA 结构最为相近,基因沉默效应也最高。最近却有研究发现,茎部长度为 27 bp或29 bp 时,引发的基因沉默效应可能显著增加,甚至百倍于传统的21 bp 茎环结构[10-11]。本实验以egfp为沉默效应的报告基因,分别构建茎部长度为21 bp、27 bp、29 bp的干扰载体,经纯化后转染小鼠胎儿成纤维细胞 (MEF) 和利用显微注射法注射到小鼠胚胎的原核中,通过检测其沉默效果来筛选出适合小鼠个体水平的最佳发夹结构。
1 材料与方法
1.1 主要仪器和试剂
小分子量 DNA片段高效快速纯化回收试剂盒(Bio Dev公司);B型超纯质粒小样快速提取试剂盒(Bioteke公司);siSTRIKE™ U6 Hairpin Cloning Systems (Promega公司);Taq酶 (Promega公司);PstⅠ内切酶(Fermentas);脂质体 Lipofectamine™2000 (Invitrogen公司);DMEM 培养基(Gibco公司);TRIzol Reagent RNA提取试剂盒 (Invitrogen公司);RealMasterMix (Tiangen公司);SuperscriptⅡ反转录酶 (Invitrogen公司);荧光显微镜 (Olympus);iQ5荧光定量PCR仪 (Biorad公司);冷冻离心机 (Sigma公司)。
1.2 RNAi表达载体构建
1.2.1 寡核苷酸设计合成
根据GenBank数据库提供的pEGFP-C1载体序列(Accession No. 1377914),以其上携带的增强型绿色荧光蛋白基因 (egfp) 为目的基因,利用Promega公司在线设计程序设计茎部长度分别为21 bp、27 bp、29 bp的干扰片段 (其序列及结构见图1和表1),

表1 不同长度茎部的shRNA序列Table 1 shRNA sequences with different length of stem
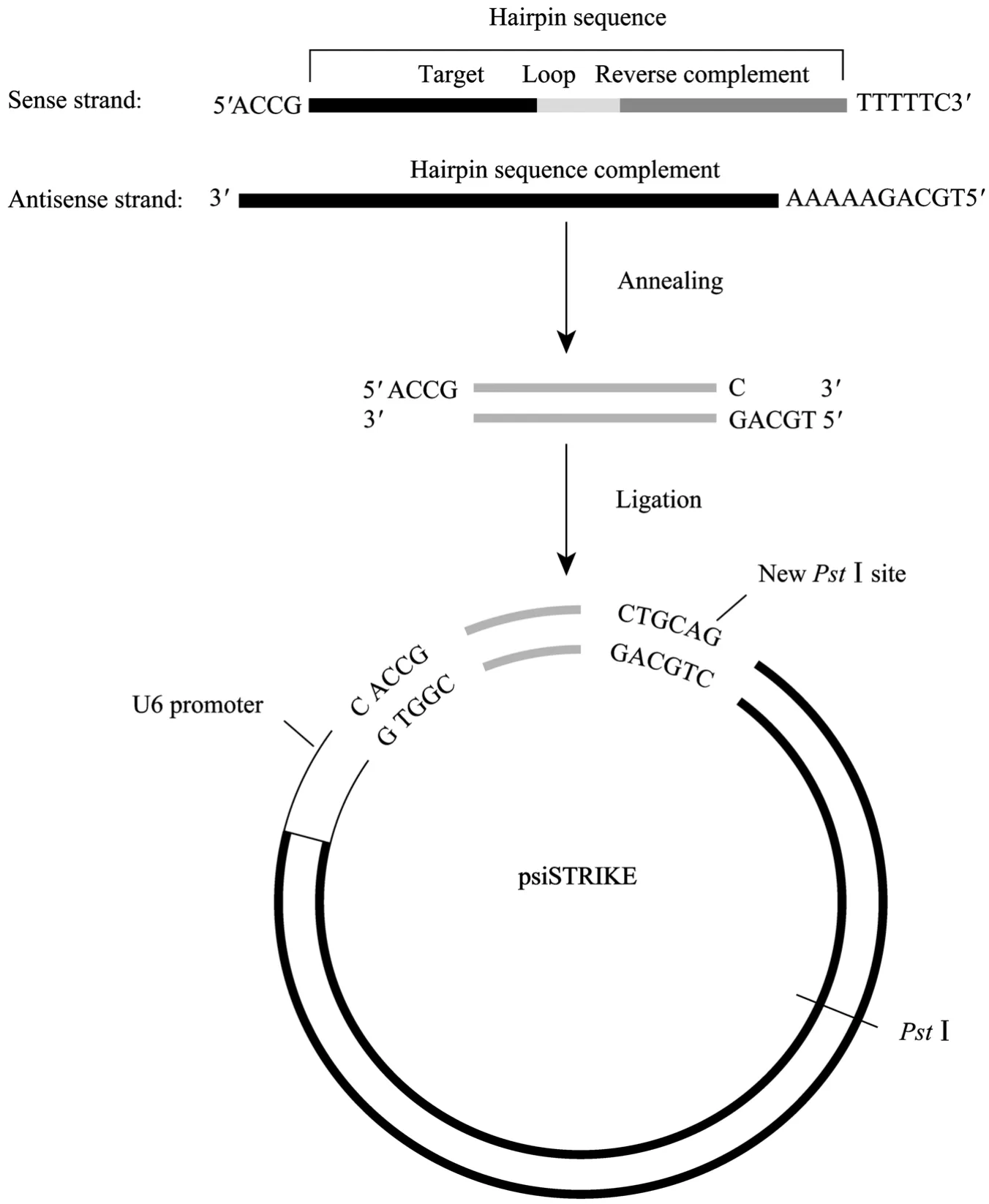
图1 shRNA载体构建Fig. 1 Construction of shRNA vector.
经 BLAST比对证实与小鼠基因组其他序列无同源性。每一长度包括3条干扰片段和1条阴性对照序列,其环部结构均使用9 bp序列 (TTCAA GAGA),送交Invitrogen公司合成。psiSTRIKE载体本身具有单一的PstⅠ酶切位点,设计的干扰片段3′端与其连接后会生成一个新的PstⅠ酶切位点,可以此做酶切鉴定阳性克隆 (图1)。
1.2.2 shRNA表达载体构建
用dd H2O将合成的寡核苷酸 (oligos) 稀释成1 µg/µL。然后进行退火,反应体系 (50 µL):退火Buffer (46 µL)+正义链oligos (2 µL)+反义链oligos (2 µL);退火程序:90 ℃ 3 min,37℃ 15 min。将退火后的核苷酸稀释到4 ng/µL,与psiSTRIKE载体在T4 DNA连接酶作用下过夜连接。产物转化 DH5α感受态细胞,在含氨苄青霉素 (100 µg/µL) 的 LB平板上筛选。次日挑取阳性克隆,在含氨苄青霉素(100 µg/µL) 的LB 液体培养基中250 r/min、37℃振荡培养14~16 h,小量提取质粒,随后PstⅠ酶切4 h,1%琼脂糖电泳鉴定。阳性克隆载体送 Invitrogen测序验证后,B型超纯质粒小样快速提取试剂盒进行回收,用于真核细胞转染和原核显微注射。
1.3 细胞培养与脂质体转染
1.3.1 小鼠胎儿成纤维细胞的分离及培养
转绿色荧光蛋白基因小鼠自然交配,待雌鼠妊娠13.5 d时将其处死。取出胎儿,0.25%胰酶消化取其细胞,高糖DMEM培养基进行培养 (添加10% FBS、1%青链霉素)。然后对其进行传代纯化、细胞计数、冻存等操作。在倒置荧光显微镜下观察荧光表达情况,并照相。
1.3.2 细胞转染
24孔转染法,按Lipofectamine 2000说明书操作。待细胞生长至 60%~70%汇合度时进行转染,每孔添加0.4 µg环状shRNA表达质粒和2 µL脂质体。分别于转染后24 h、48 h、72 h在荧光显微镜下观察沉默效应。
1.3.3 稳定细胞株的获得
转染48 h后更换含G 418 (500 µg/mL) 的完全培养基进行稳定细胞株的筛选,之后每3天更换培养液。大约15 d抗性细胞集落形成,此时用含半量筛选浓度 (250 µg/mL) 的G 418完全培养基扩大培养。
1.4 荧光定量PCR检测干扰效果
1.4.1 细胞总RNA的提取及反转录
分别于转染24 h、48 h、72 h收集24孔板培养的细胞,参照TRIzol Reagent RNA提取试剂盒使用说明书进行细胞总 RNA的提取。紫外分光光度计测定RNA的浓度及纯度。取4 µg总RNA、1 µL Oligo (dT)12-18、1 µL dNTPs (10 mmol/L)、RNase-free ddH2O定容至12 µL,混合后65℃温浴5 min,置冰上冷却 2 min,简短离心后依次加入 4 µL 5×First-Strand Buffer、2 µL 0.1 mol/L DTT、1 µL RNasin,混匀,42℃温浴2 min。加入1 µL SuperScript II 反转录酶,混匀后42℃温浴50 min,70 ℃ 15 min 终止反应。反转录产物于−20℃保存或立即进行PCR。
1.4.2 引物和探针设计及合成
利用Primer Express软件,分别针对pEGFP-C1载体上的 egfp和小鼠的 gapdh (Accession No. 126012538) 基因设计用于荧光定量 PCR的引物及探针 (表2),送交Invitrogen公司合成。
1.4.3 荧光定量PCR反应
从空白组、EGFP-21 siRNA组、EGFP-27 siRNA组、EGFP-29 siRNA组、阴性对照组的cDNA中各取1 µL作为模板,参照说明书配制25 µL反应体系:10 µL 2.5×RealMasterMix,gapdh和egfp上游引物及下游引物各 1 µL,探针各 0.5 µL,1.25 µL 20×probe,7.75 µL ddH2O。反应在Biorad公司iQ5荧光定量PCR仪上进行,扩增条件如下:95 ℃ 2 min,95℃ 20 s,57℃ 20 s,68℃ 30 s,共40个循环。待获得各样品的Ct值后,使用2−△△Ct法[12]分析结果。
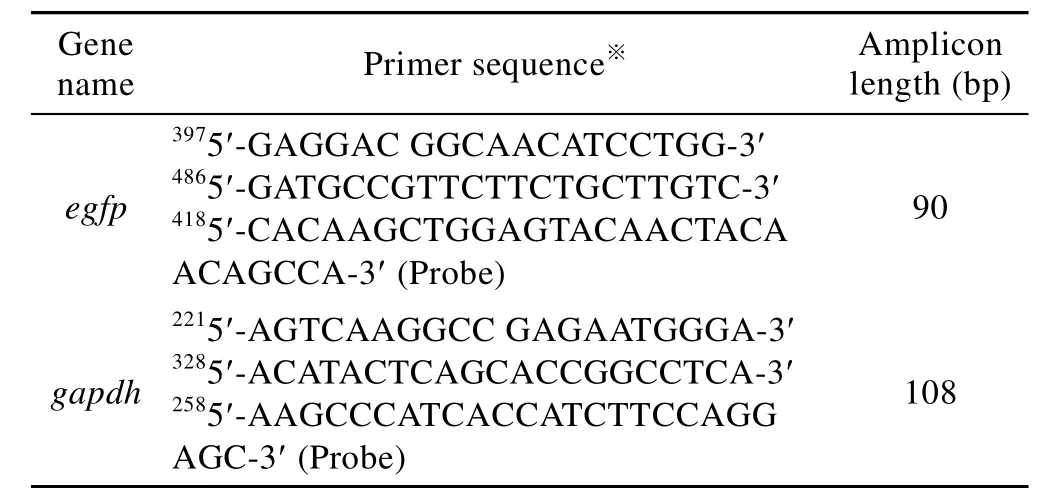
表2 用于荧光定量PCR分析的引物及探针序列Table 2 Primer and probe sequences used for real-time PCR analysis
2 结果
2.1 重组质粒酶切鉴定
提取的质粒DNA用PstⅠ酶切,阳性质粒将被酶切成2个片段,长度分别为3655 bp和962~970 bp (因茎部长度而异),其酶切片段电泳结果如下 (图2) 所示。
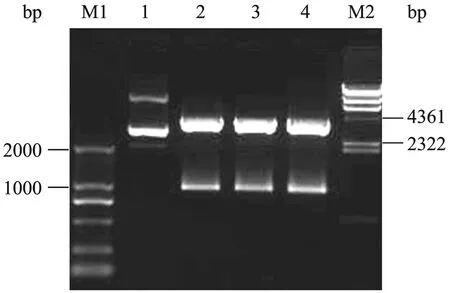
图2 重组质粒PstⅠ酶切Fig. 2 Recombinant plasmid digested with PstⅠ . M1: DL 2000 marker; 1: positive control; 2–4: positive plasimid; M2: Hind Ⅲ marker.
2.2 重组质粒的测序验证
酶切鉴定呈阳性的重组质粒送上海英骏生物技术公司测序验证。ClustalX软件将测序结果与设计的序列进行比对,所含目的基因序列准确无误,证明已获得所需的重组质粒。
2.3 转染细胞的显微镜观察
转绿色荧光蛋白小鼠胎儿成纤维细胞均贴壁生长,大多呈梭形或多角形;荧光显微镜下观察,细胞发出强烈的绿色荧光 (图3 A、B)。shRNA表达质粒转染细胞24 h后出现荧光减弱现象,48 h沉默效应达到最大。加入G 418筛选,细胞于第3 天开始大量死亡,15 d左右出现单细胞克隆,然后分化成生长期细胞群。筛选7 d时给细胞照相,转不同茎部长度 (21 bp、27 bp、29 bp) shRNA表达质粒的细胞均出现沉默现象 (图3 C、D、E、F、G、H),箭头所示细胞在白光下可见,在紫外光下发出微弱荧光或者不可见,阴性对照组没有发现相应效应(图3 I、J)。
2.4 荧光定量PCR结果分析
利用 TaqMan探针法对转染不同茎部长度干扰载体的细胞cDNA进行荧光定量PCR检测。每组设3个重复,取其平均值,利用 2−△△Ct对其数据进行分析 (表3)。从表3可以看出,茎部长度为21 bp、27 bp和29 bp的shRNA表达载体分别使得绿色荧光蛋白基因的表达量降低了55%、60%和78%,以茎部长度29 bp的干扰载体沉默效果最好;不同茎部长度的干扰载体使得目的基因出现最大沉默效应的时间也不同,21 bp、27 bp或29 bp分别是在转染后24 h和48 h。
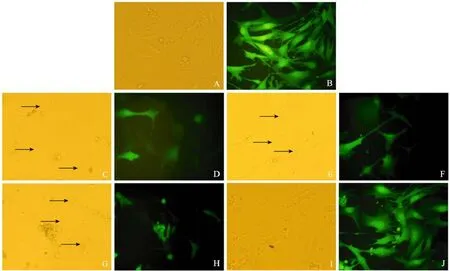
图3 小鼠胎儿成纤维细胞的显微镜观察Fig. 3 Microscopy of mouse fibroblast.(A, B) MEF separately exposed under light and UV. (C, D) MEF transfected by EGFP-21 siRNA separately exposed under light and UV. (E, F) MEF transfected by EGFP-27 siRNA separately exposed under light and UV. (G, H) MEF transfected by EGFP-29 siRNA separately exposed under light and UV. (I, J) MEF transfected by scramble sequence separately exposed under light and UV.
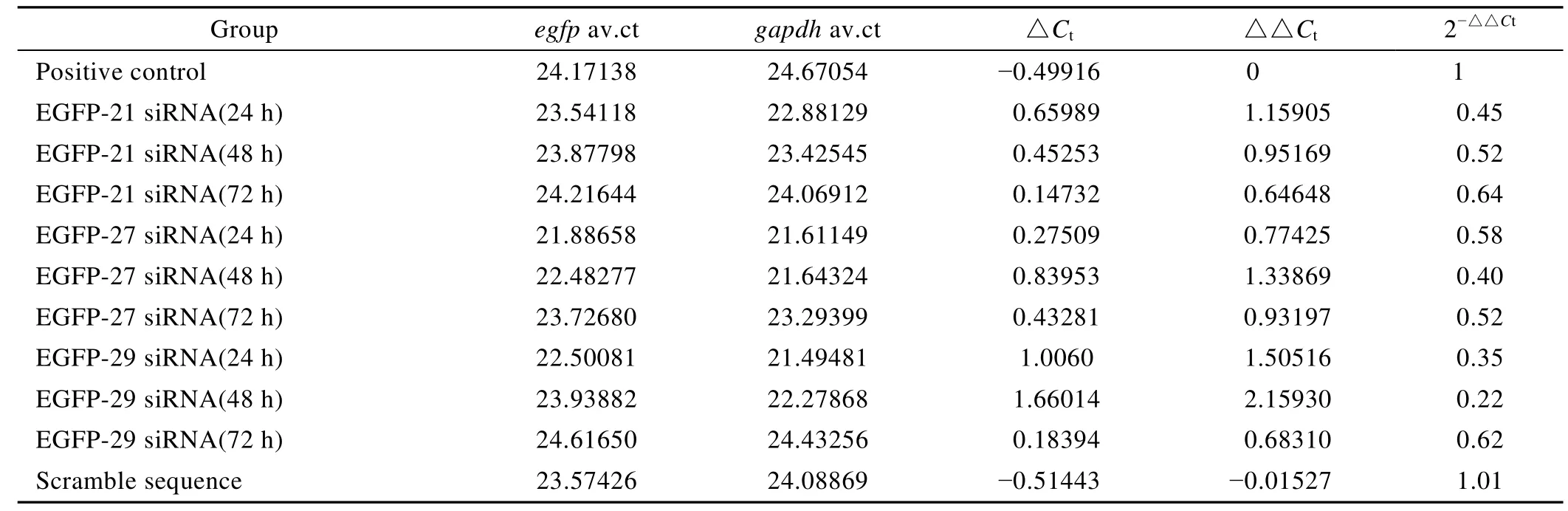
表3 2−△△Ct法分析的干扰结果Table 3 Result analysed by 2−△△Ct method
3 讨论
质粒 DNA的拓扑学结构对其转染效率影响很大。Andrea等[13]分别用表达半乳糖苷酶的线性化和环化质粒转染Vero细胞,结果发现前者与脂质体形成的复合物转化效率明显低于后者,究其原因在于线性化和环化 DNA与脂质体形成的复合物空间结构不同。李作生等[14]利用不同拓扑学结构的质粒,分别转化E. coli感受态细胞、转染SK 6-6细胞和免疫小鼠,结果表明转化原核细胞和转染真核细胞时,环化质粒是线性化质粒效率的几十倍,超螺旋比例高的基因疫苗免疫效果明显好于开环质粒的基因疫苗。为了获得最大的转染效率,本实验中用于转染细胞的沉默载体均未线性化。
2002年,Hasuwa等[6]首先利用显微注射法将茎部长度为21 bp的shRNA干扰载体导入转绿色荧光蛋白小鼠的雄原核中,成功获得了 RNAi小鼠,证明 RNA 干扰技术用于转基因动物研究的可行性。虽然研究者针对不同目的基因,利用不同方法来研究沉默效应,但至今仍未见报道利用转绿色荧光蛋白小鼠成体细胞来研究干扰效应的文章。本实验中,转染细胞的显微镜观察和实时荧光定量PCR分析结果显示,虽然不同茎部长度的shRNA载体转染MEF后均发生了绿色荧光蛋白沉默现象,但是其抑制基因表达的程度有所不同:21 bp和27 bp茎部长度的干扰效应相差不大,29 bp茎部长度的干扰效应明显优于二者。Kim等[10]研究发现 27 bp的 siRNA可作为Dicer底物进入RNAi途径,在很低的浓度下 (50~200 pmol) 效果比21 bp的siRNA更好,持续时间更长。同年,Siolas等[11]报道体外合成的29 bp shRNA可被Dicer切割成22 bp的小片段RNAs,能引起更加强烈的RNA干扰效应。本实验将设计的不同茎部长度 shRNA基因序列克隆进入真核表达载体,以期获得更加稳定、长期的基因沉默效应。此次实验的初步结果与 Siolas等的研究相一致,但却并没有获得27 bp较21 bp shRNA具有明显干扰效应的数据。这可能与干扰载体的用量有关,因为不同茎部长度的 siRNA产生最佳沉默效应的浓度不同[10];也有可能跟目的基因本身序列结构有关。真正原因仍需进一步实验探明。
另外作者在分析了实验数据后发现不同茎部长度的干扰载体虽然都使得目的基因出现了沉默,但达到最大效应的时间有所不同。Kim等[10]利用体外合成的长度分别为21 bp和27 bp的dsRNA转染细胞,结果二者均在转染后的第4天达到最大沉默效应。最佳沉默效应发生在时间上的差异,可能与siRNA的导入形式以及转染细胞系的不同有关。
为了进一步验证干扰效应,利用原核显微注射法将制备的干扰质粒注射到小鼠受精卵雄原核中。胚胎体外培养到两细胞期,可见明显的干扰效应,但并未进一步发育。显微注射外源DNA本身会对胚胎发育有一定影响,而且DNA浓度过高对胚胎也有毒害作用[15]。Hasuwa等[6]利用显微注射法将干扰载体导入小鼠原核并体外培养到桑椹胚,说明显微操作熟练程度可能是导致培养的胚胎发育受阻的主要原因。
虽然人们普遍认为向哺乳动物细胞导入 siRNA (<30 bp) 长度过短时不会引起干扰素效应,但有研究表明向哺乳动物细胞转入小片段siRNA或者构建的 shRNA载体一样可以引发干扰素效应[16-17]。当siRNA片段数量足够大时,还可与核胞质转运蛋白exportin-5结合从而饱和其通路,影响内源性miRNAs的作用[18]。因此,siRNA除了使目的基因沉默外,还存在一个错综复杂的负效应网络,有待深入研究。
REFERENCES
[1] Dorsett Y, Tuschl T. siRNAs: applications in functional genomics and potential as therapeutics. Nat Rev Drug Discov, 2004, 3: 318–329.
[2] Mittal V. Improving the efficiency of RNA interference in mammals. Nat Rev Genet, 2004, 5: 355–365.
[3] Elbashir SM, Harborth J, Lendeckel W, et al. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature, 2001, 411: 494–498.
[4] Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science, 2002, 296: 550–553.
[5] Miyagishi M, Taira K. U6 promoter-driven siRNAs with four uridine 3' overhangs efficiently suppress targeted gene expression in mammalian cells. Nat Biotechnol, 2002, 20: 497–500.
[6] Hasuwaa H, Kaseda K, Einarsdottir T, et al. Small interfering RNA and gene silencing in transgenic mice and rats. FEBS Lett, 2002, 532: 227–230.
[7] Yu JY, DeRuiter SL, Turner DL. RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc Natl Acad Sci USA, 2002, 30: 6047–6052.
[8] Sui GC, Soohoo C, Affar EB, et al. A DNA vector-based RNAi technology to suppress gene expression in mammalian cells. Proc Natl Acad Sci USA, 2002, 16: 5515–5520.
[9] Persengiev SP, Zhu XC, Green MR. Nonspecific, concentration-dependent stimulation and repression of mammalian gene expression by small interfering RNAs (siRNAs). RNA, 2004, 10: 12–18.
[10] Kim DH, Behlke MA, Rose SD, et al. Synthetic dsRNA dicer substrates enhance RNAi potency and efficacy. Nat Biotechnol, 2005, 23: 222–226.
[11] Siolas D, LernerC, Burchard J, et al. Synthetic shRNAs as potent RNAi triggers. Nat Biotechnol, 2005, 23: 227–231.
[12] Kenneth JL, Thomas DS. Analysis of relative gene expression data using real-time quantitative PCR and the 2–△△Ctmethod. Methods, 2001, 25: 402–408.
[13] Andrea VG, Yan L, Marcia CB, et al. Linear DNA low efficiency transfection by liposome can be improved by the use of cationic lipid as charge neutralizer. Biotechnol Prog, 2006, 22(4): 1220–1224.
[14] Li ZS, Yu XL, Zhang ML, et al. Effect of plasmid DNA
toplogy on biologic property of DNA vaccine. Chin J Vet Sci, 2004, 24(3): 250–251.
李作生, 余兴龙, 张茂林, 等. 质粒DNA拓扑学结构对基因疫苗生物学特性的影响. 中国兽医学报, 2004, 24(3): 250–251.
[15] Williams BL, Boone BP. In vitro development of zygotes from prepubertal gilts after microinjection of DNA. J Anim Sci, 1992, 70: 2207–2211.
[16] Carol AS, Michelle H, Michael J, et al. Activation of the interferon system by short-interfering RNAs. Nature Cell Biology, 2003, 5(9): 834–839.
[17] Alan JB, Stephanie P, Annick D. Induction of an interferon response by RNAi vectors in mammalian cells. Nat Genet, 2003, 34(3): 263–264.
[18] Dirk G, Konrad LS, Catherine LJ, et al. Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways. Nature, 2006, 441(25): 537–541.
