重组猪乳铁蛋白N端的高效表达及抑菌活性检测
2010-02-09哈卓赵丽丽于晓旭宗晓淋毛雅元张健李一经葛俊伟乔薪瑗唐丽杰
哈卓,赵丽丽,于晓旭,宗晓淋,毛雅元,张健,李一经,葛俊伟,乔薪瑗,唐丽杰
1 东北农业大学动物医学学院,哈尔滨 150030
2 东北农业大学资源与环境学院,哈尔滨 150030
3 东北农业大学生命科学学院,哈尔滨 150030
乳铁蛋白 (Lactoferrin,LF) 是一种天然活性铁离子结合糖蛋白,分子量约为80 kDa,广泛存在于动物的乳汁 (初乳)、血液、唾液、小肠液等外分泌液或血浆、中性粒细胞中[1-3]。乳铁蛋白是一种具有多种生物学功能的蛋白质,它不仅参与铁的转运,而且具有抗微生物、调节免疫系统等功能[4-7]。LF对细菌生长的抑制作用被认为是清除介质中的铁,由于细菌需要铁离子以维持生长,因此乳铁蛋白在结合铁离子的同时起到了抑制需铁细菌的生长,进而导致病原菌死亡[8]。在一个乳铁蛋白分子中含有2个铁结合位点,它包括2个结构相似的叶片状结构,分别被命名为N-叶和C-叶,2个叶片被一条短肽链连接[9]。乳铁蛋白肽是乳铁蛋白在酸性环境条件下经胃蛋白酶水解的一段小肽,位于乳铁蛋白的N-叶,它具有比乳铁蛋白更强的抗菌活性[10-11],许多研究表明,乳铁蛋白的生物学性都与N-叶密切相关[12]。
本研究利用 RT-PCR方法,从猪的乳腺组织中扩增出猪乳铁蛋白N-叶基因,以此为参考模板,重新优化设计并合成了猪乳铁蛋白N-叶片段,插入到原核表达载体 pET-30b中,得到高效表达,并进行了包涵体的裂解、纯化和复性,得到了具有抑菌活性的重组猪乳铁蛋白,为进一步研究其抗病毒和免疫调节功能提供了物质基础。
1 材料与方法
1.1 质粒、菌种及主要试剂
表达载体质粒 pET-30b和大肠杆菌 JM109及BL21(DE3) 均由本实验室保存。金黄色葡萄球菌Staphylococcus aureas CVCC25923株和大肠杆菌Escherichia coli CVCC10141株购于中国兽医药品监察所,益生菌干酪乳杆菌ATCC393株由荷兰NIZO研究所惠赠。
小量DNA胶回收试剂盒、质粒抽提试剂盒购自上海华舜生物工程有限公司。限制性内切酶及pMD18-T载体购自TaKaRa公司。T4 DNA连接酶购自NEB公司。针对His标签的单克隆抗体和HRP标记的羊抗鼠IgG购自Sigma公司。
1.2 猪乳铁蛋白基因的扩增和基因优化
1.2.1 引物设计
根据GenBank登录的猪乳铁蛋白基因序列,在其可读框两侧设计一对引物,上游引物P1:5′-GGATCC AATGAAGCTCTTCATCCC-3′和下游引物P2:5′-CTCGAGCTTCGCCTGCCGCGC-3′分别含有BamH I酶切位点、Xho I酶切位点 (下划线标示),由上海生物工程有限公司合成。
1.2.2 猪乳铁蛋白RNA的提取与基因扩增
取泌乳 3 d的长白猪乳腺组织在液氮中研磨成粉末,按照每50~100 mg组织加入1 mL Trizol液裂解乳腺组织细胞,以氯仿、异丙醇抽提乳腺组织中的总RNA,在以P1为引物进行逆转录后,再以P1和P2为引物通过PCR方法扩增出1077 bp的PLF-N基因片段。将其经胶回收纯化,与 pMD18-T载体连接,转化JM109感受态细胞,经质粒提取后进行酶切及 PCR鉴定,获得阳性重组质粒,命名为pMD-PLF-N,送上海生物工程有限公司进行测序鉴定。
1.2.3 基因的优化设计与合成
以1.2.2中应用RT-PCR方法扩增的PLF-N基因为参照序列,利用在线软件,将序列中的稀有密码子改为大肠杆菌优势密码子,优化了密码子适应性指数,根据已报道文献,将密码子改为利于大肠杆菌表达的密码子[13],重新设计并合成了优化后的猪乳铁蛋白PLF-NS基因。
1.3 表达猪乳铁蛋白PLF-NS基因和PLF-N基因重组菌的构建
将PLF-NS基因、PLF-N基因和原核表达载体pET-30b 质粒,分别经BamH I和Xho I双酶切后,胶回收纯化试剂盒回收目的基因,经T4 DNA连接酶连接,转化E. coli BL21(DE3)感受态细胞。挑取单个菌落提取质粒,经酶切、PCR鉴定后,获得含有阳性重组质粒的菌株,分别命名为 pET-PLF-NS/ BL21(DE3) 和pET-PLF-N/BL21(DE3)。
1.4 基因表达条件的优化和表达产物的鉴定
1.4.1 表达条件的选择及优化前后表达量的比较
为了获得重组蛋白的最佳表达量,取少量重组菌种 pET-PLF-NS/BL21(DE3)过夜培养,按 1∶100比例接种于100 mL含氨苄青霉素100 mg/L LB培养基中,培养至OD600在0.4~0.6之间时,分别于28℃、32℃、37℃条件下以0.4 mmol/L的IPTG进行诱导,在诱导后的6 h内,每隔1 h取样进行SDS-PAGE分析,确定最佳表达条件,用BandScan软件分析重组蛋白表达量,并在相同条件下对未优化的重组菌pET-PLF-N/BL21(DE3) 诱导表达,比较优化前后重组蛋白表达量的变化。
1.4.2 融合蛋白的表达形式分析及Western blotting鉴定
诱导后菌液经超声波破碎后,在4℃下,10 000×g离心10 min,上清和沉淀同时进行SDS-PAGE分析。同时将诱导前和诱导后的重组蛋白经SDS-PAGE电泳后转印到硝酸纤维素膜上,以针对 His标签的单克隆抗体为一抗,HRP标记的山羊抗鼠IgG为二抗,进行Western blotting分析确定蛋白的表达。
1.5 重组蛋白表达产物的纯化及复性
收集诱导后的表达菌体,重悬于PBS (pH 7.4)缓冲液中,加入溶菌酶,37℃作用30 min后,置冰浴中超声裂解,功率300 W,3 s/次,间隔时间3 s,至不再粘稠。4℃、10 000×g离心10 min,用溶液I (0.01 mol/L Tris,0.1 mol/L NaCl,2 mol/L尿素)重悬沉淀,8 000×g离心10 min,再加入溶液II (0.01 mol/L Tris-HCl,0.1 mol/L NaCl,4 mol/L尿素)重悬沉淀,8 000×g离心10 min,收集上清液,得到初步纯化的包涵体,−20℃保存备用。
将上述包涵体溶解到裂解液中 (0.01 mol/L Tris-HCl,0.1 mol/L NaCl,8 mol/L 尿素)。4℃下磁力搅拌器溶解过夜。采用亲和层析法纯化表达蛋白,参照 Qiagen公司镍离子亲和层析柱 (Ni2+NTA) 操作说明进行,在洗脱液中加入 0.1% Triton-100和10%丙三醇加以改进。
将纯化后的蛋白进行尿素梯度透析复性,依次在含有6、5、4、3、2.5、2、1.5、1.0、0.5和0 mol/L尿素的50 mmol/L Tris-HCl缓冲液 (含有20 mmol/L巯基乙醇,0.3 mol/L NaCl,10%丙三醇,pH 9.0) 中透析各4 h (4℃),将裂解液中的尿素替换出来。通过SDS-PAGE及BandScan软件检测纯化后的样品纯度。
1.6 重组蛋白的抑菌活性检测
重组蛋白的抑菌活性检测采用琼脂孔穴扩散抑菌圈法[14],将金黄色葡萄球菌、大肠杆菌接种到5 mL LB中,37℃摇床培养至对数生长期。乳杆菌接种于5 mL MRS培养基中,37℃静止培养至对数生长期。取10 µL细菌培养液加入到1 mL的培养基中混匀,涂于琼脂平板,待菌液稍干后,放置牛津杯,加入200 µL复性超滤浓缩的1 g/L重组蛋白,对照采用最后一次透析液,拍照观察并测定清晰的抑菌圈直径。
取灭菌的干净试管10支,分成两组,每组5支,编号 1~5,然后将金黄色葡萄球菌和大肠杆菌培养至对数生长期,再将其稀释至105/mL,每支试管中加入0.5 mL。再向第一支试管中加入0.5 mL超滤浓缩的重组蛋白,混匀后取 0.5 mL加入到第二支试管中,同样的方法一直稀释到第五支试管中,1~5管中重组蛋白的浓度分别 2.0、1.0、0.5、0.25、0.125 g/L,37℃作用18 h,观察细菌生长状况,确定MIC值[15]。
2 结果
2.1 重组质粒pMD-PLF-N的鉴定
重组质粒pMD-PLF-N用BamH I或Xho I单酶切后得到大小约为3.6 kb的基因片段,用BamH I和Xho I双酶切后得到大小约为1.0 kb和2.6 kb基因片段,以P1/P2为引物进行PCR扩增,得到约为1.0 kb基因片段,与预计大小相符合。表明 PLF-N基因片段插入到克隆载体pMD18-T中。
测序结果表明获得大小为1.0 kb的PLF-N基因与预期相符,通过与GenBank上已发表的序列相比对,结果表明本研究获得的长白猪 PLF-N基因与GenBank序列AY306198.1、M81327.1、L77887.1及M92089.1的核苷酸同源性分别达99.16%、99.07%、99.63%和99.35%,可见PLF-N基因在核苷酸序列上高度保守。
2.2 基因优化
将序列中的稀有密码子换成有利于大肠杆菌表达的优势密码子,使全基因的密码子适应性指数由原来的0.2提高到0.5,优化后的基因序列和对应的氨基酸序列如图1。
2.3 重组表达载体的鉴定
挑取单菌落过夜培养,提取质粒经 BamH I和Xho I单、双酶切和PCR鉴定均表明与预期大小的核酸片段相一致。将鉴定正确的阳性质粒转化到表达菌 BL21(DE3) 中,获得重组菌株 pET-PLF-NS/ BL21(DE3) 和pET-PLF-N/BL21(DE3)。
2.4 蛋白的诱导表达
对重组菌的最佳表达条件研究,结果表明基因优化后的重组菌在28℃诱导3 h表达量最大,相对分子质量约为42 kDa (图2),经薄层扫描分析表明目的蛋白表达量可占菌体总蛋白的32%。而野生型重组菌蛋白表达量较低,表明通过基因优化明显提高了重组蛋白的表达量。

图1 优化后的基因序列和对应的氨基酸序列Fig. 1 Optimized gene sequence and its deduced amino acid sequence.
2.5 重组蛋白表达产物的Western blotting鉴定
由于 pET-30b为表达载体所表达的融合蛋白带His标签,以针对 His标签的单克隆抗体为一抗和HRP标记的山羊抗鼠 IgG为二抗,进行 Western blotting分析在42 kDa位置出现了特异的反应带,说明目的蛋白得到了表达 (图3)。
2.6 重组蛋白的纯化与复性
通过SDS-PAGE分析,上清液中未检测到目的蛋白,发现目的蛋白存在于沉淀中,说明该目的蛋白以包涵体形式存在。经包涵体提取、镍离子亲和层析柱纯化变性的融合蛋白,得到了纯化后的重组蛋白 (图4)。经BandScan软件分析,蛋白的纯度达到98%以上。
2.7 重组PLF-NS蛋白的抑菌活性检测
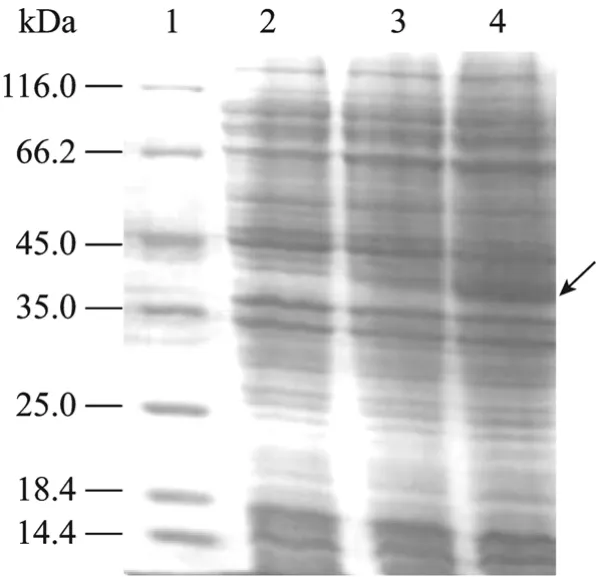
图2 重组菌诱导表达的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of induced recombinant strain.1: protein molecular weight marker; 2: non-induced expression of pET-PLF in E. coli BL21(DE3); 3: expression of wild-type gene in E. coli BL21(DE3) induced for 3 h; 4: expression of optimized gene in E. coli BL21(DE3) induced for 3 h.
抑菌试验表明,重组蛋白对金黄色葡萄球菌有明显的抑菌作用,对大肠杆菌的抑菌作用较弱,而对益生菌干酪乳杆菌没有观察到抑菌作用 (图 5)。金黄色葡萄球菌和大肠杆菌的抑菌圈直径分别为13 mm和6 mm。对金黄色葡萄球菌的最小抑菌浓度为1.0 g/L,对大肠杆菌的最小抑菌浓度大于2.0 g/L。
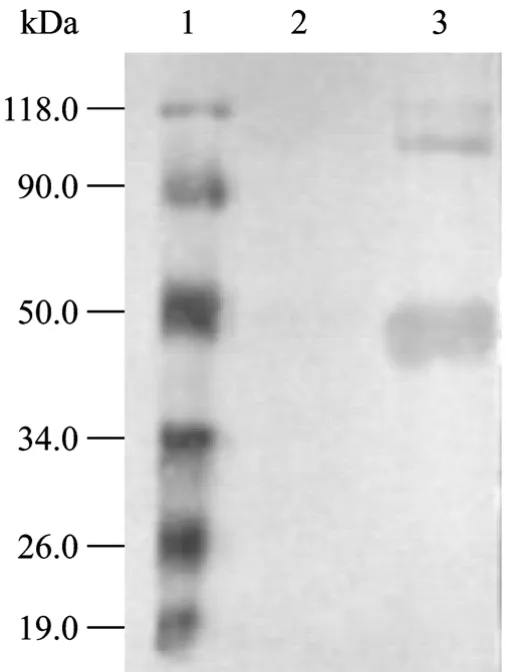
图3 重组蛋白的Western blotting分析Fig. 3 Western blotting analysis of recombinant protein PLF-NS. 1: protein molecular weight marker; 2: non-induced expression of pET-PLF-NS in E. coli BL21(DE3); 3: induced expression of pET-PLF-NS in E. coli BL21(DE3).
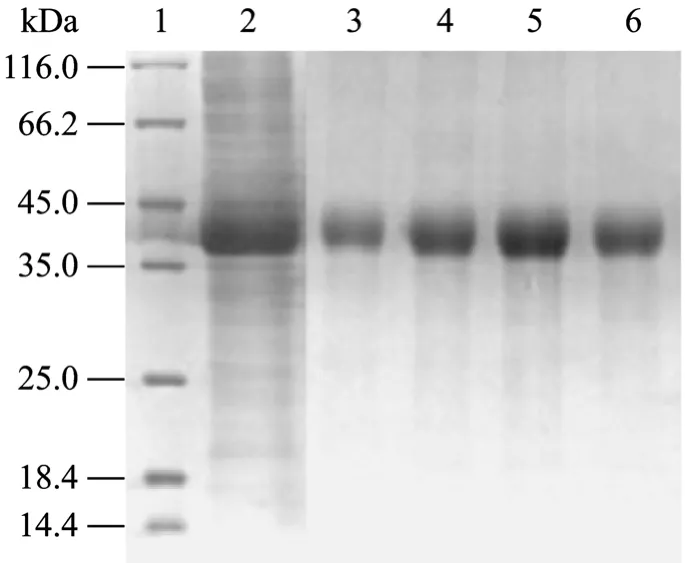
图4 包涵体和纯化蛋白的SDS-PAGE分析Fig. 4 SDS-PAGE analysis of the inclusion and purified fusion protein. 1: protein molecular weight marker; 2: inclusion body of recombinant strain pET-PLF-NS/BL21(DE3); 3−6: purified fusion protein of inclusion body from recombinant strain pET-PLF-NS/BL21(DE3).

图5 重组PLF-NS蛋白对金黄色葡萄球菌、大肠杆菌和益生菌干酪乳杆菌的抑菌活性Fig. 5 Antimicrobial activities of recombinant PLF-NS to S. aureas CVCC25923, E. coli CVCC10141 and L. casei ATCC393. 1, 4, 6: control assay; 2: S. aureas CVCC25923; 3: E. coli CVCC10141; 5: L. casei ATCC393.
3 讨论
由于传统的乳铁蛋白分离从初乳中进行提取纯化工艺繁琐、价格昂贵,利用基因工程方法生产乳铁蛋白显得尤为重要。大肠杆菌表达系统是基因表达技术中发展最早,目前应用最广泛的经典表达系统,具有遗传背景清楚、目的基因表达水平高、培养周期短、抗污染能力强等特点[16]。但利用大肠杆菌表达系统进行表达时,往往会遇到外源蛋白的低表达或不表达[17],在进行本研究时就遇到了蛋白表达水平低的问题,所以为了得到高水平表达的蛋白进行了基因的优化,主要对密码子的偏爱性、密码子适应指数、串联密码子对进行了分析,在保证氨基酸不变的情况下,利用在线软件对基因进行改进,和未改进前相比明显提高了蛋白的表达量。结果证明通过基因优化的方式对表达量低或不表达的基因进行改造使之高效表达是一种提高表达效率的有效手段。
pET系统是现今原核表达方面使用最广泛的系统,本实验所选用的pET-30b载体受强噬菌体T7转录及翻译信号控制,表达由宿主细胞提供的T7 RNA聚合酶诱导,充分诱导时,几乎所有的细胞资源都用于表达目的蛋白[18]。载体中含有 His标签,可以用亲和层析方法纯化融合蛋白。通过对表达条件的优化,表达蛋白可达到全菌体的32%。由SDS-PAGE和Western blotting分析,特异性条带所处的位置分子量大约为 42 kDa,与理论计算的分子量相一致,直接证明了PLF-N可读框的完整性。在生产中考虑到蛋白酶的价格昂贵,本实验使用 pET-30b载体,由于融合标签小,表达产物经纯化复性后无需进行标签的切除,就可以得到具有生物学活性的猪乳铁蛋白。
在纯化过程中出现了蛋白的聚集,严重影响了纯化效率,后经过加入 0.1% Triton-100和10%丙三醇避免了蛋白的聚集,大大提高了纯化效率。采用尿素梯度透析的复性方法,由于蛋白的浓度和复性液的pH值对蛋白复性的好坏起着决定性的影响,当蛋白浓度过高时几乎所有的蛋白都发生了聚集,复性缓冲液的pH值必须在7.0以上,这样可以防止自由硫醇的质子化作用影响正确配对的二硫键的形成,过高或过低会降低复性效率[19],所以本研究尝试了不同的初始蛋白浓度和不同的pH值,最后确定蛋白浓度为0.1~0.2 mol/L,pH值为9.0时,蛋白得率最高。
体外抑菌试验发现猪乳铁蛋白对革兰氏阳性金黄色葡萄球菌和革兰氏阴性大肠杆菌均有抑菌作用,而对益生菌乳酸菌无抑菌作用;其中尤以对金黄色葡萄球菌抑菌作用明显,反映出猪乳铁蛋白与其他乳铁蛋白一样,在抗菌活性作用上均表现为对革兰氏阳性菌抑制作用比革兰氏阴性菌要明显些。这可能与G+菌和G−菌的细胞膜构成差异有关,乳铁蛋白结合到细胞膜上,引起细胞膜的变化方式或者程度有可能不同,从而产生抑菌活性的差异。有关重组猪乳铁蛋白的其他生物学功能将有待于进一步研究。本试验获得重组猪乳铁蛋白的高效表达也为生物功能蛋白通过基因优化获得高效表达提供参考,为基因工程重组猪乳铁蛋白在生产应用中奠定基础。
REFERENCES
[1] Rey MW, Worldshuk SL, DeBeor HA, et al. Complete nucleotide sequence of human. Nucleic Acid Res, 1990, 18(17): 5288−5289.
[2] Johansson B. Isolation of an iron-containing red protein from human milk. Acta Chem Scand, 1960, 14: 510−512.
[3] Montreuil J, Tonnelat J, Mullet S. Preparation and properties of lacto-transferrin of human milk. Biochim Biophys Acta, 1960, 45: 413−421.
[4] Bluard-Deconinck JM, Masson PL, Osinski PA, et al. Amino acid sequence of cystic peptides of lactoferrin and demonstration of similarities between lactoferrin and transferring. Biochim Biophys Acta, 1974, 365(2): 311−317.
[5] Farnaud S, Evans RW. Lactoferrin-a multifunctional protein with antimicrobial properties. Mol Immunol, 2003, 40: 395−405.
[6] Elizabeth JD. Antibiotic properties of bovine Lf on helicobacter pylori. Digest Dis Sci, 1998, 43(12): 2573−2812.
[7] Britigan BE, Lewis TS, Waldshcmidt M, et al. Lactoferrin binds CpG-containing oligonucleotides and inhibits their immunostimulatory effects on human B cells. J Immunol, 2001, 167: 2921−2928.
[8] Reyes RE, Manjarrez HA, Drago ME. E1 hierro and la virulencia bacteriana. Enf Inf Microbiol, 2005, 25: 104−107.
[9] Anderson BF, Baker HM, Norris GE, et al. Structure of human lactoferricin: crystallographic structure analysis and refinement at 2.8 A resolution. J Mol Biol, 1989, 209: 711−734.
[10] Dionysius DA, Milne JM. Antibacterial peptides of bovine lactoferrin: purifcation and characterization. J Dairy Sci, 1997, 80(4): 667−674.
[11] BeIlamy W, Takase M, Yamauchi K, et al. Identification of the bactericidal domain of lactoferrin. Biochim Biophys Acta, 1992, 1121(2): 130−136.
[12] Nakamura I, Watanabe A, Tsunemitsu H, et al. Production of recombinant bovine lactoferrin N-lobe in insect cells and its antimicrobial activity. Protein Expr Purif, 2001, 21(3): 424−431.
[13] Svetlana B, Georgi C, Ivan I. Codon pairs in the genome of Escherichia coli. Bioinformatic, 2003, 19(18): 987−998.
[14] Bu XJ, Du XJ, Zhou WJ, et al. Molecular cloning, recombinant expression and characterization of lysozyme from Chinese shrimp Fenneropenaeus chinensis. Chin J Biotech, 2008, 24(5): 723−732.卜兴江, 杜欣军, 周文杰, 等. 中国明对虾溶菌酶基因克隆、重组表达与性质分析. 生物工程学报, 2008, 24(5): 723−732.
[15] Xu SY, Chen X. Pharmaco-experiment Methodology. Beijing: People’s Health Press, 2001: 797−889.徐叔云, 陈修. 药理实验方法学. 北京: 人民卫生出版社, 2001: 797−889.
[16] Swartz JR. Advances in Escherichia coli production of therapeutic proteins. Curr Opin Biotechnol, 2001, 12(2): 195−201.
[17] Grantham R, Gautier C, Gouy M, et al. Codon catalog usage and the genome hypothesis. Nucleic Acids Res, 1980, 8: 49−62.
[18] Novagen. pET System Manual. 9th ed. 2000.
[19] Xie Y, Wetlaufer DB. Control of aggregation in protein refolding: the temperature-leap tactic. Protein Sci, 1996, 5(3): 517−523.
