中美药品监管信息公开制度比较
2010-02-09廖淑雯陈永法邵蓉
廖淑雯 陈永法 邵蓉
(中国药科大学国际医药商学院,江苏 南京 210009)
中美药品监管信息公开制度比较
廖淑雯 陈永法 邵蓉
(中国药科大学国际医药商学院,江苏 南京 210009)
通过对我国SFDA和美国FDA信息公开制度及实施情况进行比较分析,找出SFDA及各地药监局开展信息公开工作时存在问题,探讨我国药品监管信息公开制度如何有效实施。
SFDA;FDA;信息公开;比较分析
健康权和知情权都是公民享有的最基本权利之一。药品监管信息公开不仅有助于公众了解药品监管信息以及安全用药信息,增进用药安全、有效;而且有助于增加药监部门工作的透明度,使公民更好地实现知情权和参政议政的权利。作为以保护消费者权益为主要职能之一的政府机构,美国食品和药品管理局(FDA)非常重视信息公开工作,并经过多年的实践形成了一套行之有效的工作程序。FDA信息公开工作的发展经验给我国食品药品监督管理局(SFDA)以及各地药监局刚刚起步的信息公开工作带来了很多启示和借鉴。
1 FDA信息公开现状
1.1 公开依据——《信息自由法》
1966年,美国颁布了《信息自由法》(Freedom of Information ACT,FOIA),旨在督促政府机构向公众公开其所持有的档案、文件等信息,以实现对政府权力的监督和制衡。随着社会环境的不断变化,美国国会于1974年、1976年、1978年、1984年、1986年、1996年先后对其进行了六次修改,使之逐步趋于成熟和完善。
FOIA分为七个部分,分别对信息公开的适用范围、运作机制以及监督系统等各方面做了较为详细的规定。这是迄今为止在世界范围内影响最为深远的一部信息公开法,也成为许多国家借鉴的对象。
1.2 公开方式及内容—— 《联邦登记》、主动公开、依申请公开
FOIA针对不同性质的信息,分别规定了三种公开方式:1.2.1 在《联邦登记》上发布 政府机构的基本情况、政府机构制定的法规和政策、公众获取信息的一般程序等最基本、重要的信息,政府机构都应当在《联邦登记》上刊登公布。《联邦登记》始于1936年,每个工作日出版一期,是联邦政府向公众及时、主动、统一、有效地提供信息服务的一个重要渠道。
1.2.2 主动公开 有些政府信息不要求在《联邦登记》上发布,但也是公众了解和监督政府所必不可少的,因此政府机构应当主动公开。这类信息包括:①政府机构最终裁决意见;②未在《联邦登记》上发布的政策及相关解释;③对公众有影响的行政人员手册;④经申请而公开后,政府机构认为以后将有类似申请的信息。
FDA主动公开的信息主要有几类:
①制定的政策文件,如执行政策指南、执行程序指南手册、咨询委员会会议记录等;
②强制执行文件,如执法报告、警告信、禁止名单、拒绝进口报告等;
③产品批准信息(其安全性、有效性和制作方法信息不予公开);
④产品不良反应报告。
FDA还根据用药者的需求主动提供了许多安全用药信息。例如,设立MedWatch网页,收集和公布药品安全性信息;公开涉及公众健康的建议信息;公开防止公众错误用药的信息;帮助公众全面了解药品可获得状态,告知公众药品短缺信息等[1]。
1.2.3 依申请公开 对于上述两种方式未公开的政府信息,公众还可以提出申请要求公开。信息自由更重要的目的也就是让公众依照法律规定获取政府不一定想主动公布的那些信息。公众提出符合要求的申请,除规定免予公开的文件外,行政机关都应当公开,但应对涉及公众或行政相对人隐私的问题做遮蔽处理。
2008年,FDA收到公开申请的数目为9 432件,处理的数目为20 348件(其中包括上一年未处理的17 484件)[2]。其收到和处理的信息公开申请数量在美国公众与卫生服务部(HHS)的11个机构中均处于较为领先水平。
1.2.4 免予公开的例外情况 FOIA规定了九种政府机构可以豁免公开信息的例外情况。其中对FDA来说最为重要的是其中的三种:①商业秘密和第三方提交给FDA的专属或机密性商业或财务信息;②公开后会明显地不正当侵犯公民隐私权的人事、医疗档案或类似的个人信息;③出于执法目的而生成的某些档案和信息。
1.3 公开途径——网站为主,发布形式多样
FDA主要通过网站主动公开信息。依据FOIA,尤其是1996年新修订的《电子信息自由法》,FDA在网上建立了自己的电子阅览室(Electronic Reading Room),供公众查阅信息。
FDA网站信息发布的方式非常多样化,除了最常见的文本形式之外,还运用多媒体技术,提供音频和视频信息。例如:FDA网站从2007年起推出了“药品安全播客”(Drug Safety Podcasts),以音频广播的方式公布新出现的药品安全性信息,并发布公共健康建议。同时,公众还可通过电子邮件订阅、RSS订阅等方式来获取信息。
2 SFDA信息公开现状
2.1 公开依据——《政府信息公开条例》及《政府信息公开指南》
2007年4月24日,我国发布了《政府信息公开条例》(以下简称《条例》),并于2008年5月1日开始施行。《条例》以“公开为原则,不公开为例外”作为基本原则,规定了政府信息公开和不公开的范围、信息公开的主体、方式、程序等。
在《条例》的基础上,SFDA根据自身实际情况,制订了本局的《政府信息公开指南》(以下简称《指南》)和公开目录,以此作为本局开展药品监管信息公开工作的法律依据和行动指南。
2.2 公开方式及内容——机构职能、法规文件、基础数据、公告通告等
2.2.1 主动公开信息 《条例》第九条规定,涉及公民、法人或者其他组织切身利益;需要公众广泛知晓或者参与;反映本行政机关机构设置、职能、办事程序等情况;以及其他依照有关规定应当主动公开的政府信息,行政机关应当主动公开。由于食品药品安全与人们的生命健康息息相关,《条例》第十条对县级以上行政机关重点公开信息中还特别规定了“食品药品的监督检查情况”一项。
从SFDA制定的公开目录上看,主动公开的信息主要包括以下10大类:机构职能、人事信息、法规文件、公告通告、规划计划、综合管理、基础数据、行政许可、最新动态和食品安全。其中公告通告中包括质量公告、药品GMP、GSP认证情况公告、药品不良反应通报等内容。基础数据中包括药品生产、经营企业基本情况;国产、进口药品品种、批准文号;药品安全监管和市场监管相关信息等。2008年SFDA网站公开信息的数据统计见图1。
2.2.2 依申请公开信息 除SFDA依法主动公开信息外,公众和行政相对人还可根据自身生产、生活、科研等特殊需要申请获取相关政府信息。公众和行政相对人提出符合要求的申请时,除规定免予公开的信息外,SFDA都应当公开,或者告知申请人获取该信息的方式和途径。

图12008年SFDA网站公开信息的数据统计
2008年5月1日至12月31日,SFDA共受理依申请公开的申请6件,其中1件属于依申请公开范畴,其余5件均为信息查询和业务咨询。
2.2.3 暂不予公开的信息 《条例》和《指南》中没有明确指出哪些信息属于暂不予公开的范畴,但依据SFDA 2000年1月发布的《关于加强药品监督管理信息化建设的若干意见》,以及从其公开信息的实际情况来看,药监部门内部行政办公信息、药品检验信息、新药和进口药标准资料、不良反应过程数据、限制性公开的假劣药品查处结果、限制性公布的新药研究动态信息、限制性公布的各类统计结果等列入“暂不宜公开”的范畴[3]。这主要是基于保护国家秘密、政府工作秘密和商业秘密而考虑的。
2.3 公开途径——网站为主,政府公报、新闻发布会、大众传媒等为辅
SFDA主动公开信息的途径是以网站发布为主,新增了政务公开专栏,公众可以通过专栏查阅和检索该局主动公开信息的内容,并可在线提交信息公开申请。
但网上公开方式可能会给无法接触网络或者缺乏网络知识的人带来很多困难,因此,SFDA还积极通过其他方式发布政府信息。2008年,SFDA共举办各类新闻发布会19次,新闻通气会7次,还在行政受理大厅设置触摸屏查询系统、发放办事指南,通过《中国医药报》、《中国食品药品监督管理年鉴》等载体扩大政府信息公开。
3 FDA和SFDA信息公开比较分析
通过对FDA和SFDA信息公开制度及其具体的实施
情况进行总结和比较,可以看出两者主要在以下几个方面存在着区别,见表1。
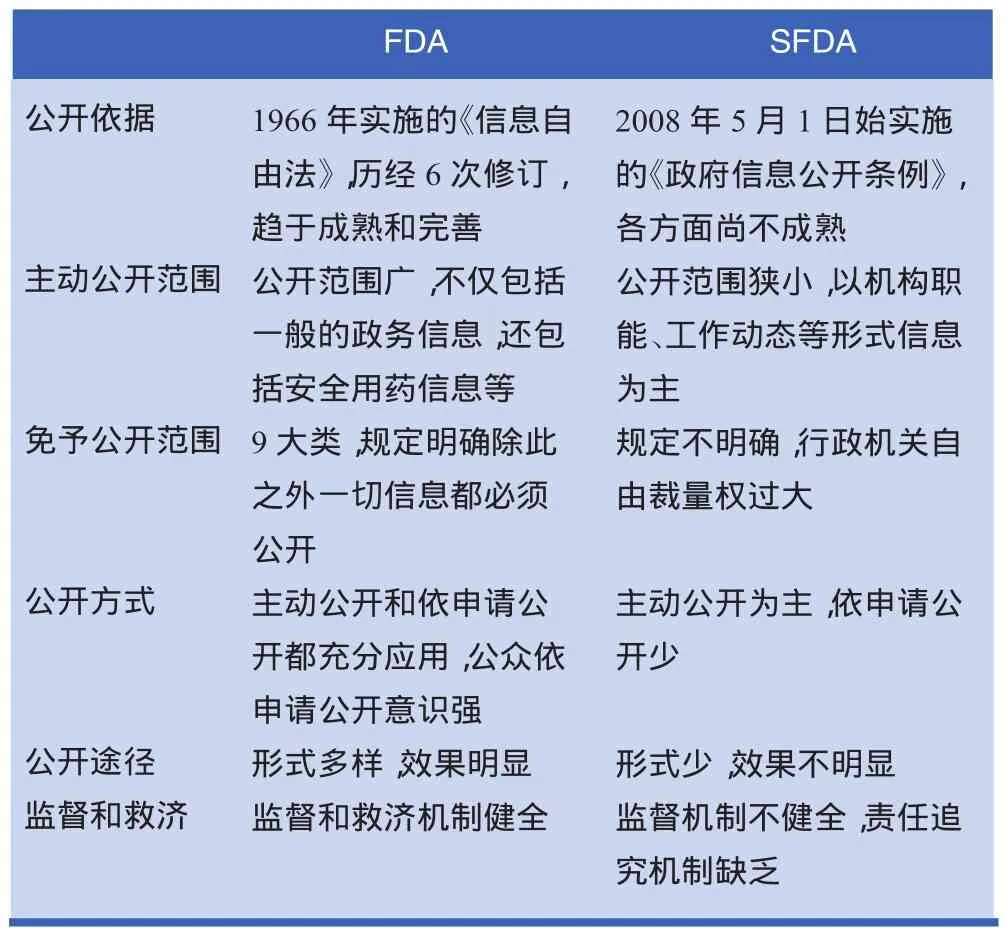
表1 FDA与SFDA信息公开制度比较
4 完善我国药品监管信息公开制度的建议
相比FDA,SFDA有待不断改进和完善。究其原因,可以归结为几个方面:一是信息公开理念的不同,FDA强调的是维护公众权益的理念,公民作为纳税人拥有获知政府行为、信息的权利;而SFDA侧重于维护社会公共利益的理念,重在公开涉及公共利益特别是政务方面的内容;理念的差别决定了公开内容和方式的不同。二是法规制度的不健全,我国在公开的内容、方式和时限等方面还未有科学、统一的规定,且缺乏监督、责任追究和救济机制。三是运作的不规范,在具体操作上还存在着一定程度的随意性。借鉴FDA成功的经验,完善我国药品监管信息公开制度,主要可以从以下几方面入手。
4.1 转变观念,立足于维护公众权益
SFDA及各地药监局可以围绕构建“透明政府”、“服务型政府”的目标,从公众和行政相对人的需求出发,不断完善信息公开的范围和途径。除了公开必要的机构职能、工作动态、法规文件等方面的形式信息外,还可以增加公开公众最关心的重点和热点问题,如突发食品药品安全事故、药品不良反应、假劣药查处、安全用药知识等信息,以及行政相对人所关心的行政许可申请、审批状况等,以满足不同信息受众的需求。
4.2 完善相关规定,明确公开程序
由于《条例》以及《指南》对公开的范围、内容、程度和时限上都没有做出非常明确的规定,致使在具体操作时存在着一定程度的随意性。而且各地药监局在开展药品监管信息公开工作时,具体做法上形式各异、尺度不一,地区间发展不平衡。
因此,可以考虑对《指南》中的公开主体的职责、程序、公开内容、方式和时限要求等方面进一步明确完善。而且各地药监局的《指南》应尽可能保持协调统一,个别可根据实际情况进行必要的调整,以保持工作的规范化和统一化。
4.3 改进网站建设,丰富信息发布形式和途径
互联网作为信息传播的途径之一,具有发布及时性、获取公平性和互动性强等优势,政府利用互联网的形式推动政府信息公开已是信息社会发展的必然趋势。因此,SFDA及各地药监局可以充分利用网络资源优势,在发展电子政务的基础上,向公众提供最新的药品监管动态以及权威、可靠的药品安全性信息。进行网站建设时,从方便公众获取信息、接受服务为出发点,按照用户的需求和浏览习惯来设计发布平台,以达到更好的公开效果。
在确保信息发布准确、及时的同时,还可以考虑发挥网络所具有的独特的传媒特性,丰富信息发布形式,如采用音频、视频等多媒体信息发布手段,让信息更具表现力;提供以药品监管信息、药品安全性信息为专题的RSS订阅或电子邮件订阅,提高信息获取的效率和个性化水平[4]。
4.4 完善监督和评估体系,保障制度落实
任何一项制度的落实都离不开长效的监督评估机制。在药品监管信息公开制度建设过程中,进一步完善信息公开的考核评估体系、监督检查体系、行政复议、行政诉讼、责任追究等方面也很重要,比如合理规定不公开信息或公开虚假信息的处罚措施、公众对公开信息的质疑方法和渠道、对公众申请信息公开的权利保障措施等,以保障和促进药品监管信息公开工作更好实施。
[1]董江萍,孙利华,马坤,等.美国食品药品监督管理局药品审评和研究中心公众共享信息披露的分析和启示[J].中国药事,2007,21(8):645-646.
[2]FDA.Freedom of Information Annual Report 2008[EB/OL].http://www.fda.gov/RegulatoryInformation/FOI/FOIAAnnual-Reports/ucm136513.htm.2009-5-27.
[3]胡敏洁.调整与完善:政府信息公开条例与中国药品监管[J].中国处方药,2007,(6):38.
[4]张欢之.发挥政府网站对药品安全性信息沟通的作用——以美国FDA网站为例[J].中国处方药.2008,(8):48.
Comparative Analysis Between SFDA and FDA of Drug Administration Information Disclosure System
Liao Shuwen,Chen Yongfa,Shao Rong(School of International Pharmaceutical Business of CPU,Nanjing 210009,China)
Through studying the differences between SFDA and FDA of the drug administration information disclosure system and their implementation status,this thesis has analyzed the current problems existing in SFDA and local Food and Drug Administration and explored how should the China’s drug adm inistration information disclosure system work.
SFDA;FDA;Information Disclosure;Comparative Analysis
廖淑雯,女,在读硕士。研究方向:药事法规。
邵蓉,女,教授。研究方向:药事管理。通讯作者E-mail:shaorong118@163.com
