脂阿拉伯甘露糖联合38kD蛋白在结核病诊断中的应用
2010-01-26王森陈嘉臻张文宏
王森,陈嘉臻,张文宏
复旦大学附属华山医院感染科,上海 200040
结核病是一种长期危害全人类的慢性传染病,病死率居传染性疾病第2位。近年来我国结核病疫情出现加重趋势。对结核病进行快速、准确的诊断,是控制结核病的重要措施之一。目前结核病确诊的主要依据仍然是细菌学检查(包括培养和涂片)。但结核分枝杆菌(简称结核杆菌)培养需很长时间(6~8周),且10%~20%病例的结核杆菌培养失败;痰涂片法虽然简便、快速,但是敏感度很低,平均检出率只有25%~35%[1]。此外,对于肺外结核(如骨关节结核、淋巴结核等)细菌学检查阳性率普遍偏低,有时还存在取样困难。因此这些手段无法对需早期有效治疗、疑似结核病的患者进行快速诊断。
自1976年Nassau等[2]用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测抗结核杆菌抗体以来,结核病的血清学诊断方法飞速发展,技术日益成熟,得到越来越广泛的应用。血清学诊断具有快速、简便、低廉,且不需要活细胞等优点。血清学诊断抗原方面的研究已取得相当大的进步,并确认了几个很有希望的血清学抗原。其中,38kD重组抗原作为结核杆菌分泌的一种抗原,是迄今为止确认的抗原中单独用于结核病血清学诊断效果最好的[3,4]。脂阿拉伯甘露糖(lipoarabinomannan,LAM)是结核杆菌细胞壁的固有成分,能有效刺激机体产生抗LAM抗体。在本实验中,我们采用LAM与38kD混合抗原,以ELISA检测结核病患者血清中抗LAM和38kD混合抗原的IgG抗体(LAM-38kD-IgG),并与结核菌素试验(tuberculin skin test,TST)进行比较,以评价其在结核病诊断和筛查中的应用价值。
1 材料和方法
1.1 实验对象
1.1.1活动性结核病组共128例,分别来自重庆市肺科医院(73例)、山东省胸科医院(20例)和苏州市第五人民医院(35例);男性72例,女性56例;年龄16~84岁,中位年龄46岁;初治101例,复治27例。128例活动性肺结核病患者中,肺结核107例,包括细菌阳性肺结核59例、细菌阴性肺结核48 例;肺外结核21例,包括结核性胸膜炎14例、结核性脑膜炎2例、骨关节结核4例、淋巴结核1例。活动性结核病的诊断标准参考中华医学会颁布的《结核病临床诊疗指南》中的规定,经细菌学检查、临床表现及病理确诊。
1.1.2潜伏性结核感染组共51例,其中男性23例,女性28例;年龄23~62岁,中位年龄32岁。入选标准如下:①有结核杆菌高感染风险的人群,包括近期与活动性肺结核病患者密切接触者、可能与结核病患者接触的医务人员、来自结核病流行高发区域者等;②酶联免疫斑点试验(enzyme-linked immunosorbent spot, ELISPOT)为阳性,本实验采用T-Spot.TB试剂盒(Oxford Immunotec,Oxford,UK),由上海复星科技有限公司提供;③根据临床、影像学表现等排除活动性结核病。
1.1.3健康对照组共68例,分别来自复旦大学附属华山医院非结核病体检者27例和复旦大学志愿者41例。其中男性33例,女性35例;年龄21~68岁,中位年龄31岁。所有入选者无免疫系统疾患,近3个月内未用过免疫抑制剂。
1.2 方法
1.2.1血清LAM-38kD-IgG的检测选取196例样本,血清中LAM-38kD-IgG的检测采用PATHOZYME-MYCO IgG(Myco G)诊断试剂盒(北京迈晨科技有限公司),完全严格按照试剂盒说明书规定的步骤进行操作,酶标仪在450 nm处读取A值。根据待测样品的A值,从标准曲线上计算出该样品的抗体含量。按试剂盒的产品说明,待测样品抗体水平>400 u/ml判为阳性。所有操作均采用双盲法。
1.2.2TST采用国产人型结核菌素纯蛋白衍生物(purified protein derivative,PPD)试剂,对所有病例以PPD 0.1 ml(5 TU,1/2 000)皮内注射(通常在前臂掌侧),48~72 h后观察结果并测量局部硬结直径。有红肿硬结且硬结直径≥5 mm 者或有水疱或破溃者判为PPD试验阳性,无红肿硬结者判为阴性。
1.3 统计学处理
所用的统计学分析软件为Stata(Ver. 10.0),各组阳性检出率的比较采用普通卡方检验和McNemar卡方检验,治疗前、后抗体水平的比较采用配对资料t检验。
2 结果
2.1 LAM-38kD-IgG检测对活动性结核病的诊断价值
在本实验中,活动性结核病患者共128例,LAM-38kD-IgG检测阳性者60例,敏感度为46.88%。其中肺结核组敏感度为46.73%(50/107),肺外结核组为47.62%(10/21)。初治组敏感度为45.54%(46/101),复治组为51.85%(14/27)。肺结核组与肺外结核组,初治组与复治组比较,敏感度均无统计学差异(P>0.05)。在68例健康对照者中,阳性者1例,特异度为98.53%(67/68)。而在51例潜伏性结核感染者中,LAM-38kD-IgG检测均为阴性(表1)。与临床诊断结果比较,LAM-38kD-IgG检测诊断活动性结核病的敏感度为46.88%,特异度为98.53%,阳性预测值为98.36%(60/61),阴性预测值为49.63%(67/135)。
表1活动性结核组和对照组中LAM-38kD-IgG检测结果
Tab.1TheresultsofLAM-38kD-IgGtestinactivetuberculosisgroupandcontrolgroup
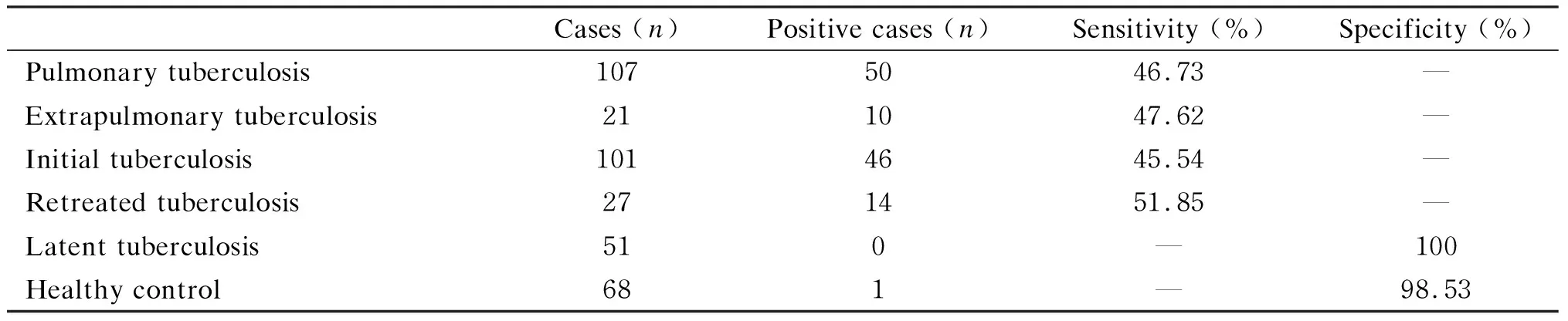
Cases (n)Positive cases (n)Sensitivity (%)Specificity (%)Pulmonary tuberculosis1075046.73—Extrapulmonary tuberculosis211047.62—Initial tuberculosis1014645.54—Retreated tuberculosis271451.85—Latent tuberculosis510—100Healthy control681—98.53
在107例活动性肺结核病患者中,痰涂片检查阳性者59例,阴性者48例。涂片阳性组LAM-38kD-IgG检测的敏感度为52.54%(31/59);涂片阴性组的敏感度为39.58%(19/48),低于涂片阳性组,但差异无统计学意义(P>0.05)(表2)。
表2涂片阳性和涂片阴性肺结核组中LAM-38kD-IgG检测结果比较
Tab.2ComparisonofLAM-38kD-IgGtestinsmear-positiveandsmear-negativepulmonarytuberculosis

Smear-positive Smear-negative χ2 PLAM-38kD-IgG positive (n)31191.7860.181LAM-38kD-IgG negative (n)2829Sensitivity (%)52.5439.58
2.2 不同受试人群中血清LAM-38kD-IgG含量的比较
不同受试人群血清中LAM-38kD-IgG的含量及范围如图1、2所示,其中肺结核组(包括涂片阳性肺结核和涂片阴性肺结核)和肺外结核组的抗体含量明显高于潜伏性结核感染组和健康对照组,差异有统计学意义(P<0.01)。涂片阳性肺结核组、涂片阴性肺结核组和肺外结核组之间,LAM-38kD-IgG含量无显著性差异(P>0.05)。潜伏性结核感染组与健康对照组比较,血清中LAM-38kD-IgG效价也无显著性差异(P>0.05)。
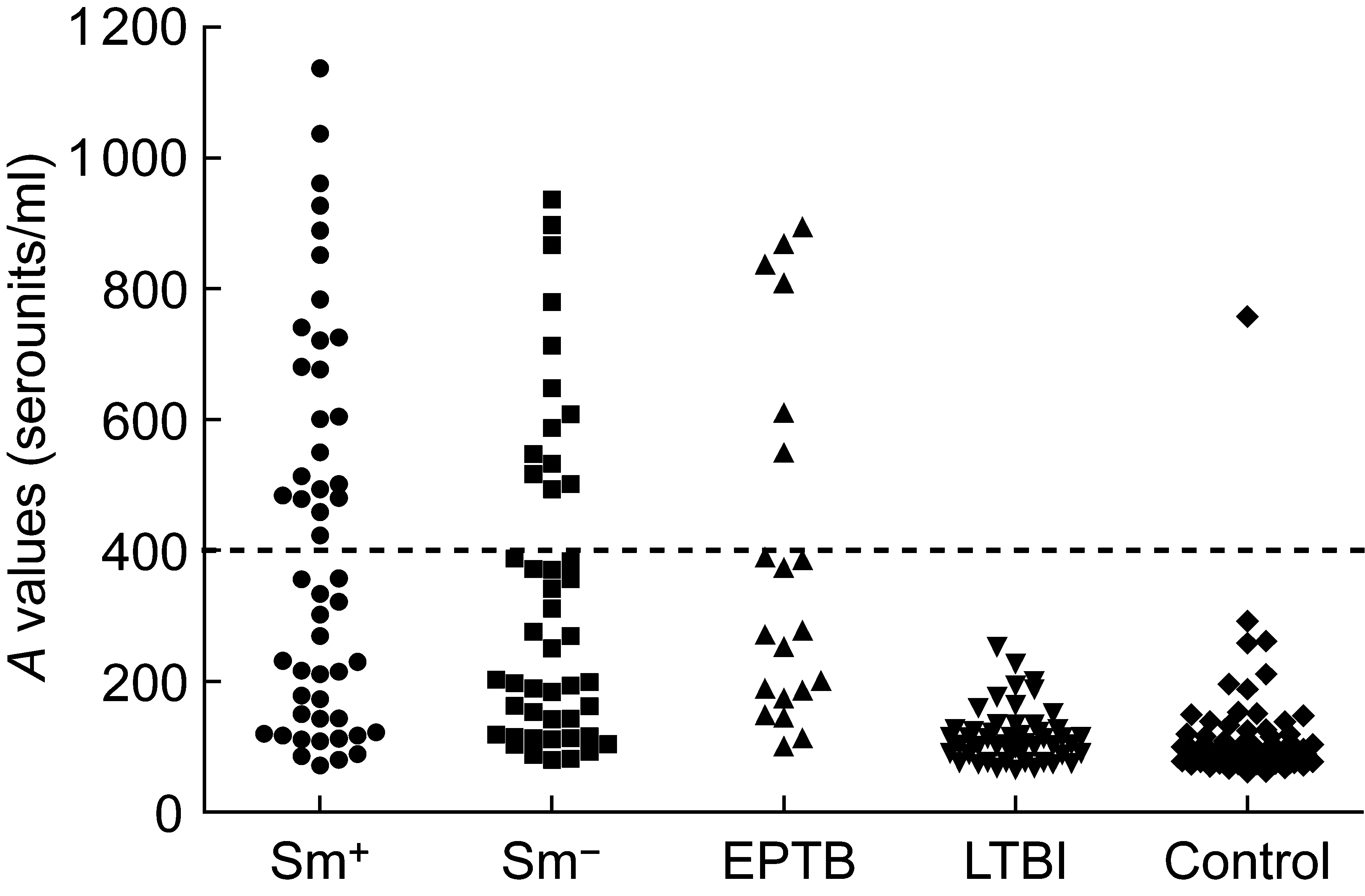
Sm+, smear-positive pulmonary tuberculosis (TB); Sm-, smear-negative pulmonary TB; EPTB, extrapulmonary TB; LTBI, latent TB infection.
图1不同受试人群中LAM-38kD-IgG含量的比较
Fig.1TiresofLAM-38kD-IgGindifferentgroups

Sm+, smear-positive pulmonary tuberculosis (TB); Sm-, smear-negative pulmonary TB; EPTB, extrapulmonary TB; LTBI, latent TB infection.
图2不同受试人群中LAM-38kD-IgG含量的范围和平均值
Fig.2RangeandmeantiresofLAM-38kD-IgGindifferentgroups
2.3 LAM-38kD-IgG检测结果与TST结果的比较
选取96例活动性结核病患者进行PPD皮试,其中PPD反应阳性者(有红肿硬结且直径≥5 mm者或有水疱或破溃者)共54例,敏感度56.25%。血清LAM-38kD-IgG检测阳性41例,敏感度42.71%,略低于PPD试验,但差异无统计学意义(P>0.05)。在有明确卡介苗(Bacillus Calmette-Guérin,BCG)接种史的41例健康对照中,LAM-38kD-IgG检测的特异度为97.56%(40/41),而PPD试验的特异度为41.46%(17/41),远低于LAM-38kD-IgG检测(P<0.01)。如果把PPD和LAM-38kD-IgG检测结果合并,其中1项阳性即判为阳性,则96例活动性结核病患者中共67例阳性,敏感度可达69.79%(表3)。
表3LAM-38kD-IgG检测与PPD试验结果的比较
Tab.3ComparisonofresultsofLAM-38kD-IgGtestandPPDtest

Positive cases in active tuberculosis (n=96)Positive cases in healthy control (n=41)Sensitivity (%)Specificity (%)LAM-38kD-IgG41142.7197.56PPD542456.2541.46
2.4 LAM-38kD-IgG含量与结核病病情的关系
为检测血清中LAM-38kD-IgG含量与结核病病情之间的关系,我们对部分结核病患者在6个月后进行随访。其中23例患者经过规范化抗结核治疗后,病情有明显好转(临床症状明显减轻;X线等影像学检查显示病变吸收,空洞闭合;痰细菌学检查转阴)。其中10例LAM-38kD-IgG检测阳性患者中7例转阴,阴转率为70.0%。对23例患者治疗前、后LAM-38kD-IgG含量进行配对t检验显示,治疗后抗体水平明显下降(P<0.05,结果未列出)。
3 讨论
近年来研究确认了几种很有希望的血清学诊断抗原,包括38kD蛋白、α-crystallin(14kD)、16kD蛋白(Rv2031)、Ag85A、Ag85B、MPT64、A60、ESAT-6、CFP-10及LAM等[5], 但目前还没有哪一种单独的抗原在诊断敏感度和特异度方面令人满意,因此研究者普遍认为血清学诊断试剂可采用几种不同的抗原以达到较好的诊断效果。本次实验采用了LAM与38kD蛋白的混合抗原。
128例活动性结核病患者血清中,LAM-38kD-IgG含量的检测结果显示其诊断结核病的敏感度为46.88%,与国外用同种试剂盒(Myco G)进行检测所得的敏感度相似(41%~55%)[6,7]。至于出现假阴性结果,即确诊活动性结核病患者的抗体反应呈阴性(53.12%),主要原因在于不同个体体液免疫水平存在差异;患者处于结核感染的不同阶段,如临床感染初期结核抗体的产生处于“窗口期”;血液中抗原-抗体复合物的存在使抗体无法被检测等。
本研究结果显示,LAM-38kD-IgG检测在涂片阳性肺结核组中的敏感度(52.54%)高于涂片阴性组(39.58%),尽管无统计学差异,但国外同类实验证实涂片阳性组检测的敏感度高于涂片阴性组[8,9],提示涂片阳性结核病患者体内含有较多结核杆菌,其免疫系统更易受到结核杆菌抗原的刺激,引起较强的免疫反应,产生更多的特异性抗体。此外,LAM-38kD-IgG在肺结核与肺外结核组、初治与复治结核组中的阳性检出率相似,说明其可被应用于多种类型的结核病如肺外结核病、复治结核病等的诊断。这些特点使LAM-38kD-IgG在检测不易取得细菌学检查标本的肺外结核病或细菌阴性肺结核病的诊断方面,具有较高的应用价值。
为避免受到BCG接种的影响,本研究选择将γ 干扰素释放试验(interferon-γ release assay,IGRA)阳性作为潜伏性结核感染的入选标准。Menzies等[10]对1966~2006年相关文献和数据进行的Meta分析显示,IGRA检测的总体特异度为92.5%~97.7%。在BCG接种人群中,其特异度明显高于PPD试验(约为56%)。入选的51例潜伏性结核感染者LAM-38kD-IgG含量与健康组相似,但均明显低于活动性结核病组,提示结核杆菌在潜伏状态下受机体免疫系统的控制而不能繁殖,较少或不能引起机体的体液免疫反应而产生相应抗体。有文献证实,机体对38kD抗原的反应主要存在于活动性结核病中,而在潜伏性感染或健康人群中较少引起相应抗体水平升高[9]。为提高对潜伏性结核感染的检出率,可采用结核杆菌只在潜伏状态下才表达的标志性蛋白,或在潜伏性感染状态下能引起相应抗体反应的16kD、14kD抗原等[5]进行检测。
目前TST仍是我国应用最广泛的检测结核杆菌感染的方法。但是,TST中使用的PPD与BCG之间存在交叉反应,出现较高的假阳性率。本研究中,41例BCG接种的健康对照中,TST的特异度仅为41.46%,而LAM-38kD-IgG检测在健康对照人群中特异度为97.56%,明显高于PPD试验(P<0.01) ,且检测结果不受BCG接种的影响。在检测结核杆菌感染的敏感度方面,LAM-38kD-IgG检测略低于PPD试验,但两者阳性率无统计学差异。因此,LAM-38kD-IgG检测是一种替代TST的可行方法,与其他检测方法联用可提高诊断活动性结核病的敏感度和准确性。
总之,应用LAM与38kD混合抗原的ELISA技术在诊断活动性结核病方面具有中等敏感度、极高特异度及阳性预测值,不仅可与结核病的其他诊断方法联用以提高诊断的准确性,而且特别适用于细菌学检查阴性结核病和肺外结核病的诊断。
[1] Furin JJ, Johnson JL. Recent advances in the diagnosis and management of tuberculosis [J]. Curr Opin Pulm Med, 2005, 11 (3): 189-194.
[2] Nassau E, Parsons ER, Johnson GD. The detection of antibodies to Mycobacterium tuberculosis by microplate enzyme-linked immunosorbent assay (ELISA) [J]. Tubercle, 1976, 57(1): 67-70.
[3] Weldingh K, Rosenkrands I, Okkels LM, Doherty TM, Andersen P. Assessing the serodiagnostic potential of 35 Mycobacterium tuberculosis proteins and identification of four novel serological antigens [J]. J Clin Microbiol, 2005, 43(1): 57-65.
[4] Uma Devi KR, Ramalingam B, Brennan PJ, Narayanan PR, Raja A. Specific and early detection of IgG, IgA and IgM antibodies to Mycobacterium tuberculosis 38kDa antigen in pulmonary tuberculosis [J]. Tuberculosis (Edinb), 2001, 81(3): 249-253.
[5] Abebe F, Holm-Hansen C, Wiker HG, Bjune G. Progress in serodiagnosis of Mycobacterium tuberculosis infection [J]. Scand J Immunol, 2007, 66(2-3): 176-191.
[6] Imaz MS, Comini MA, Zerbini E, Sequeira MD, Latini O, Claus JD, Singh M. Evaluation of commercial enzyme-linked immunosorbent assay kits for detection of tuberculosis in Argentinean population [J]. J Clin Microbiol, 2004, 42(2): 884-887.
[7] Senol G, Erer OF, Yalcin YA, Coskun M, Gündüz AT, Biçmen C, Ertas M, Ozkan SA. Humoral immune response against 38-kDa and 16-kDa mycobacterial antigens in tuberculosis [J]. Eur Respir J, 2007, 29(1): 143-148.
[8] Steingart KR, Henry M, Laal S, Hopewell PC, Ramsay A, Menzies D, Cunningham J, Weldingh K, Pai M. Commercial serological antibody detection tests for the diagnosis of pulmonary tuberculosis: a systematic review [J]. PLoS Med, 2007, 4(6): e202.
[9] Silva VM, Kanaujia G, Gennaro ML, Menzies D. Factors associated with humoral response to ESAT-6, 38 kDa and 14 kDa in patients with a spectrum of tuberculosis [J]. Int J Tuberc Lung Dis, 2003, 7(5): 478-484.
[10] Menzies D, Pai M, Comstock G. Meta-analysis: new tests for the diagnosis of latent tuberculosis infection: areas of uncertainty and recommendations for research [J]. Ann Int Med, 2007, 146: 340-354.
