COX-2、Ang-2在胃癌中的表达及其与淋巴管生成间的关系*
2010-01-25刘振忠冯善龙王新立王庆宝
刘振忠 冯善龙 杨 柳 孔 伟 王新立 王庆宝
(泰山医学院附属医院,山东 泰安 271000)
淋巴转移是恶性肿瘤独有的恶性行为学特征,是影响恶性肿瘤进展的重要因素。近年来,随着淋巴管特异性标记物D2-40、VEGFR-C、Podoplanin、 LYVE-1等陆续被发现,使淋巴内皮细胞和血管内皮细胞得以区别开来,对研究肿瘤淋巴管转移起到了极大的促进作用。环氧合酶(cyclooxygenase COX)是花生四烯酸代谢的关键性限速酶,是一种膜结合蛋白,具有环氧合酶和过氧化物合成酶双重酶的功能。研究发现Ang-2 可使肠系膜淋巴管内皮细胞的Tie2 受体磷酸化, 促进淋巴管内皮细胞迁移,增殖作用[1]。两者作为重要的淋巴管生长因子,在淋巴管生成过程中均具有重要作用。本研究就Ang2和COX-2 在胃癌中的表达关系及其意义进行探讨。
1 材料与方法
1.1 临床资料
48例胃癌标本为泰山医学院普外科2007年7月~2009年7月间行胃癌根治术的切除标本,术后病理结果均为腺癌。所有病例术前均未化疗、放疗或激素治疗。其中包括男40例,女8例,中位年龄57岁;TI期5例,T2期12例,T3期27例,T4期4例;有淋巴结转移者36例,无淋巴结转移者12例。
1.2 免疫组织化学染色
用免疫组织化学SP法,鼠抗人D2-40单克隆抗体,免疫组化单染试剂盒均购自北京中杉生物工程有限公司。将标本制成层厚为4um连续切片,经常规二甲苯脱蜡,梯度酒精脱水,水化,高压修复,3%过氧化氢溶液,滴加山羊血清封闭后,滴加一抗(D2-40工作液,浓),4 ℃过夜,PBS冲洗,滴加生物素标记的二抗,甩去PBS液,滴加链霉菌抗生物素一过氧化物酶溶液,加新鲜配制的DAB溶液,显微镜下观察3~5分钟,苏木素复染30秒,温热PBS冲洗返蓝,经梯度酒精脱水干燥二甲苯透明,中性树胶封片。每批标本染色过程中均设置阳性对照和阴性对照。淋巴管密度计数采用Wendner等[2]的方法,计数标准:先在低倍镜(×40)下全面观察切片,确定淋巴管密度最高处,即热点。再在高倍镜下(×200)计数D2-40阳性的淋巴管数目。应用多功能病理图像分析仪计数每一份标本5个视野内的淋巴管个数,合计5个视野内淋巴管均数作为该部位的MLVD。
1.3 RT-PCR
选取基因保守序列,应用Primer5软件,设计目的基因COX-2、Ang-2以及内参基因β-actin引物,由上海英潍捷基生物工程技术有限公司合成。引物具体序列:COX-2上游引物TCG CCC TCC CAT CCC TAC GC,下游引物AGA GGG GGT AGA GGG GGT GCT (477bp); Ang-2上游引物CGC CGC TCG AAT ACG ATG A,下游引物CGT CTG GTT CTG TAC TGC ATT(158bp);β-actin上游引物CTG GAA CGG TGA AGG TGA CA,下游引物AAG GGA CTT CCT GTA ACA ATG CA(148bp)。按试剂盒说明提取总RNA并逆转录成cDNA,PCR反应程序:94 ℃预变性5分钟;94 ℃变性30秒,退火温度退火30秒, 72 ℃延伸45秒,共40个循环;72 ℃延伸10分钟。2%琼脂糖凝胶电泳后,在成像分析系统上统计基因表达情况。
1.4 统计学分析
所有数据均采用SPSS 17.0统计软件包进行统计分析。计量资料结果以均数士标准差(Mean±Sd)表示,t检验;计数资料结果用χ2检验。P<0.05定为差异有统计学意义。
2 结 果
2.1 COX-2、Ang-2在胃癌中的表达。
本实验数据表明:39例COX-2mRNA高表达胃癌中有25例Ang-2mRNA阳性表达,14例阴性表达;9例COX-2mRNA阴性表达胃癌标本中有3例Ang-2mRNA阳性表达,6例阴性表达。在胃癌组织中COX-2与Ang-2的表达明显具有相关性。
2.2 胃癌中COX-2,Ang-2的表达与临床病理参数之间关系。
COX-2表达与胃癌TNM临床病理和有无淋巴结转移明显相关,Ⅲ+IV期病例的COX-2表达率显著高于I+Ⅱ期病例。与病人的年龄,肿瘤部位,肿瘤大小无关。Ang-2表达与胃癌TNM临床病理TNM分期和有无淋巴结转移相关,与其他临床病理资料无明显相关。不同临床病理生物学指标的胃癌COX-2、Ang-2表达情况见表1。
2.3 COX-2,Ang-2的表达与MLVD之间的关系
COX-2阳性表达组淋巴管密度平均为14.18±2.23个,高于阴性表达组淋巴管密度12.49±1.23个,MLVD在COX-2阳性表达胃癌标本中的表达率高于COX-2阴性表达的胃癌标本(t=2.189,P<0.05)。Ang-2阳性表达组淋巴管密度平均为14.76±1.98个,高于阴性表达组淋巴管密度12.60±1.83个。MLVD在Ang-2mRNA阳性表达胃癌标本中的表达率高于Ang-2阴性表达组的胃癌标本(t=3.882,P<0.05),两者具有统计学意义。
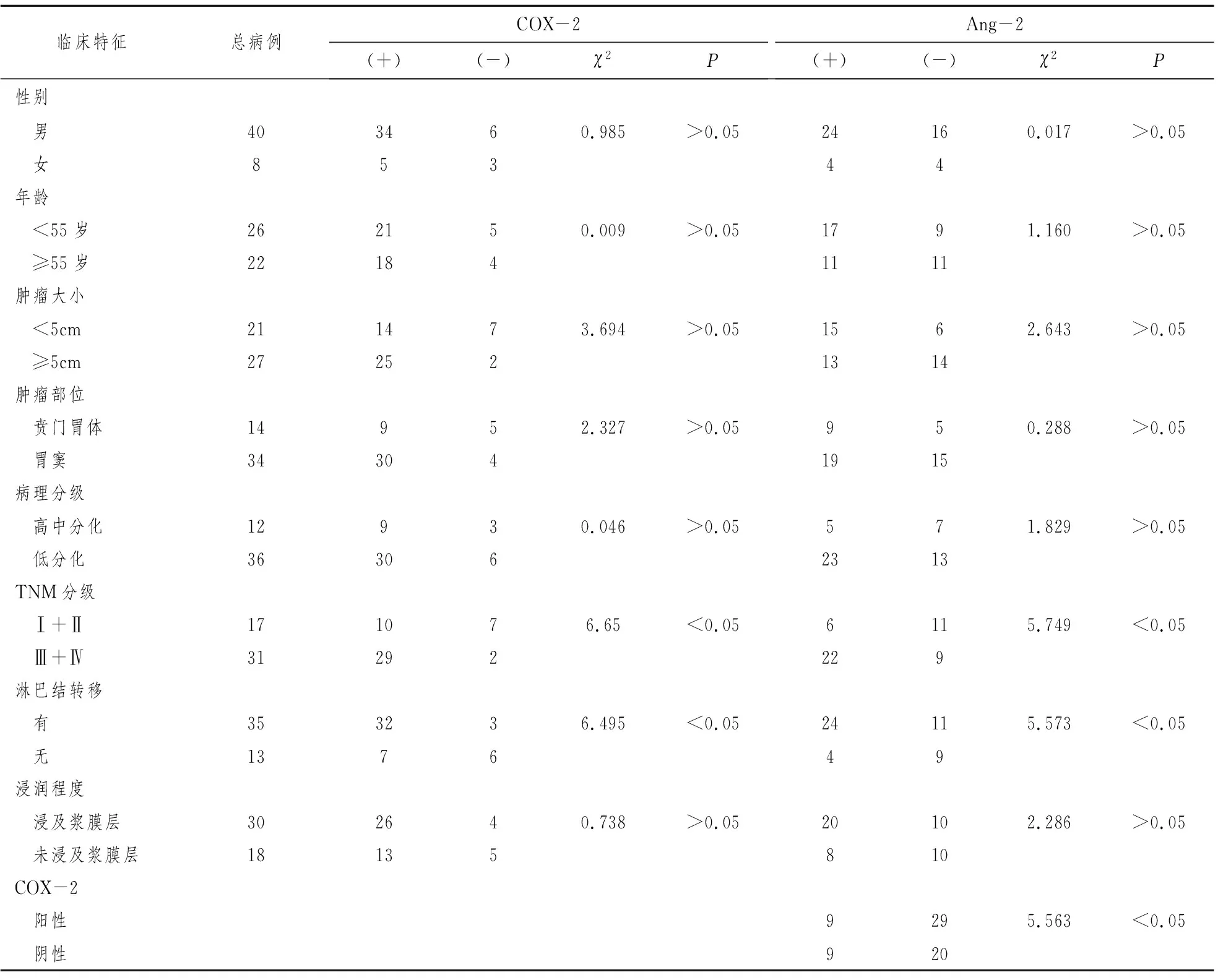
表1 胃癌组织中COX-2、Ang-2表达与临床病理参数之间关系
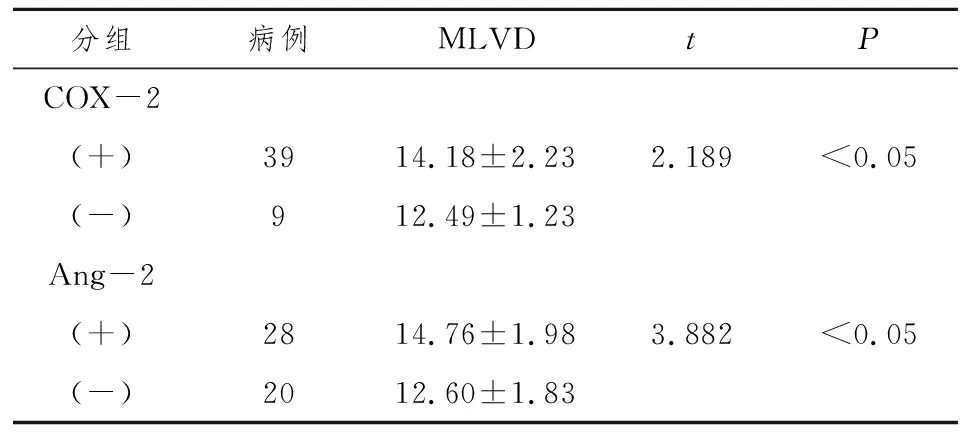
表2 胃癌组织中COX-2,Ang-2的表达与MLVD之间的关系
图1 D2-40在胃癌癌旁组织中的表达(×200)

图2 COX-2在胃癌组织的表达电泳图
图3 Ang-2在胃癌组织的表达电泳图
3 讨 论
环氧合酶是花生四烯酸(AA)合成前列腺素(PGs)过程中一个重要的限速酶,作为一个重要的生化调节因子及多效酶,其具有抑制细胞凋亡、促进血管形成、增强细胞活动性等多种功能,参与体内包括炎症反应和肿瘤发生发展等在内的多个生理病理过程,参与了胃癌的形成、进展、转移等多种过程。COX-2的高表达与胃癌血管生成和淋巴管生成密切相关。目前发现COX-2可上调VEGF-C等基因[3、4],但这不能充分解释COX-2促进肿瘤淋巴管生成的机制,因此推测可能还有其他一些基因起作用。
血管生成素(Angiopoietins, Ang)是一族分泌型的细胞因子,因为能促进血管生成,故被命名为血管生成素。Ang-2可竞争性拮抗Ang-1的作用,其通过竞争性抑制Ang-1与受体酪氨酸激酶Tie2 的相互作用参与血管重塑和血管内膜去稳定的过程[5],遗传学表明,Ang2也是在淋巴管发育过程中起关键作用[6],研究还发现Ang1 和Ang2 均可使牛肠系膜淋巴管内皮细胞的Tie2 受体磷酸化,从而诱导淋巴管内皮细胞增殖和迁移[1]。
以往对COX-2、 Ang-2的研究主要在促进肿瘤血管生成方面,两者在肿瘤淋巴管生成方面有无协同作用研究较少,两者的表达与胃癌淋巴管生成间有无关系尚未见文献报道。本研究结果表明,COX-2、 Ang-2在胃癌中均高表达,且两者之间具有正相关关系。这与国外研究相一致[7]。结合临床病理资料,我们发现COX-2、 Ang-2的表达均与胃癌的淋巴结转移,TNM临床分期有关,提示COX-2可影响Ang-2在胃癌中的表达,特别在缺氧状态下,刺激细胞中Ang-2水平升高,从而共同影响胃癌的生物学行为,COX-2抑制剂影响胃癌细胞Ang-2的表达从侧面也证实了COX-2上调Ang-2在胃癌中的表达[8]。
我们通过检测48例胃癌组织中COX-2、Ang-2的表达及癌旁组织淋巴管密度,评估淋巴管密度与COX-2、Ang-2相互关系,发现COX-2表达阳性组淋巴管密度高于COX-2表达阴性组,Ang-2阳性组淋巴管密度明显高于Ang-2阴性组。MLVD作为反映胃癌微淋巴管生成状况的指标,提示COX-2、 Ang-2的表达在促进肿瘤周围淋巴管新生过程中起重要作用。
作为重要的促淋巴管生成因子, COX-2与Ang-2诱导肿瘤组织淋巴管新生的确切机制仍需进一步研究。如果能彻底阐明两者在胃癌肿瘤淋巴管新生过程中的具体作用机制,将对胃癌抗肿瘤淋巴管转移的临床治疗产生深远影响。
[1] Vicky PK,Nguyen,Stephen ,et al.Differential response of lymphatic venous and arterial endothelial cells to angiopoietin-1 and angiopoietin-2[J]. BMC Cell Biology,2007,6:8-10.
[2] Weidner N, Semple JP, Welch WR, et al. Tumor angiogenesis and metastasis: correlation in invasive breast carcinoma[J].N Engl J Med 1991,324:1-8.
[3] Su JL, Shih JY, Yen ML,et al.Cyclooxygenase-2 induces EP1-and HER-2/ Neu- dependent vascular endothelial growth factor-C up-regulation: a novel mechanism of lymphangiogenesis in lung adenocarcinoma[J].Cancer Res,2004,64: 554-564.
[4] Ming-Xu Da, Xiao-Ting Wu, et al.Expression of Cyclooxygenase-2 and Vascular Endothelial Growth Factor-C Correlates with Lymphangiogenesis and Lymphatic Invasion in Human Gastric Cancer[J].Sci USA, 2008,12(1):92-99.
[5] Maisonpierre PC, Suri C, Jones PF, et al. Angiopoietin-2, a naturalantagonist for Tie2 that disrupts in vivo angiogenesis[J]. Sci,1997,277:55- 60.
[6] Michael Dellinger, Robert Hunter, Michael Bernas, et al. Defective remodeling and maturation of the lymphatic vasculature in Angiopoietin-2 deficient mice[J].Dev boil,2008,July,15(2) 319:309-320
[7] Paola pichiale,Juan C,Chavez et al.Hypoxic regulation of Angiopoietin-2 expression in endothelial cells.[J]Biol Chem 2004 279(13):12171-12180
[8] Wang J, Wu K, Bai F, et al.Celecoxib could reverse the hypoxia-induced Angiopoietin-2 upregulation in gastric cancer. Cancer Lett. 2006 Oct 8;242(1):20-27.
