紫杉醇同步放化疗对子宫内膜癌HEC-1A细胞系的抑制作用及其机理的初步研究
2010-01-25孔为民李丽英牛聚伟张卫华
李 静 孔为民 李丽英 牛聚伟 张卫华
子宫内膜癌特别是不能手术的中晚期(ⅢA~ⅣB期)子宫内膜癌患者的预后较差,因此,探讨更有效的治疗方法显得尤为必要。本研究探讨了顺铂或紫杉醇联合放射线同步作用对子宫内膜癌HEC-1A细胞系的抑制情况及其可能机制,为进一步动物体内实验和临床试验提供依据。
1 材料与方法
1.1 实验材料
子宫内膜癌HEC-1A细胞株系北京大学人民医院妇产科实验室惠赠。紫杉醇为注射液,为海口市制药厂有限公司产品。细胞培养基为美国Invitrogen Corporation 公司生产的GIBCO品牌的 DMEM高糖培养基。胎牛血清由德国Biochrom公司生产的特级胎牛血清。胰蛋白酶购于北京鼎国生物技术有限公司。噻唑蓝(MTT)由美国Amresco公司生产。RNA酶为美国Sigma 公司生产。碘化丙啶(PI)为美国Sigma 公司生产。酶联免疫检测仪系美国基因有限公司生产,型号ELX800。数字彩色图像照相机由德国Leica公司制造,型号DFC300FX。流式细胞仪为Beckman-Coulter公司生产的Coulter Eplcs XL流式细胞仪。
1.2 实验方法
1.2.1 细胞培养 人子宫内膜癌HEC-1A细胞株,培养于含10%胎牛血清、200 U/ml谷氨酰胺、100 U/ml青霉素及100 U/ml链霉素的DMEM高糖培养基中。用0.25%胰蛋白酶消化传代。取生长状态稳定、呈对数生长期细胞用于实验。实验共分为6个组:对照组,紫杉醇IC10浓度组,紫杉醇IC50浓度组,单纯放疗组,紫杉醇IC10浓度+放疗组,紫杉醇IC50浓度+放疗组。
1.2.2 紫杉醇作用 24 h的10%药物致死剂量(24 hIC10)及24 h的50%药物致死剂量(24 h IC50)的选择调整细胞浓度为5×104个/ml,以200μl/孔接种于96孔板,另设空白调零孔。于饱和湿度条件下5%CO237℃恒温培养箱中培养24 h后,紫杉醇按照终浓度2 μmol/L、4 μmol/L、8 μmol/L、12 μmol/L、16 μmol/L、20 μmol/L、24 μmol/L、28 μmol/L、32 μmol/L的浓度梯度,每孔加入各浓度化疗药物100 μl,每浓度设6个复孔,对照孔加入药物溶剂(0.9%氯化钠注射液)100μl。继续培养24 h后,采用MTT法测各孔光吸收值(OD值)。实验重复3次。
1.2.3 各组抑制率比较 消化离心HEC-1A 细胞,调整细胞浓度为5×104/ml,以200 μl/孔接种于96孔板,每组设6个复孔,另设空白调零孔。细胞培养24 h,加入相应浓度的化疗药物,另外放射线照射组加入相应浓度的化疗药物后立即行60Co射线照射,照射剂量为4 Gy。照射后继续在培养箱中培养。每48更换培养基,同时重新加入相应浓度的化疗药物。分别于24 h、48 h、72 h、96 h于倒置显微镜下,用型号为DFC300FX的数字彩色图像照相机,取每孔中心点视野拍摄细胞图片,观察细胞形态改变。 采用MTT法检测各组OD值。实验重复3次。
1.2.4 应用流式细胞技术比较各组细胞周期及细胞凋亡情况 将浓度为1×106/ml的细胞以2 ml/孔接种于6孔板,每组设3个复孔,另设对照孔。收集各处理组培养48 h的含药培养基及PBS洗液,消化离心细胞,加入终浓度为70%的-20℃酒精,-20℃过夜固定,离心弃酒精,加1 ml RNA酶A(终浓度为100 μg/ml),置于37℃培养30 min,加0.1 ml碘化丙啶(PI)(终浓度为50 μg/ml)避光染色至少30 min,应用流式细胞仪检测细胞周期和凋亡。
1.3 统计学处理
相对抑制率(%)=1-(实验组OD值-空白调零组OD值)/(对照组OD值-空白调零组OD值)。应用SPSS13.0统计软件包,概率分析法计算IC10值及IC50值,采用t检验比较各组的OD值及抑制率。应用EXPO32 ADC 1.1C统计软件分析流式细胞仪检测结果。
2 结果
2.1 紫杉醇对HEC-1A细胞作用24 h的IC10值及IC50值
应用MTT法检测,采用SPSS概率法计算,紫杉醇对HEC-1A细胞系作用24 h后的IC10值及IC50值分别为5.87[95%可信区间(4.28,7.28)]及13.83[(95%可信区间(12.18,15.25)]。不同浓度梯度的紫杉醇作用于子宫内膜癌HEC-1A细胞株24 h后的OD值及抑制率见表1。不同浓度紫杉醇抑制率曲线见图1。

表1 紫杉醇各浓度的OD值及抑制率

图1 不同浓度紫杉醇抑制率曲线图
2.2 各组细胞的形态学改变
肉眼见培养基颜色随培养时间延长逐渐变黄。低倍(10×10倍)倒置显微镜下可见到经放化疗作用后细胞逐渐出现皱缩、变圆、脱落。并随用时间延长,被破坏的细胞增多。高倍(10×20倍)倒置显微镜下可见部分细胞体积改变,细胞内出现空泡,细胞结构破坏,裂解成碎片。
2.3 不同浓度紫杉醇及放疗不同时间对HEC-1A细胞的抑制作用
单纯放疗组、紫杉醇IC10浓度+放疗组、紫杉醇IC50浓度+放疗组作用于HEC-1A细胞24 h、48 h、72 h、96 h OD值及抑制率见表2。
2.4 各组48细胞周期改变及凋亡情况
经流式细胞仪分析,对照组、紫杉醇IC10浓度组、紫杉醇IC50浓度组、单纯放疗组、紫杉醇IC10浓度+放疗组和紫杉醇IC50浓度+放疗组48 h S期和G2期细胞比例及凋亡细胞比例见表3。
3 讨论
由于放射治疗是对老年患者或合并有严重内科疾患不能接受手术治疗或有手术禁忌证的子宫内膜癌患者的重要治疗方法,而子宫内膜癌对放射线的敏感性又相对差于宫颈癌[1],因此,对同步放化疗能否提高放射线对子宫内膜癌细胞的抑制作用,从而提高不能手术的子宫内膜癌患者的治疗效果的研究具有重要意义。
3.1 紫杉醇同步放化疗对子宫内膜癌的抑制作用
经临床研究发现,紫杉醇用于宫颈癌的同步放化疗已初步证实具有良好疗效[2]。紫杉醇作为1种新型的抗肿瘤药,对各种进展期的人子宫内膜癌有缓解作用,在人子宫内膜癌的有效率最高可达80%[3]。目前仅有很少关于子宫内膜癌同步放化疗(CRT)的临床试验研究。RTOG-9708试验[4]研究证实对内膜癌患者放疗同时予顺铂50 mg/m2,第1天,第28天的方案可行,其局部控制效果较好,放化疗疗效具有增加效果,但是仍发生远处转移,其远期疗效尚待进一步随机试验研究证实。Kelly等[5]的研究结果表明子宫内膜癌术后铂类盆腔同步放化疗,与术后传统放疗比较,ⅢC期以下癌,同步放化疗优于传统放疗,ⅢC期及以上的晚期癌,同步放化疗与传统放疗无差异。GOG-9907研究[6]报道顺铂(25 mg/m2)加紫杉醇(20 mg/m2)周疗同时予全腹外照射方案可行,但是有中度的急性及慢性胃肠道反应。从以上几个临床试验的初步结果可以看出,子宫内膜癌的同步放化疗似乎有效,但其疗效尚缺乏实验研究的证据。本实验研究结果表明小剂量(24 h IC10浓度)的紫杉醇能够增加放射线对子宫内膜癌HEC-1A细胞的抑制作用;大剂量(24 h IC10浓度)的紫杉醇与放射线对子宫内膜癌HEC-1A细胞具有更强的抑制作用。研究结果从体外实验角度证实了紫杉醇同步放化疗对子宫内膜癌HEC-1A细胞系有协同抑制作用。
3.2 紫杉醇或顺铂同步放化疗协同抑癌作用机理
本实验提示小剂量紫杉醇与放射线的协同作用机制可能主要与其能够使细胞周期停滞于G2期,从而增加细胞对放射线的敏感性有关。Randall等[7]的研究发现,紫杉醇对卵巢癌细胞的抑制作用与其能够诱导凋亡相关。Carlos[8]报道,紫杉醇对前列腺癌的抑制作用主要是使细胞停滞于G2/M期,从而诱导细胞凋亡,与本实验结论一致。本实验研究发现,随着紫杉醇剂量的增加,停滞于G2期的细胞比例增加,但是凋亡细胞比例没有明显增加,分析可能是由于本实验检测的为晚期凋亡细胞比例,不除外检测时细胞还处于凋亡早中期,DNA还没有从细胞内漏出,从而不能在检测图中体现出来。

表2 各组不同时间OD值及抑制率比较
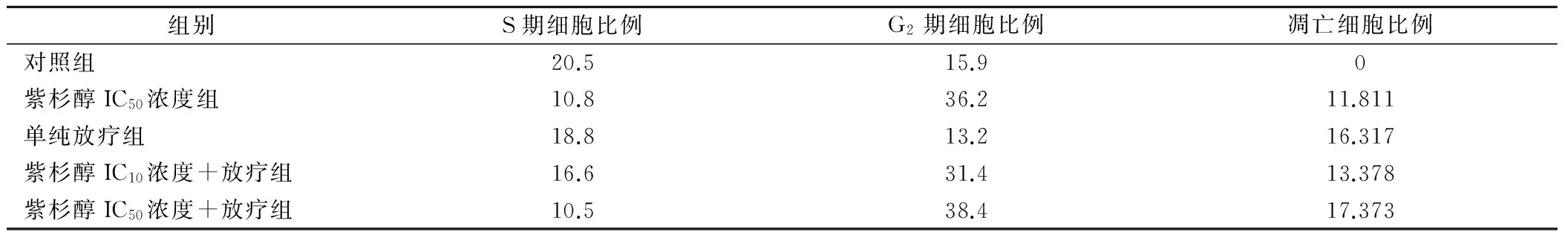
表3 各组48 h S期和G2期细胞比例及凋亡细胞比例(%)
总之,目前,关于子宫内膜癌的同步放化疗的国内外相关文献报道较少,我们的体外实验研究结果提示紫杉醇同步放化疗对子宫内膜癌HEC-1A细胞具有协同抑制作用,其作用机理是小剂量或大剂量紫杉醇能够使细胞周期停滞于G2期,使细胞对放射线的敏感性增加。其疗效及作用机理尚待进一步体内实验及临床试验研究证实。
[1] 盛修贵,梁 克,孙建衡,等.人子宫内膜癌裸小鼠移植瘤放射敏感性的测定〔J〕.中华放射肿瘤杂志,1998,7(3):182.
[2] Lee MY,Wu HG,Kim K,et al.Concurrent radiotherapy with pclitaxel/ carboplatin chemotherapy as a definitive treatment for squamous cell carcinoma of the uterine cervix〔J〕.Gynecol Oncol,2007,104(1):95.
[3] Lane DP.A death in life of p53〔J〕.Nature,1993,362:786.
[4] Greven K,Winter K,Underhill K,et al.Final analysis of RT-OG 9708:adjuvant postoperative irradiation combined with cisplatin/paclitaxel chemotherapy following surgery for patients with high-risk endometrial cancer〔J〕.Gynecol Oncol,2006,103(1):155.
[5] Kelly MG,O’Malley D,Hui P,et al.Patients with uterine papillary serous cancers may benefit from adjuvant platinum - based chemoradiation〔J〕.Gynecol Oncol,2004,95(3):469.
[6] McMeekin DS,Walker JJ,Hartenbach EM,et al.Phase I trial of the treatment of high-risk endometrial cancer with concurrent weekly paclitaxel and cisplatin and whole abdominal radiation therapy:A Gynecologic Oncology Group study〔J〕.Gynecol Oncol,2009,112(1):134.
[7] Randall K Gibb,Douglas D Taylor,Tina Wan,et al.Apoptosis as a measure of chemosensitivity to cisplatin and taxol therapy in ovarian cancer cell lines〔J〕.Gynecologic Oncology,1997,6(1):13.
[8] Carlos Perez-Stable.2-Methoxyestradiol and paclitaxel have s-imilar effects on the cell cycle and induction of apoptosis in prostate cancer cells〔J〕.Cancer Letters,2006,231(1):49.
