先天性巨结肠乳鼠模型的建立和评价
2010-01-25王玲朝王春晖王宝西
王玲朝 王春晖 江 逊 林 燕 王宝西
先天性巨结肠(hirschsprung's disease,HD)是病变结肠神经节细胞缺如的一种肠道发育畸形,其病因尚未阐明[1],目前认为是遗传及环境多种因素综合所致[2]。HD发病率约为1/5 000,男∶女为4∶1。HD主要病理改变为病变结肠段神经节细胞缺如,病变结肠持续性痉挛、狭窄,近端肠腔扩张,内容物潴留。HD新生儿可表现为胎粪排出延迟和肠梗阻等症状,婴儿及成人可表现为严重的便秘和腹胀,常合并小肠结肠炎、低位性肠梗阻,严重影响生活质量甚至危及生命[2~4]。
由于直接进行人体研究受到伦理学限制,Sato等[5]于1978年首先用苯扎氯铵(BAC)选择性损毁鼠肠神经节细胞成功建立大鼠巨结肠模型,之后该模型被广泛应用于损毁神经方面的研究。Yoneda等[6]于2002年用BAC建立了小鼠巨结肠模型。目前应用于HD研究的动物模型有花斑致死鼠和致死斑点鼠[7],该模型与人类HD的病理学改变非常相似,但其培育困难,早期常死于严重的小肠结肠炎,存活时间短,不利于长期观察研究。既往用BAC建立的大鼠和小鼠模型,是在大鼠和小鼠肠道神经系统已经发育健全的基础上建立的,不符合HD的发病微环境。6~7日龄乳鼠肠道神经系统发育尚不健全且接近于胚胎时期[8],用6~7日龄乳鼠建立的模型更接近于HD的发病微环境。本研究以乳鼠制备HD模型,并进行模型评价,为进一步深入研究HD及其相关并发症的病因、病理机制、生理机制、病程演变特征及以Cajal间质细胞(ICC)为靶点治疗HD奠定实验基础。
1 方法
1.1 动物和试剂 6~7日龄SD乳鼠9窝,每窝10只[由第四军医大学动物中心提供,生产许可证:SCXK(陕)2008-002],乳鼠由母鼠喂养,母鼠采用二级鼠料喂养,动物饲养和实验均遵照第四军医大学实验动物饲养与使用规定。主要试剂:BAC(Sigma公司);兔抗大鼠S-100蛋白多克隆抗体、兔抗大鼠NSE多克隆抗体、兔抗大鼠c-Kit多克隆抗体和羊抗兔FITC-IgG(均购自Boster公司)。
1.2 分组和HD模型建立 将9窝乳鼠从1~9编号,从随机数字表第5行第8列开始依次读取1位数作为随机数,录于编号下,将全部随机数从小至大编序号,规定序号1~3为实验组,4~6为对照组,7~9为正常组,各组均为3窝。实验组术前将4~5日龄SD乳鼠在第四军医大学动物中心适应性饲养2 d。乙醚麻醉,在无菌条件下行下腹部正中切口,提取降结肠(图1),在其肠系膜的无血管区,将0.1%BAC溶液浸泡过的滤纸条(0.8 cm×1 cm)紧贴肠壁环形包绕结肠1周,每5 min滴加0.1%BAC溶液100 μL于滤纸上,保持滤纸湿润。15 min后移去滤纸条,用温生理盐水棉球蘸洗结肠及腹腔,回纳肠管,丝线缝合关腹。对照组用生理盐水代替0.1%BAC溶液处理降结肠15 min,操作同实验组。正常组不做任何处理。术后母鼠喂养,每笼1窝分笼饲养。
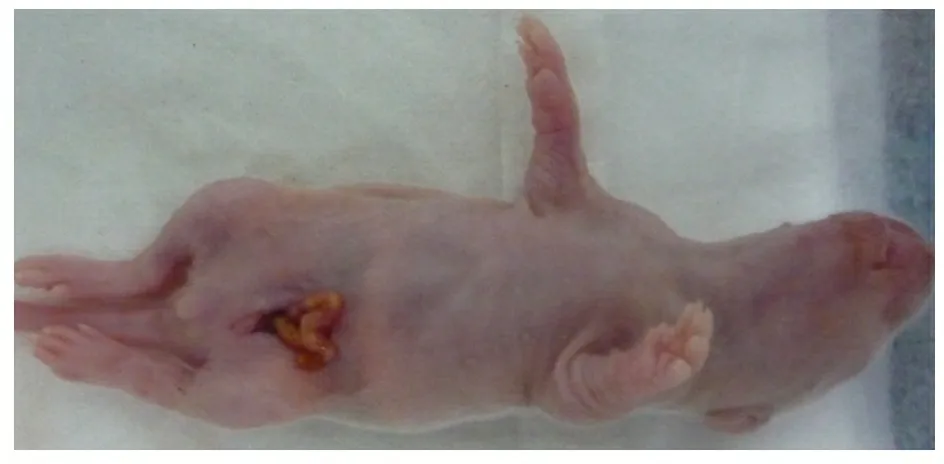
图1 先天性巨结肠制备外观模型
Fig 1 Hirschsprung's disease neonatal rat model
Notes Neonatal rat abdominal midline incision to show descending colon
1.3 模型评价 术后每周观察乳鼠生活习性、饮食、排便情况及有无腹胀。术后1、3、5、6和7周每组任意取4只乳鼠处死,实验组取BAC处理段结肠,对照组取生理盐水处理段结肠,正常组取远端结肠,生理盐水冲洗肠腔,观察各组结肠大体形态。
组织病理学检查:各组结肠沿肠系膜缘纵行剪开,在滤纸上将肠壁展开,固定和编号。肠管用10%甲醛缓冲液固定24 h后取材。石蜡包埋、切片,行苏木精-伊红染色。光镜下观察各组结肠神经节细胞的病理学改变。
免疫组化检测:以SABC法检测各组结肠神经节细胞S-100蛋白和神经细胞特异性烯醇化酶(NSE)表达。石蜡切片常规脱蜡至水,组织抗原微波修复(柠檬酸盐修复液)正常羊血清封闭,滴加兔抗大鼠S-100蛋白多克隆抗体(1∶200),37℃孵育1 h,PBS液冲洗3次,每次2 min,滴加SABC试剂,37℃孵育20 min,PBS洗5 min,共4次,使用DAB显色试剂盒,取1 mL蒸馏水,加入试剂盒中A、B、C试剂各1滴,混匀后加至切片。室温显色,镜下控制反应时间为20 min,蒸馏水洗涤。用PBS代替一抗作阴性对照。NSE的检测方法同S-100蛋白。
免疫荧光检测:以c-Kit免疫荧光检测各组结肠ICC的分布和表达。石蜡切片常规脱蜡至水,组织抗原微波修复(柠檬酸盐修复液)正常羊血清封闭。滴加兔抗大鼠c-Kit多克隆抗体(1∶100),37℃孵育1 h,PBS液冲洗3次,每次5 min。再滴加羊抗兔FITC-IgG(1∶200),37℃孵育1 h,PBS液冲洗3次,每次5 min。甘油封片,用PBS代替一抗作阴性对照,激光共聚焦显微镜观察结果。
2 结果
实验组乳鼠死亡5只,其中术后1 h被母鼠啃食2只,术后1 d肠管被BAC腐蚀死亡1只,术后3 d感染死亡1只,7周后肠穿孔死亡1只。对照组乳鼠术后1 h被母鼠啃食1只。正常组乳鼠无死亡。
2.1 一般情况和大体结肠形态学观察 术后1~3周实验组和对照组乳鼠手术伤口愈合良好,吃奶及粪便正常,正常组未见异常表现。实验组:术后4周3只出现腹胀;术后5周10只出现腹胀,排便减少,粪便颗粒性状改变不明显;术后6周12只出现腹胀,排便减少,较对照组和正常组粪便颗粒变大。
处死后大体解剖可见BAC处理段结肠狭窄。术后7周实验组均出现不同程度的排便减少,腹胀,精神萎靡,消瘦,粪便颗粒较对照组和正常组干燥且明显变大,处死后大体解剖可见BAC处理段结肠肠管狭窄、痉挛,无蠕动,病变近端肠管扩张,肠腔内容物潴留(图2)。对照组和正常组结肠未见明显异常。
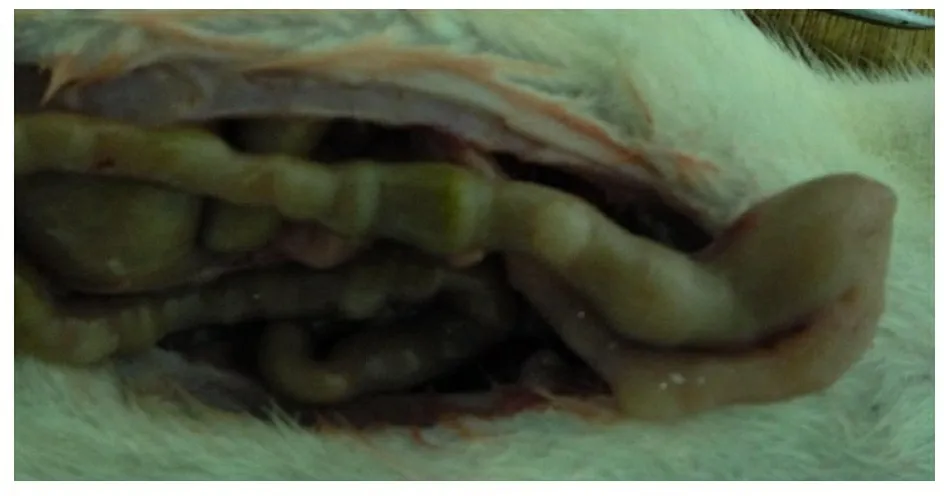
图2 实验组术后7周大体解剖BAC处理段结肠所见
Fig 2 Autopsy of experimental rats 7 weeks after BAC treatment
Notes 7 weeks after BAC treatment,a narrowed segment at the site of BAC treatment,accompanied by distended proximal colon filled with massive feces
2.2 病理学检查结果 正常组远端结肠和对照组生理盐水处理段结肠可见正常的肌间及黏膜下神经节细胞,正常组见图3A。实验组术后1、3周BAC处理段结肠肌间及黏膜下神经节细胞与对照组比较减少不明显(图3B,C),术后5、6周可见神经节细胞数量逐渐减少、体积逐渐变小(图3D,E),术后7周神经节细胞完全消失,肠壁其他结构完整,未发现瘢痕形成及炎症细胞浸润(图3F)。
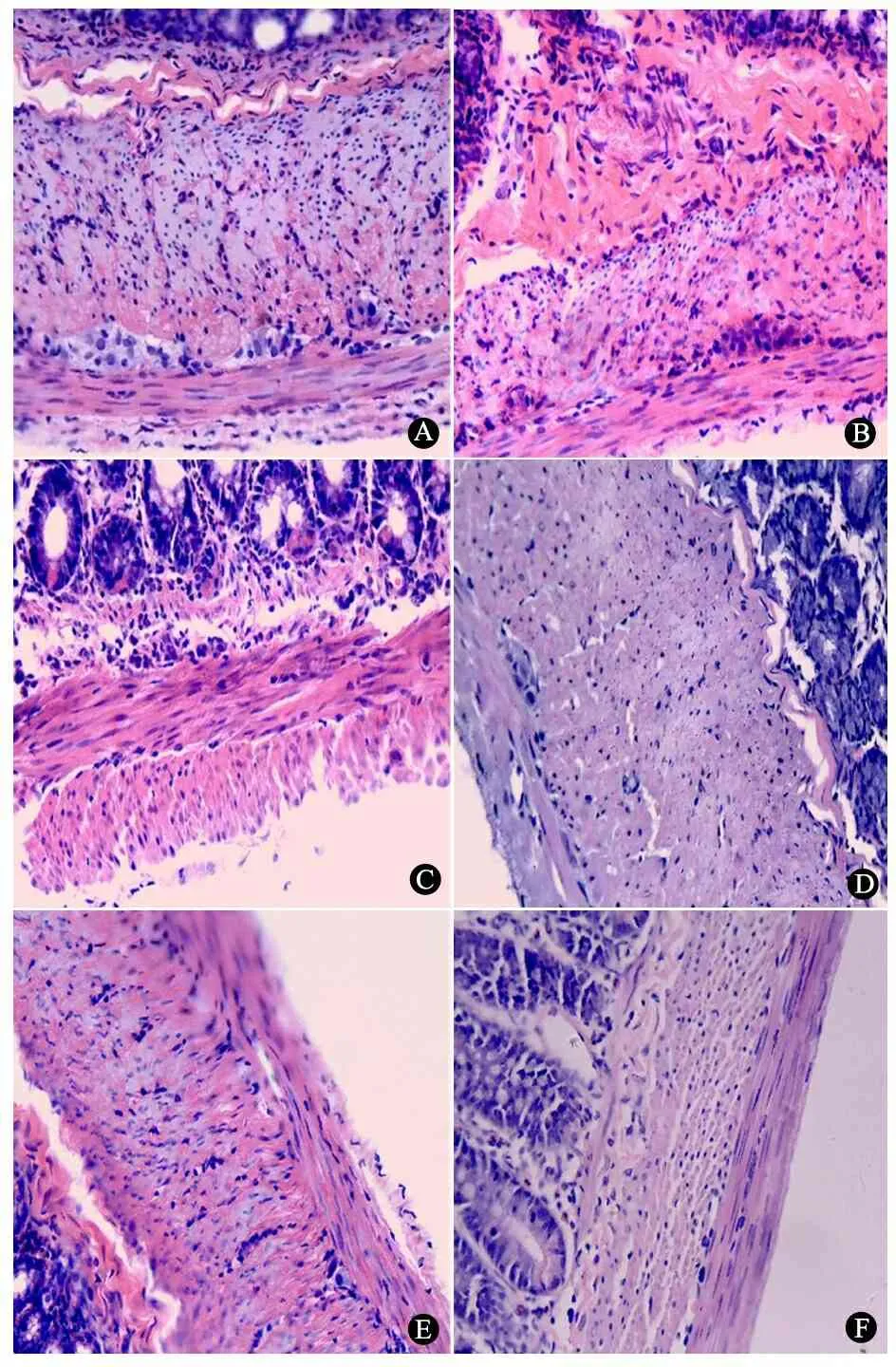
图3 正常组和实验组结肠组织病理学检查(苏木精-伊红染色,×100)
Fig 3 Pathology of normal and experimental group rats(HE,×100)
Notes A:Normal ganglion cells of the normal group;B:1 week after BAC treatment,ganglion cells had no significant changes;C:3 weeks after BAC treatment,ganglion cells decreased;D:5 weeks after BAC treatment,ganglion cells decreased in the number and the size;E:6 weeks after BAC treatment,ganglion cells decreased obviously in the number and the size;F: 7 weeks after BAC treatment,ganglion cells in the myenteric and submucous plexuses completely disappeared
2.3 S-100蛋白和NSE的表达 正常组远端结肠和对照组生理盐水处理段结肠S-100蛋白表达在神经节细胞的胞质和胞核中,两组差异不明显,正常组见图4A。实验组术后1、3周BAC处理段结肠肌间及黏膜下神经节细胞S-100蛋白的表达与对照组比较减少不明显(图4B,C),术后5、6周神经节细胞S-100蛋白表达逐渐减少、神经节体积逐渐变小(图4D,E),术后7周S-100蛋白表达完全消失(图4F)。
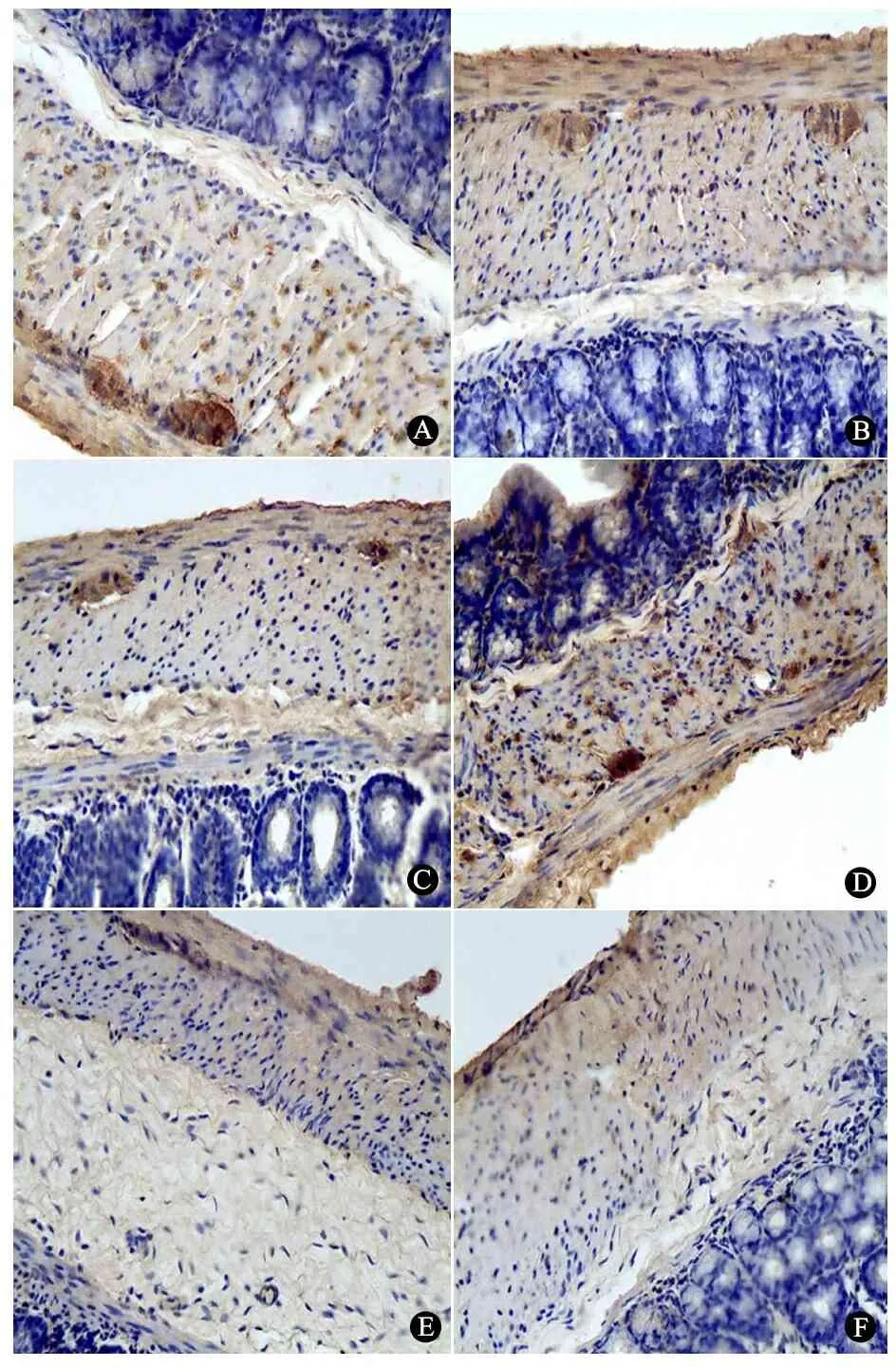
图4 S-100蛋白在正常组和实验组结肠组织的表达(免疫组化,×100)
Fig 4 The expression of S-100 protein in normal and experimental group rats(immunohistochemistry,×100)
Notes A:Normal ganglion cells appeared as brown particles in the normal group;B:1 week after BAC treatment,ganglion cells had no significant changes;C:3 weeks after BAC treatment,ganglion cells decreased;D:5 weeks after BAC treatment,ganglion cells decreased in the number and the size;E:6 weeks after BAC treatment,ganglion cells decreased obviously in the number and the size;F:7 weeks after BAC treatment,ganglion cells completely disappeared
正常组远端结肠和对照组生理盐水处理段结肠组织NSE表达在神经节细胞的胞核中,两组表达差异不明显,正常组见图5A。实验组术后1、3周BAC处理段结肠肌间及黏膜下神经节细胞NSE的表达与对照组比较无明显改变(图5B,C),术后5、6周神经节细胞NSE表达逐渐减少、神经节细胞体积逐渐变小(图5D,E),术后7周神经节细胞NSE表达完全消失(图5F)。
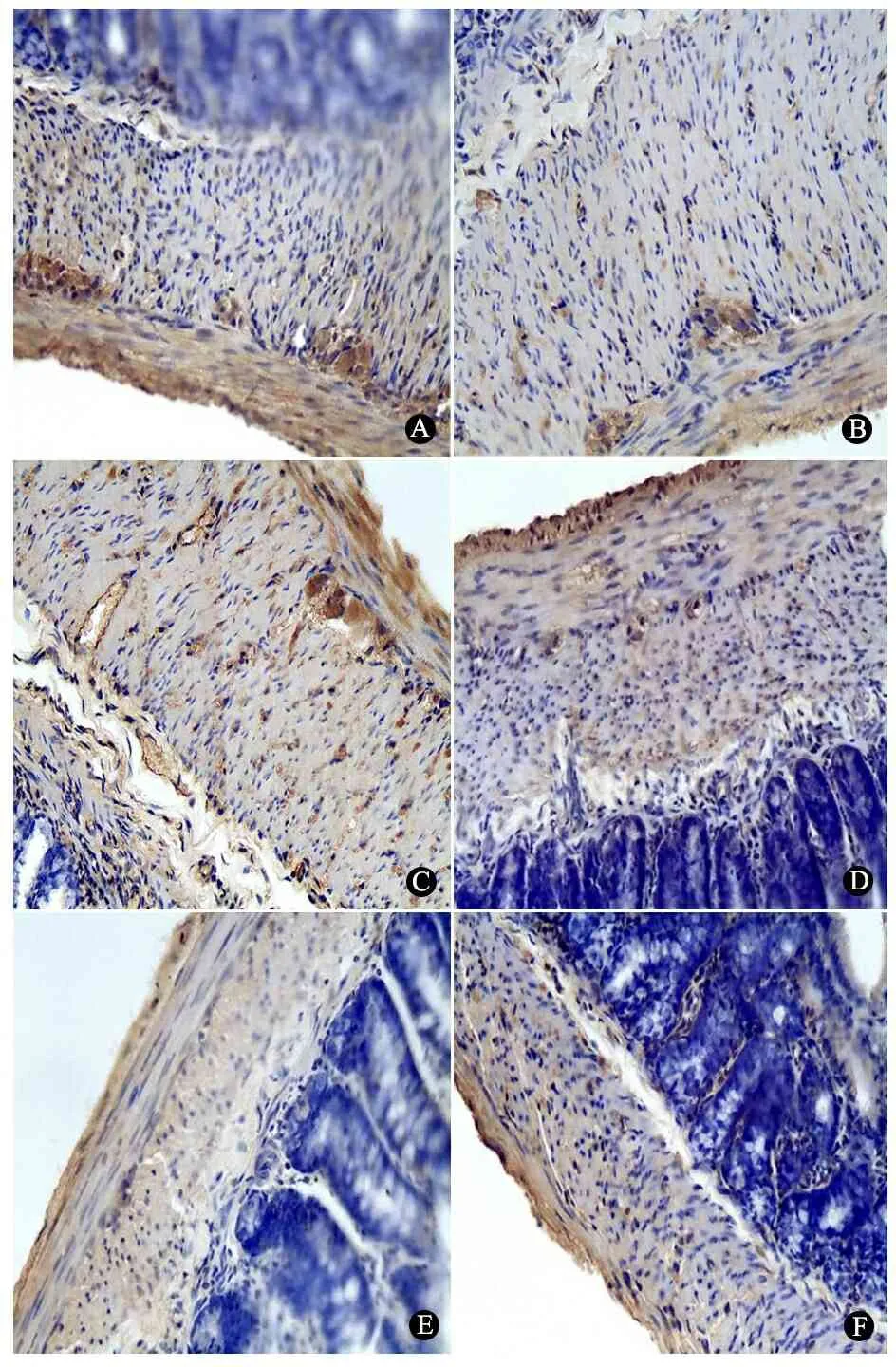
图5 NSE在正常组和实验组结肠组织的表达(免疫组化,×100)
Fig 5 The expression of NSE in normal and experimental group rats(immunohistochemistry,×100)
Notes A:Normal ganglion cells appeared as brown particles in the normal group;B:1 week after BAC treatment,ganglion cells had no significant changes;C:3 weeks after BAC treatment,ganglion cells decreased;D:5 weeks after BAC treatment,ganglion cells decreased in the number and the size;E:6 weeks after BAC treatment,ganglion cells decreased obviously in the number and the size;F:7 weeks after BAC treatment,ganglion cells completely disappeared
2.4 免疫荧光检测c-Kit的表达 正常组远端结肠和对照组处理段结肠ICC的分布和形态相似,差异不明显,ICC在切面上几乎呈现连续性分布,相互连接形成网络状结构,正常ICC多呈纺锤形,有2~3条突起,正常组ICC的分布和形态见图6A。术后1周实验组BAC处理段结肠c-Kit的表达与正常组较为接近(图6B),术后3、5、6和7周c-Kit的表达逐渐减少,提示ICC在BAC处理段结肠的分布明显减少,ICC分布均较对照组和正常组明显减少,网络状结构受到破坏,形态也出现异常,表现为突起变短、变钝(图6C~F)。
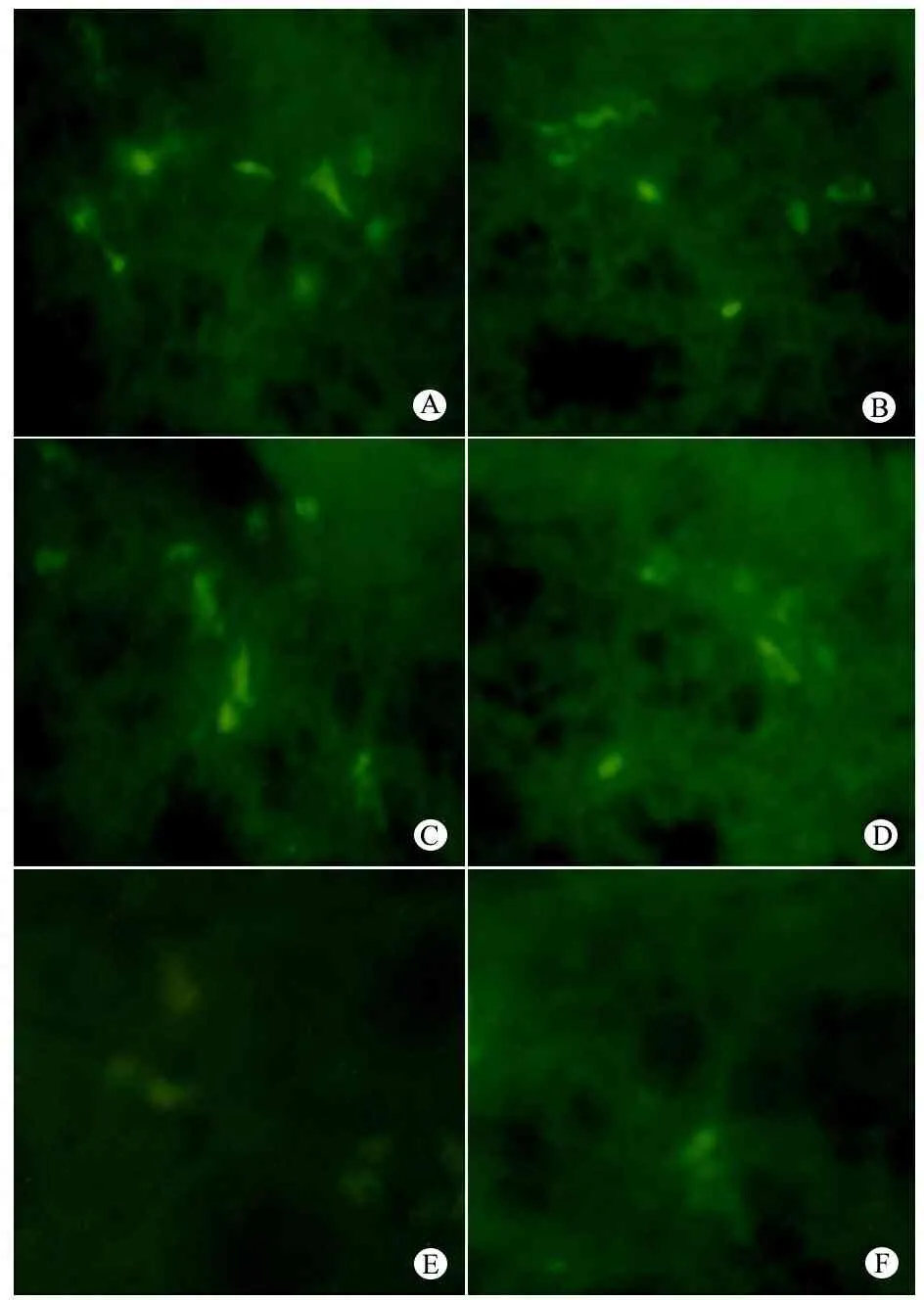
图6 正常组和实验组结肠组织c-Kit的表达(免疫荧光, ×200)
Fig 6 The expression of c-Kit in normal and experimental group rats(immunofluorescence,×200)
Notes A:Normal ICC of normal group; B:ICC 1 week after BAC treatment had no significant changes;C:ICC 3 weeks after BAC treatment decreased,D:ICC 5 weeks after BAC treatment decreased obviously,the network was disappeared;E:ICC 6 weeks after BAC treatment decreased obviously,the network was disappeared,and the configuration was abnormal;F:ICC 7 weeks after BAC treatment,decreased obviously,the network was disappeared,and the configuration was abnormal,the ICC got blunted and short processes
3 讨论
研究发现,HD与ICC的减少有密切关系[9]。Rolle等[10]发现HD患者结肠肠管的肌间ICC比正常对照组显著减少。王宝西等[11]研究发现ICC分布减少和形态异常可导致HD的发生。HD患儿由于病变结肠肠壁缺少神经节细胞使肠壁痉挛、肠腔狭窄,使粪便滞留在近端结肠,该段肠管继发性扩张、肥厚,形成巨结肠。因此选择性损毁结肠肌间及黏膜下神经节细胞是制备HD动物模型的理论依据。BAC选择性损伤肠神经节细胞的机制可能是BAC长分子链与神经轴突膜活性基团多个位点结合并注入膜内,引起膜肿胀,离子自由进入膜内,进而引起膜的去极化,导致动作电位和静息电位快速和不可逆地减小。当BAC作用于结肠壁时,膜电位比平滑肌细胞低的神经细胞易受到损伤,从而选择性地损伤神经细胞,而不损伤其他细胞组织[12]。中国学者也用该方法成功地建立了成年动物HD模型[13~15],但各研究中BAC浓度、作用时间、作用肠段长度,模型完成所需时间及所采用动物有所不同。本研究采用0.1%BAC作用在1 cm的乳鼠结肠段15 min,术后7周神经节细胞完全消失,提示模型建立成功。
在预实验中术后乳鼠存活率仅为50%,多在术后3 d内死亡,主要原因为:人为的异味及血迹造成母鼠啃食乳鼠;手术不熟练致使乳鼠手术损伤加重;术后乳鼠对新环境不适应;术中和术后乳鼠体温降低;清洗腹腔不彻底使BAC腐蚀乳鼠腹腔其他脏器;术后切口感染等。通过总结,采取术前乳鼠在饲养室适应1~2 d新环境;熟练手术步骤,做到快、准、轻和细,尽量减少对乳鼠的创伤;尽量减少BAC渗入腹腔;术中和术后加强对乳鼠保暖;术后给乳鼠体表涂抹适量母鼠尿液,覆盖人为异味;术中严格无菌操作,术后切口涂适量青霉素粉剂预防感染等措施使乳鼠存活率明显提高。
本研究发现ICC在实验组和对照组的分布、数量和形态上均有差异。实验组术后3~7周ICC的数量明显减少,残存ICC突起变短、变钝,连续网络结构破坏,与HD患儿结肠狭窄段神经节细胞和ICC改变的特点相一致[16]。ICC是一种特殊类型的间质细胞,广泛分布于消化道,是胃肠慢波活动的起搏器和传导细胞,也是肠神经作用的首要靶细胞[17]。ICC的基因表达产物c-Kit对于ICC表型的发育和维持是必需的,因此c-Kit成为胃肠道ICC的特异性标志物。可表达于ICC、肥大细胞及造血细胞等多种细胞[18]。在胃肠道组织中只有ICC和肥大细胞表达c-Kit,从而有较高的特异性[19],c-Kit 受体被广泛用于胃肠道ICC的鉴定[20]。肥大细胞数量很少,且其细胞形态很容易和ICC区分[21],因此,本研究应用c-Kit特异性抗体和形态学的方法鉴定ICC,c-Kit表达减少,提示ICC的减少。
本研究用6~7日龄乳鼠成功建立HD模型,模型建立后实验组乳鼠出现排便减少,腹胀,精神萎靡,消瘦,体重减轻,粪便颗粒变干和变大。大体解剖发现BAC处理段肠管狭窄、痉挛,无蠕动,病变近端肠管扩张,肠腔内容物潴留。NSE和S-100蛋白表达逐渐减少至消失,表明神经节细胞逐渐减少至消失,c-Kit的表达逐渐减少;提示模型建立成功。
本研究的不足之处和局限性:①技术方法不完善,未能使用免疫组化双标及多标术使各组的神经节细胞、ICC共同显色,以使结果更严谨和直观;②未从分子生物学方面研究模型的特性。
[1]Zhou MN(周妙妮),Zhang CN,Li JC.Research progress of molecular genetic pathogenesis of Hirschsprung disease.International Journal of Genetics(国际遗传学杂志),2007,30(3):217-220
[2]de Lorijn F, Boeckxstaens GE, Benninga MA. Sympto-matology,pathophysiology,diagnostic work-up,and treatment of Hirschsprung's disease in infancy and childhood.Curr Gastroenterol Rep,2007,9(3):245-253
[3]Chen F, Winston JH, Jain SK, et al.Hirschsprung′s disease in a young adult: report of a case and review of the literature. Ann Diagn Pathol,2006,10(6):347-351
[4]Kessmann J.Hirschsprung's disease:diagnosis and management.Am Fam Physician,2006,74(8):1319-1322
[5]Sato A,Yamamoto M,Imamura K,et al.Pathophysiology of aganglionic colon and anorectum:an experimental study on a ganglionosis produced by a new method in the rat.J Pediatr Surg,1978,13(4):399-435
[6]Yoneda A, Shima H, Nemeth L, et al.Selective chemical ablation of the enteric plexus in mice.Pediatr Surg Int,2002,18(4):234-237
[7]Robertson K, Mason I, Hall S. Hirschsprung′s disease: genetic mutations in mice and men. Gut,1997,41(4):436-441
[8]Burns AJ, Roberts RR, Bornstein JC, et al.Development of the enteric nervous system and its role in intestinal motility during fetal and early postnatal stages.Semin Pediatr Surg, 2009, 18(4):196-205
[9]Hou Y(侯豫),Yang Y,Zhao X,et al.Expression of glial cell derived neurotrophic factor in Hirschsprung′s disease.J Appl Clin Pediatr(实用儿科临床杂志),2008,23(7):507-509
[10]Rolle U, Piotrowska AP, Nemeth L, et al.Altered distribution of interstitial cells of Cajal in Hirschsprung disease. Arch Pathol Lab Med,2002,126(8):928-933
[11]Wang BX(王宝西),Hou Y,Yang Y.Expression and distribution of glial cell derived neurotrophic factor,interstitial cells of Cajal and Connexin 43 in Hirschsprung′s disease.Chin J Evid Based Pediatr(中国循证儿科杂志),2009,11(3):333-339
[12]Levin RJ.Actions of spermicidal and virucidal agents on electrogenic ion transfer across human vaginal epithelium in vitro.Pharmacol Toxicol,1997,81(5):219-225
[13]Xu JR(徐纪荣),Jing XQ,Chen XZ.Establishment of experimental aganglionosis model and observation of its biological features in rat.Journal of Chongqing Medical University (重庆医科大学学报),2005,30 (4):594-597
[14]Liu W(刘伟),Wu RD,Dong YL,et al.An animal model of aganglional megacolon.Chin J Pediatr Surg(中华小儿外科杂志),2007,28(4):208-210
[15]Shu XG(舒晓刚),Chen JB,Wang GB,et al.Establishment and biological characteristics of aganglionosis mouse model.Chin J Exp Surg (中华实验外科杂志),2008,25(5):671-672
[16]Rumessen JJ.Ultrastructure of interstitial cells of Cajal at the colonic submuscular border in patients with ulcerative colitis.Gastroenterology,1996,111(6):1447-1455
[17]Seki K,Komuro T.Immunocytochemical demonstration of the gap junction proteins connexin 43 and connexin 45 in the musculature of the rat small intestine.Cell Tissue Res,2001,306(3):417-422
[18]Luo M(罗曼),Li HF.Expression of c-Kit tyrosine receptor and intercellular adhesion molecule-1 in endometriosis.China Journal of Modern Medicine(现代医学杂志),2008,18(11):1571-1574
[19]Streutker CJ, Huizinga JD, Driman DK, et al.Interstitial cells of Cajal in health and disease.Part I:Normal ICC structure and function with associated motility disorders.Histopathology,2007,50(2):176-189
[20]Vannucchi MG.Receptors in interstitial cells of Cajal: identification and possible physiological roles.Microsc Res Tech,1999,47(5):325-335
[21]Yan JA(鄢俊安),Song B.Research on ICC-like Cells of Bladder.Progress in Modern Biomedicine(现代生物医学进展),2009,9(3):598-600
