胃癌组织中GHR的表达与组织分化相关性的研究
2010-01-24李苏宜
袁 媛, 李苏宜
基于对肿瘤生物学理解的加深和新的治疗策略的不断涌现,晚期癌症的治疗取得了重大的进展。但即便如此,极高比例的晚期恶性肿瘤患者仍将面对致死性的不良预后,其主要原因是恶病质与营养不良。重组人生长激素(recombinant human growth hormone,rhGH)因具有促进蛋白质合成、增加机体瘦组织、改善机体免疫功能及降低应激反应的作用,现已广泛应用于外科围手术期的代谢调节。应用rhGH后是否会促进肿瘤的增殖、转移和复发尚存在争议。由于生长激素受体(growth hormone receptor,
GHR)是生长激素(GH)作用的生理基础,本研究旨在通过检测GHR在胃癌组织中的表达,以探讨其与胃癌临床病理特征的关系,为GH应用于胃癌代谢调节的临床可行性提供理论依据。
1 资料与方法
1.1 一般资料 选取徐州市中心医院2008年1月至2008年3月行胃癌根治术的32例胃癌患者的术后病理标本,男25例,女7例;年龄30~84岁,中位年龄62岁,其中≤60岁15例,>60岁17例。早期胃癌4例,进展期胃癌28例;高分化癌及印戒细胞癌各3例,中分化及低分化癌各13例。并选取正常胃黏膜组织标本7例。
1.2 主要试剂 鼠抗人GHR单克隆抗体(Mab263)购自英国Serotec公司,生物素标记抗鼠免疫球蛋白及酶底物显色剂DAB均购自福州迈新公司。
1.3 实验方法 采用免疫组化SP法:(1)石蜡块切片(3~4 μm),贴片,烤片,二甲苯脱蜡至水,PBS冲洗(3 min×3);(2)柠檬酸盐抗原修复液,微波高火加热10 min,PBS冲洗(3 min×3);(3)免疫组化染色按SP法常规流程进行(Mab263以1∶100稀释);(4)滴加新鲜配制的DAB溶液,显微镜下观察显色反应及程度;(5)蒸馏水冲洗,苏木素浅染,自来水冲洗还蓝,梯度乙醇脱水干燥,二甲苯透明,中性树胶封固。每一标本均以一张相同组织切片备份作为空白对照,以PBS代替一抗,其余操作流程完全相同。
1.4 阳性结果判断 应用Olympus BX50多头显微镜及北京天地公司的病理细胞图像分析仪对切片进行观察和细胞计数。以细胞膜、细胞质和细胞核出现棕黄色染色颗粒为阳性。根据组织切片着色的范围和强度,以阳性细胞百分比表示结果:切片无染色反映或染色细胞计数<25%为阴性(-);阳性细胞数≥25%为阳性,其中阳性细胞数25%~50%为弱阳性(+),51%~75%为中度阳性 (++),>75%为强阳性(+++)。
1.5 统计学处理 对实验数据用R×C表Fisher′s Exact Test 进行分析,以P<0.05为差异有统计学意义。
2 结果
GHR在胃癌及正常胃黏膜组织细胞中定位于细胞膜、细胞质和细胞核,以细胞质染色多见。免疫组化染色阳性产物呈棕黄色颗粒,间质未见阳性染色,各PBS空白对照切片均无阳性染色。见图1、2。
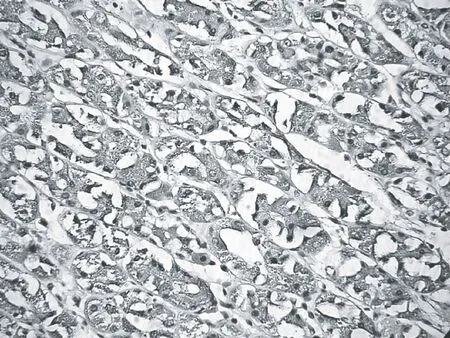
图1 正常胃黏膜组织GHR高表达
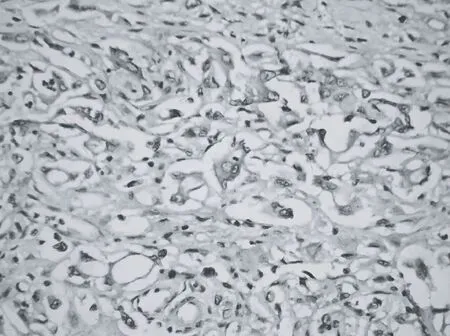
图2 胃癌组织GHR高表达
胃癌组织GHR的表达与性别、年龄无关(见表1)。正常胃黏膜组织GHR表达阳性率高于胃癌组织(P=0.038),且GHR表达强度较高(见表2)。肿瘤组织分化越好GHR表达阳性率越高(P=0.036),且GHR表达强度较高;而GHR表达与疾病分期无关(见表3)。
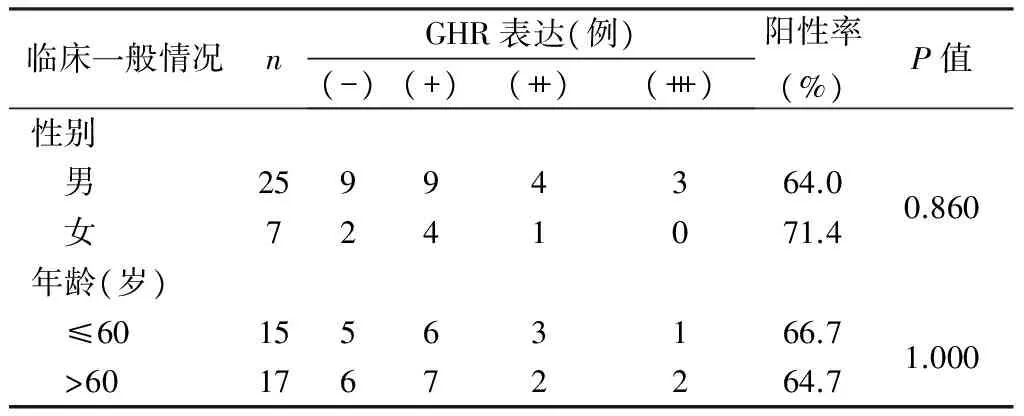
表1 32例胃癌组织中GHR的表达与临床一般情况的关系
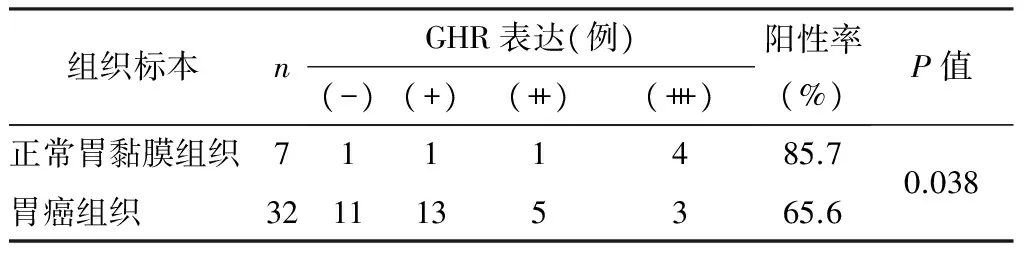
表2 32例胃癌组织和7例正常胃黏膜组织GHR的表达结果
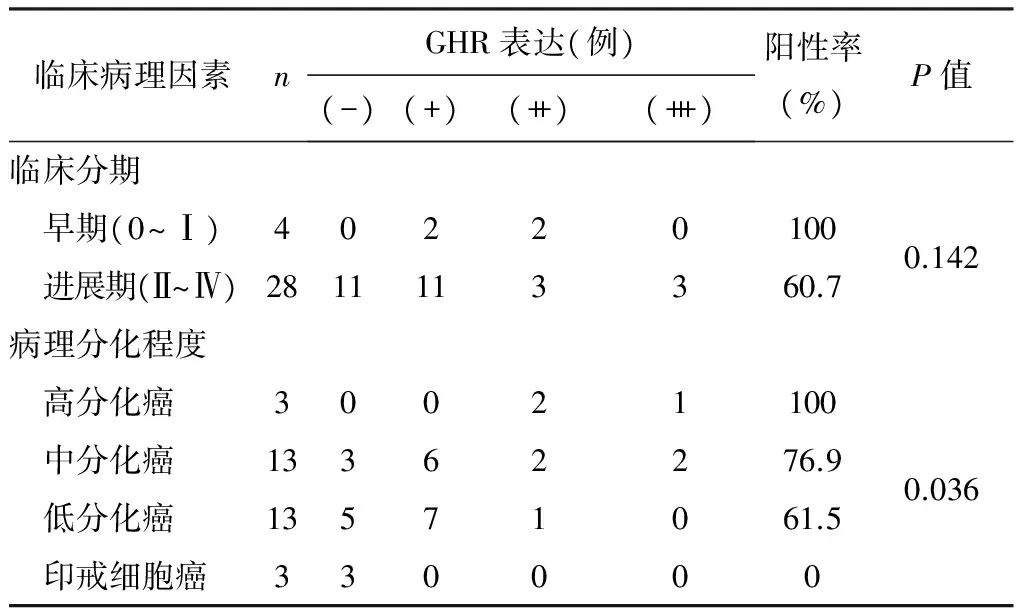
表3 32例胃癌组织中GHR的表达与临床病理特征的关系
3 讨论
晚期胃癌患者多伴有营养不良,其中约90%存在体重下降。单纯的肠内肠外营养不能有效改善这种营养不良。rhGH因具有促进蛋白质合成、增加机体瘦组织、改善机体免疫功能及降低应激反应的作用,已广泛应用于非恶性疾病营养不良的代谢调节中。但由于rhGH肿瘤相关安全性尚不明确,在具肿瘤负荷患者的临床治疗仍被视为禁区。
GHR是GH作用的生理基础。GH 与GHR结合后不仅激活JAK2信号传导系统途径(JAK2-STST5,JAK2-STST3),也激活Src家族激酶,导致磷脂酶Cr细胞外信号调节激酶(ERK)、磷脂酰肌醇3-激酶(PI3K)信号途径的活化。这些路径能增强细胞的增殖、存活和活动性,ERK激活与癌转移有关。GHR在正常胃肠黏膜上皮细胞广泛表达,激活后可以刺激提高蛋白合成,促进伤口愈合,促进胃肠道细胞增殖、修复,调节免疫反应,增加营养物质吸收[1]。目前已经发现GHR在多种肿瘤组织中有丰富的表达,且表达量与肿瘤进展呈正相关[2-4]。另一方面,Okamoto等[5]则发现,PS评分高的恶性肿瘤患者本身存在GH-IGF1轴紊乱,血浆GH水平增高,IGF1降低,获得性GH抵抗,分析原因可能与GHR合成减少有关,提示GHR表达的异常与癌症恶液质的发展可能是互为因果的[6]。澳大利亚的研究发现GHR的核表达可能与肿瘤发生、发展、转移有关[7],进入核内的GHR作为转录激活因子,会共同激活因子CoAA启动靶基因子集转录调控细胞周期进程[8]。而Dehari等[9]对年轻的宫颈癌患者的研究也有相似发现。胃癌组织中GHR的表达情况国外报道较少,Nagano 等[10]在胃腺癌中检测到GHR亚型——GHRd3,这种亚型缺少外显子3,表达后呈现GH敏感性增强。国内的梁道明等[11]发现胃癌GHR表达水平与正常胃黏膜相当,胃癌GHR的表达与肿瘤分化程度、组织学类型、性别和年龄均无关。张富伟等[12]则认为胃癌GHR表达较正常组织弱,但与转移淋巴结相同,同样的是表达情况与肿瘤大小、分化程度、性别、年龄等无关。本研究发现正常胃黏膜组织表达水平及强度优于胃癌组织,与张富伟的结论相同;胃癌组织分化越好GHR表达阳性率越高,且差异显著,这与之前的研究结果截然不同。分析原因可能是本研究为回顾性研究,所选标本为连续的3个月间所有资料完整的32例胃癌标本,没有如上述两项研究那样预先分组挑选病例,因此能够更准确地描述事实真相。
前期研究表明,rhGH可增加GHR高表达细胞株胞膜表面GHR密度[13],促进GHR高表达细胞株裸鼠移植瘤模型的增殖,并促进VEGF表达,而对于不表达GHR的细胞及移植瘤不仅无上述影响,反而可以改善受试裸鼠的营养状况,使其增重[14]。支持GHR的表达状况可以作为指导临床应用rhGH进行代谢调节的生物靶标,选择适用人群。本研究发现组织分化越差GHR表达阳性率越低,表达的强度也越低。因此低分化、高度恶性的胃癌患者可能就是rhGH应用相对安全的人群。然而本研究也发现无论何种临床病理特征的胃癌,GHR均有一定程度的表达。提示在GHR未明的情况下,单纯应用rhGH治疗仍有刺激肿瘤增殖的危险。因此rhGH与化疗或分子靶向药物的全身治疗联合应用或能最大限度地缓解与癌症相关的不适和恶液质,降低患者死亡率及最大限度地控制肿瘤负荷。
[1] Nagano M, Chastre E, Choquet A, et al. Expression of prolactin and growth hormone receptor genes and their isoforms in the gastrointestinal tract[J]. Am J Physiol, 1995, 268(3): 431-442.
[2] Lincoln DT, Kaiser HE, Raju GP, et al. Growth hormone and colorectal carcinoma: localization of receptors[J].In Vivo,2000,14(1):41-49.
[3] Gebre-Medhin M, Kindblom LG, Wennbo H, et al. Growth hormone receptor is expressed in human breast cancer[J]. Am J Pathol, 2001, 158(4):1217-1222.
[4] Weiss-Messer E, Merom O, Adi A, et al. Growth hormone (GH) receptors in prostate cancer: gene expression in human tissues and cell lines and characterization, GH signaling and androgen receptor regulation in LNCaP cells[J]. Mol Cell Endocrinol, 2004, 220(1-2):109-123.
[5] Okamoto I,Munakata M,Miyazaki M,et al.Disturbance of the growth hormone-insulin-like growth factor-1 axis associated with poor performance status in patients with solid tumors[J].Jpn J Clin Oncol,2010,40(3):222-226.
[6] Wolf M, Böhm S, Brand M, et al.Proinflammatory cytokines interleukin 1 beta and tumor necrosis factor alpha inhibit growth hormone stimulation of insulin-like growth factor I synthesis and growth hormone receptor mRNA levels in cultured rat liver cells[J].Eur J Endocrinol,1996,135(6):729-737.
[7] Conway-Campbell BL, Wooh JW, Brooks AJ, et al. Nuclear targeting of the growth hormone receptor results in dysregulation of cell proliferation and tumorigenesis[J]. Proc Natl Acad Sci USA,2007,104(33):13331-13336.
[8] Conway-Campbell BL, Brooks AJ, Robinson PJ, et al. The extracellular domain of the growth hormone receptor interacts with coactivator activator to promote cell proliferation[J]. Mol Endocrinol,2008,22(9):2190-2202.
[9] Dehari R, Nakamura Y, Okamoto N, et al. Increased nuclear expression of growth hormone receptor in uterine cervical neoplasms of women under 40 years old[J]. Tohoku J Exp Med,2008,216(2):165-172.
[10] Nagano M, Chastre E, Choquet A, et al. Expression of prolactin and growth hormone receptor genes and their isoforms in the gastrointestinal tract[J]. Am J Physiol, 1995, 268(3 Pt 1):G431-442.
[11] 梁道明,杨慰,周东,等. 胃癌组织中生长激素受体的表达[J]. 中国普外基础与临床杂志, 2009, 16(3):208-210.
[12] 张富伟,孙少川.生长激素受体在胃癌及其转移淋巴结组织中的表达[J].中华普通外科杂志, 2006,21(5):377-378.
[13] 陆颖芝,林岩,李苏宜,等.重组生长激素体外干预人肝癌细胞膜GHR密度变化[J]. 中国肿瘤外科杂志,2009,1(1):44-47.
[14] Li S, Hou G, Wang Y, et al. Influence of recombinant human growth hormone (rhGH) on proliferation of hepatocellular carcinoma cells with positive and negative growth hormone receptors in vitro[J]. Tumori, 2010, 96(2): 282-288.
