CD1D基因与B7-1基因真核表达载体的构建
2010-01-24王昆华龚昆梅欧阳一鸣刘为军黄映光龙亚新郭世奎
王昆华, 张 杰, 龚昆梅, 肖 乐, 欧阳一鸣, 刘为军, 凌 平, 黄映光, 龙亚新, 郭世奎
CD1是一类无多态性的蛋白质家族,人CD1的5个等位基因编码4种蛋白产物——CD1A、CD1B、CD1C、CD1D。其中CD1D是唯一存在于人和鼠中的一类蛋白分子,由CD1介导的抗原加工呈递也要经过一系列的加工修饰过程,但不同于MHC-Ⅰ 类分子和MHC-Ⅱ 类分子介导的信号传导途径。现已证实CD1分子与多种免疫性疾病及肿瘤性疾病有关。此外,有研究显示:肿瘤细胞能通过改变自身细胞表面糖脂结构或改变其膜性糖脂,逃避CD1D的NK/T细胞杀伤效应,提示通过CD1D介导的NK/T细胞激活能实现抗肿瘤免疫的基因治疗[1]。近年来的研究认为,多数肿瘤细胞存在肿瘤特异性抗原和/或肿瘤相关抗原,但仍能逃避免疫监视,其重要原因之一是肿瘤细胞缺乏B7-1等辅助刺激分子,不能为T细胞活化提供所必须的第二信号。若能将B7-1基因导入肿瘤细胞,使肿瘤细胞表达B7-1分子,使其与MHC分子联合以完善抗肿瘤免疫的双信号系统,共同刺激、诱导抗肿瘤效应细胞的产生,则可能逆转这种免疫无能状态,增强细胞的免疫原性,激发机体T淋巴细胞的抗肿瘤免疫,诱导肿瘤排斥反应,从而达到治疗恶性肿瘤的目的。我们试图构建表达小鼠CD1D基因和 B7-1基因的真核表达载体,为今后有效利用基因免疫疗法、治疗肿瘤疾病提供基础。
1 资料和方法
1.1 实验材料
大肠杆菌DH5α、真核质粒pcDNA3由昆明医学院神经科学研究所提供,限制性内切酶、T4DNA连接酶、凝胶纯化试剂盒、PCR试剂盒购自大连宝生物公司,其他试剂为进口或国产分析纯试剂,B7-1引物、CD1D引物由大连宝生物公司合成,Trizol购自Progema公司。
1.2 实验方法
1.2.1 小鼠总RNA提取 (1) 处死C57BL/6小鼠,取100 mg新鲜脾脏组织放入DEPC处理过的匀浆器中,加1 mL预冷的Trizol,冰浴中匀浆至无组织块。(2) 将匀浆液转移至EP管中,加入200 μL氯仿,用力振荡EP管直到充分混匀,4℃ 12 000 g离心10 min。(3) 上层水相移至另1支EP管中,加入250 μL异丙醇沉淀RNA,室温放置5~10 min。(4) EP管4℃ 12 000 g离心10 min,去上清液。(5) 加入1 mL 75%乙醇,4℃ 7 500 g离心5 min,去上清。EP管倒置干燥,加入DEPC处理过的双蒸水20 μL,溶解RNA保存于-80℃冰箱。
1.2.2 紫外分光光度计测定RNA浓度和纯度 取1 μL RNA溶于双蒸水,用紫外分光光度计测RNA的OD260,OD260/OD280以测定浓度和纯度。
1.2.3 RT反应 反应体系10 μL,包括:RT Buffer、dNTP、RNaes inhibitor、AMV逆转录酶、Oligo dT-adaptor、总RNA,37℃反应1 h,95℃灭活逆转录酶,用反应产物做PCR反应。
1.2.4 PCR反应 取上述反应产物,根据软件设计B7-1引物(序列号X60958.1),上游:5′-CGGAATTCATGGCTTGCAATTGTCA-3′,下游:5′-GCGGATCCCTAAAGGAAGACGGT -CT-3′;CD1D引物(序列号NM 007639):上游:5′-CGGAATTCGCTATGCGGTACCTACC-3′,下游:5′-GCGGATCCGTGTAAGGAAGAGTCAC-3′,反应体系包括:引物、RT产物、TaqDNA酶、dNTP等;加水补足至50 μL。扩增条件为:94℃ 3 min,94℃ 30 s,55℃ 30 s,72℃ 60 s,共35个循环,然后72℃延伸5 min。反应完毕,将产物经1%琼脂糖凝胶电泳观察结果。
1.2.5 重组真核表达载体的构建及鉴定 对产物用EcorRⅠ和BamHⅠ双酶切,经凝胶纯化后已同样经过酶切和纯化的pcDNA3质粒在T4连接酶的作用下,16℃连接过夜,产物进行电泳,切下所需条带纯化,转化大肠杆菌DH5α感受态细胞,37℃培养,挑取单克隆菌落进行筛选,然后用双酶切方法加以鉴定。
2 结果
2.1 小鼠脾总RNA的提取
用Trizol试剂提取小鼠总RNA,溶于20 μLDEPC处理过的双蒸水中,取4 μL进行凝胶电泳,可见两条明显的RNA条带。用紫外分光光度计测RNA OD260/OD280为1.89,能满足实验的要求(见图1)。

图1 小鼠总RNA凝胶电泳
2.2 CD1D基因与B7-1基因的PCR扩增产物
小鼠总RNA用试剂盒方法进行扩增,PCR产物进行凝胶电泳,分别可见CD1D基因大小为1 010bp的条带(见图2)和B7-1基因大小为930bp的条带(见图3),测序结果与已知系列相符。
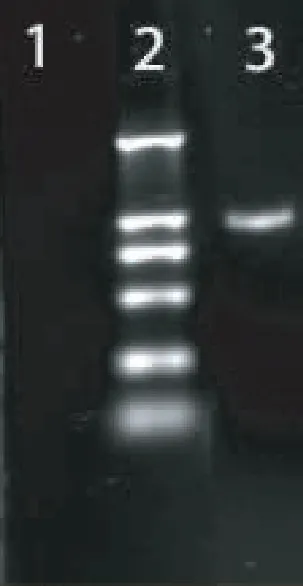
图2 CD1D基因的PCR检测1.空白对照;2.DNA marker DL2 000,从上至下分子量为2 000、1 000、750、500、250、100;3.CD1D基因 PCR扩增产物(1 010bp)
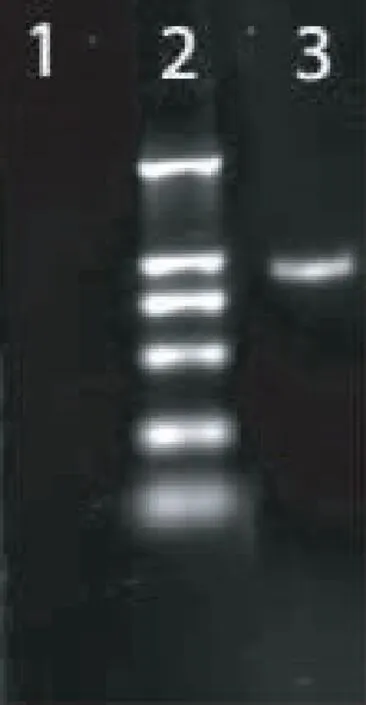
图3 B7-1基因的PCR检测1.空白对照;2.DNA marker DL2 000,从上至下分子量为2 000、1 000、750、500、250、100;3.B7-1基因 PCR扩增产物(930bp)
2.3 重组载体的构建及鉴定
重组质粒转化大肠杆菌后,挑取单克隆菌落用EcorRⅠ和BamHⅠ双酶切,产物进行凝胶电泳加以鉴定,可见1条1 000bp和1条5.4kb的条带,与已知片段分子量大小相符,获得重组的真核表达载体(见图4)。

图4 CD1D基因与B7-1基因真核表达载体的酶切鉴定1.DNA marker;2.CD1D基因真核表达载体的酶切鉴定;3.B7-1基因真核表达载体的酶切鉴定
3 讨论
研究显示,CD1D的抗原呈递途径不同于已知的MHC-Ⅰ及MHC-Ⅱ类所介导的抗原传递途径,能在体内通过调控Ⅰ型和Ⅱ型NK细胞,诱导多种免疫排斥反应,与自身免疫性疾病,肿瘤等疾病密切相关[2],是当前研究的热点之一。国外学者通过对CD1D依赖型细胞的研究,发现CD1D分子可以大量激活有生物活性的IL-12、IFN-γ等免疫炎性物质,引起细胞裂解,提高细胞抵抗病毒的能力[3]。此外,CD1D基因还可以通过介导呈递抗原途径,诱导骨髓瘤细胞的凋亡,提高机体抗骨髓瘤的能力[4]。CD1D在脂类抗原的识别中居于十分重要的地位,通过导入CD1D基因可能对免疫基因治疗在临床治疗上开辟一种新的基因治疗模式。
机体抗肿瘤免疫反应主要是细胞免疫过程,T细胞在肿瘤排斥及对肿瘤产生特异性记忆中起着重要作用,T细胞的激活存在双信号作用机制,需要第一信号及第二信号的参与。一是由T细胞受体(TCR)介导的抗原特异性信号即第一信号,另一个是由B7分子等共刺激分子介导的抗原非特异性信号即第二信号。正常状态下,由于抗原肽分子数量较少,难以刺激产生第一信号,往往需要免疫细胞依靠B7等共刺激分子介导第二信号来扩大反应信号,实现信号传导,活化免疫细胞,发挥抗肿瘤效应。B7-1是在T细胞活化中提供第二信号的关键分子,能通过与T细胞上CD28/CTLA-4反应为T细胞活化提供协同刺激信号,其在肿瘤细胞上的表达,能协同激活CD8+CTL以及CD4+T细胞。
许多体内外实验表明,单基因治疗在降低肿瘤的致瘤性,提高肿瘤的免疫原性方面难以达到预期的效果。随着分子生物学技术的不断成熟, 很多的研究显示双基因及多基因联合转导肿瘤细胞可以达到更佳的治疗效果[5]。如联合MCP-1、GM-CSF、B7-1所制备的细胞疫苗,在小鼠体内产生了明显的抗肿瘤效应[6]。联合同一免疫反应途径中两个刺激因子,能够优势互补,产生更明显的共刺激信号以加强抗肿瘤免疫的效果[7]。
真核载体介导的基因转移是将外原性基因导入靶细胞的有效手段,能高效地将外源基因整合到宿主细胞基因组,是基因治疗的基础实验和临床研究中广泛使用的载体系统。本实验成功克隆和构建了小鼠CD1D和B7-1基因的真核表达载体,今后我们将利用这些载体,在小鼠胰腺癌细胞中导入B7-1和CD1D基因,这种修饰过的胰腺癌细胞有望能增强共刺激分子在肿瘤细胞表面的表达,有助于机体对肿瘤细胞的识别和排斥并提高机体免疫细胞对肿瘤抗原的识别能力, 从而激发CTL的活性,降低细胞的致瘤性,有可能是一种极有前途的肿瘤细胞疫苗。
[1] Chang DH, Deng H, Matthews P, et al. Inflammation-associated lysophospholipids as ligands for CD1D-restricted T cells in human cancer[J]. Blood, 2008, 112(4):1308-1316.
[2] Neparidze N, Dhodapkar MV. Harnessing CD1D-restricted T cells toward antitumor immunity in humans[J]. Ann N Y Acad Sci, 2009, 1174:61-67.
[3] Yue SC, Nowak M, Shaulov-Kask A, et al. Direct CD1D-mediated stimulation of APC IL-12 production and protective immune response to virus infection in vivo[J]. J Immunol, 2010, 184(1):268-276.
[4] Spanoudakis E, Hu M, Naresh K, et al. Regulation of multiple myeloma survival and progression by CD1D[J]. Blood, 2009, 113(11):2498-2507.
[5] Ren SP, Wu CT, Huang WR, et al. Adenoviral-mediated transfer of human wild-type p53, GM-CSF and B7-1 genes results in growth suppression and autologous anti-tumor cytotoxicity of multiple myeloma cells in vitro[J]. Cancer Immunol Immunother, 2006, 55(4):375-385.
[6] Lakatosová-Andelová M, Jinoch P, Dusková M, et al. Live cell vaccines expressing B7.1, monocyte chemoattractant protein 1 and granulocyte-macrophage colony stimulation factor derived from mouse HPV16-transformed cells[J]. Int J Oncol, 2008, 32(1):265-271.
[7] Tseng SH, Chen Y, Chang CJ, et al. Induction of T-cell apoptosis in rats by genetically engineered glioma cells expressing granulocyte-macrophage colony-stimulating factor and B7.1[J]. Clin Cancer Res, 2005, 11 (4):1639-1649.
