多层螺旋CT在胃癌术前分期诊断中的价值研究
2010-01-24肖献秋刘怡文张国强龚伟达
肖献秋, 陆 波, 刘怡文, 张国强, 洪 岩, 陶 政, 龚伟达
胃癌是最常见的上消化道恶性肿瘤之一,其病死率占所有恶性肿瘤的23%,居各类癌症死亡的前两位[1]。胃癌的诊断,特别是早期胃癌,主要依靠胃镜及活检,但多层螺旋CT(multispiral computed tomography,MSCT)在对胃癌患者进行全面的术前评估和分期方面,有着不可替代的作用。我们采用MSCT检查对胃癌患者进行术前的TNM分期诊断,并与术后病理结果进行比较,以评价MSCT的诊断准确率及临床应用价值。
1 资料与方法
1.1 临床资料 收集我院2005年5月至2008年5月经胃镜活检并病理证实的胃癌患者87例,男53例,女34例,平均年龄52.7岁。69例经手术治疗,其中57例行胃癌根治术,12例行姑息性手术。
1.2 MSCT检查方法 所有患者手术前1周均经Siemens Somatom Sensation 16 CT机平扫加增强检查,检查前患者空腹12 h,于扫描台上饮水1 000~1 200 mL。扫描范围从膈顶至耻骨联合水平,体位则根据病灶位置而定。经肘静脉高压注射器注射优维显300 mgI/mL,总量80~100 mL,流率3.0 mL/s。动脉期、静脉期及平衡期延迟时间分别为注射开始后25 s、35 s、70~80 s。扫描参数:0.75 mm准直扫描。120 kV,250~300 mA。图像采用软组织函数重建方法,重建层厚1.0 mm,重建间隔0.7 mm,所有图像均传送到Wizard工作站,用3D后处理软件,首先浏览轴位图像,并附以分别采用多平面重组(multiplanar reconstruction,MPR)和最大密度投影法(maximum intensity projection,MIP)进行重建,并根据需要对病变区进行任意旋转和切割。CT图像传送工作站行图像后处理,由有经验的影像学医师进行读片分析。
1.3 MSCT胃癌的分期标准 (1)T分期标准[2]:在MSCT图像上正常胃壁厚度一般在5 mm以下且可呈1~3层结构,胃癌表现为胃壁增厚和(或)胃壁异常强化。MSCT判断其浸润深度的标准为:T0胃壁无明显异常增厚改变;T1(见图1)单层胃壁时显示非透壁性局灶性明显增强伴或不伴有胃壁局灶性增厚,而胃病变区显示多层结构时,可同时看到相应于黏膜下层的完整低密度带;T2(见图2)单层胃壁结构时显示胃壁透壁性增强伴有局灶性增厚,并且其外边界光整和(或)病灶周围脂肪层清晰,多层结构显示胃壁异常增强并伴中外层的突然消失,并且其外边界浆膜面光整和(或)病灶周围脂肪层清晰;T3(见图3) 增厚胃壁外边界浆膜面不规则或呈条索状高密度影,和(或)病灶周围脂肪层模糊,存在结节或带状影;T4(见图4)增厚胃壁与临近器官间的脂肪层消失,明显侵犯周围脏器。(2)淋巴结转移标准[3]:当MSCT检出的胃周淋巴结短径>6 mm 和胃周外淋巴结短径>8 mm时视为淋巴结转移。N0无淋巴结转移;N11~6个淋巴结转移;N27~15个淋巴结转移;N315个以上淋巴结转移。(3)远处转移诊断标准:M0无远处转移;M1有远处转移(第12组以上淋巴结、肝脏转移和腹水等)。

图1 T1胃窦部黏膜层增厚伴局灶性明显增强,黏膜下层低密度带完整

图2 T2胃底部胃壁异常增强并伴中外层消失,其外边界浆膜面光整
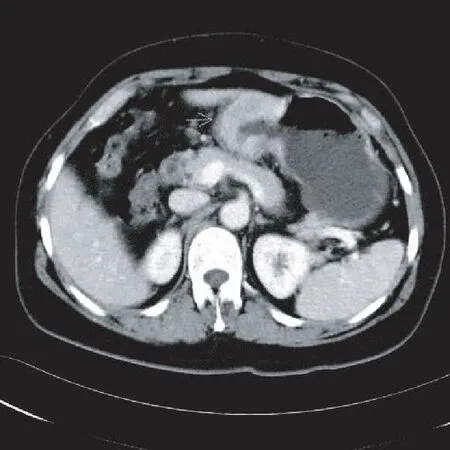
图3 T3胃窦壁增厚,异常强化,并伴中外层消失,其外边界浆膜面不规则呈条索状高密度影

图4 T4浸润型胃癌,胃壁弥漫性全层增厚,其外边界浆膜面模糊,与周围器官脂肪间隙消失,胃周围淋巴结转移
1.4 结果评定 将69例经手术治疗患者的MSCT分期与其术后病理TNM分期比较,术后病理分期参照美国2002年肿瘤联合会UICC第六版TNM分期标准[4]。Ⅰ期27例,Ⅱ期11例,Ⅲ期24例,Ⅳ期7例。
1.5 统计学方法 采用SAS 9.1统计软件进行一致性检验,若Kappa值大于0.75,说明一致程度相当满意,若Kappa值小于0.4,说明一致程度不够理想。
2 结果
所有患者的病灶均得以显示并诊断。69例经手术的胃癌患者MSCT术前定位诊断和术中探查结果完全一致,准确度达100%。病灶位于胃底贲门11例,位于胃窦部位40例,位于胃体部18例。T分期准确率分别为T1期75.0%(9/12),T2期64.7%(11/17),T3期85.7%(30/35),T4期60.0%(3/5),总T分期准确率为76.8%(53/69)。与病理分期结果进行一致性检验(Kappa检验),Kappa值为0.644,说明MSCT的T分期结果与病理结果一致性较好(见表1)。

表1 胃癌的T分期:MSCT分期和术后病理分期之比较
N分期准确率分别为N083.3%(30/36),N1期87.5%(21/24),N2期66.7%(6/9),总N分期准确率为82.6%。与病理分期结果进行Kappa检验,Kappa值为0.705,说明MSCT下N分期结果与病理结果一致性较好(见表2)。

表2 胃癌的N分期:MSCT分期和术后病理分期之比较
M分期中M0期及M1期准确率均达100%。术中发现3例远处转移,2例肝转移,1例腹膜后淋巴结转移,CT均诊断正确。与病理的分期结果进行Kappa检验,Kappa值为1.000,说明MSCT下M分期结果与病理结果相一致(见表3)。

表3 胃癌的M分期:MSCT分期和术后病理分期之比较
TNM分期的准确率为Ⅰ期88.9%,Ⅱ期63.6%,Ⅲ期79.2%,Ⅳ期100%。总TNM分期准确率为82.6%(57/69)。与病理的分期结果进行Kappa检验,Kappa值为0.750。说明MSCT下TNM分期结果与病理结果一致性满意(见表 4)。

表4 胃癌的TNM分期:MSCT分期和术后病理分期之比较
3 讨论
3.1 胃癌术前TNM分期的必要性 目前,胃癌的治疗方法仍是以手术为主的综合治疗,正确的术前分期对选择治疗方案、评价预后有重要的指导意义。Maruyama等[5]应用Cox模型分析4 734例胃癌切除患者预后的影响因素,显示肿瘤浸润深度、淋巴结转移、远处转移为影响预后的3个最主要因素。提示胃癌术前TNM分期的重要性,可为手术方案的制订提供客观依据。文献报道[6]螺旋CT对胃癌TNM分期的准确率为79.0%~80.2%,本组MSCT TNM分期准确率为82.6%,与术后病理分期一致性良好(Kappa值0.750),尤其是Ⅳ期准确率高达100%,若无明显的消化道梗阻症状,则可以避免不必要的剖腹探查术。
3.2 胃癌术前诊断方法的比较 传统的胃癌术前检查方法包括胃镜、B超、CT等。胃镜虽能判定黏膜病变的大小、部位,但较难确定其浸润胃壁的深度,更不能判断淋巴结及远处转移情况,不适于术前分期。有报道内镜超声(EUS)对胃癌术前分期的准确率达80.3%[7],但其不能对全胃进行满意观察,虽对胃贲门、窦部的胃壁显示较满意,但对胃底、体部胃壁的显示常不理想,故临床实用价值有限。常规CT检查由于扫描速度慢,受呼吸及运动伪影的影响大,即使采用动态扫描,TNM分期的准确率亦仅为56.7%。目前开展的MSCT以其快速扫描、多层重建技术的应用明显优于常规CT,在胃癌术前评估方面取得了较大的进展,对T4分期有其独特的优越性,能发现EUS较难发现的远处(后腹膜、大血管周围)淋巴结和脏器(腹膜、肝)转移,提高了病灶检出率及术前TNM分期的准确性。在胃癌MSCT增强扫描中,单期、双期和三期扫描均有报道,如Takao等[8]研究显示,动脉相扫描有利于胃癌病灶的检出及估计其浸润胃壁的范围,实质期(门脉期)扫描有利于肝转移灶的检出,而平衡期扫描有利于胃癌浸润深度(特别是进展期胃癌)的判断。因此,MSCT三期扫描更有利于胃癌病灶的检出和提高术前分期的准确率。
3.3 胃癌检查中低张水做对比剂的应用 目前,CT检查前多以水作为口服对比剂,其主要原因有:(1)与空气相比,水不会引起伪影,并能冲去附于胃壁的黏液且绝对安全;(2)应用阳性对比剂在增强扫描图像上将严重影响病灶的观察;(3)使用大量水(1 000~1 200mL)扩张胃腔有助于鉴别胃癌和正常胃壁,因为一旦肿瘤侵犯固有肌层,病变区域便不能完全扩张。同时可使用胃肠松弛剂抑制胃肠蠕动,以减少运动伪影和延迟胃排空使显示更清楚。此外,水作为对比剂具有无色无味、安全可靠,易被患者接受、耐受,且费用低廉等优点。低张又能使胃充分扩张,减少或消除胃蠕动的伪影,有助于正确判断胃壁有无异常增厚。
3.4 MSCT在胃癌术前TNM分期的诊断意义 胃癌的T分期是影响切除率的主要因素[9],Kim等[10]报道MSCT术前临床T分期的准确率为69%~87%。本研究结果显示其对胃癌T分期诊断总准确率为76.8%,对T3期病灶诊断准确率特别高(85.7%),原因可能是该期患者病灶明显,易于检出,同时,T3期患者是临床就诊的主要人群。淋巴结转移是胃癌转移的主要方式,无淋巴结转移患者术后5年生存率是有淋巴结转移患者的3倍。淋巴结转移与否对判断预后非常重要,也是MSCT诊断的重点之一。在本研究中N分期准确率为82.6%,与病理分期一致性良好,但N2准确度为66.7%,一致性相对较低,可能与周围脂肪量少,患者屏气程度不一等因素有关。胃癌的远处转移主要为肝、肺的血行转移,远处淋巴结转移和腹膜腔种植转移等,MSCT胸部和全腹部增强扫描可及时发现转移情况。本组病例仅3例发生远处转移,MSCT均正确诊断,与术后病理分期一致,说明MSCT三期增强扫描可准确反映胃癌远处转移的病理特征。
总之,本研究表明MSCT对胃癌术前TNM分期有较高的准确性,MSCT与内镜、超声相结合,是目前对胃癌的定性、定位及术前分期诊断的最佳方法之一。
[1] 尚克中. 中华影像医学·消化系统卷[M].北京:人民卫生出版社,2002:82.
[2] Wittekind C, Greene FL, Hutter RVP, et al. TNM Atlas: Illustrated Guide to the TNM/pTNM-Classification of Malignant Tumours[M]. New York: Springer-link Co, 2003:53-58.
[3] Ba-Ssalamah A, Prokop M, Uffmann M, et al. Dedicated multidetector CT of the stomach:spectrum of diseases[J].Radiographics,2003,23(3):625-644.
[4] Sobin LH, Wittekind C. TNM Classification of Malignant Tumours, (UICC) (Paperback)[M]. 6th ed, New York: John Wiley & Sons Inc, 2002:81-83.
[5] Maruyama K,Miwa K.Japanese staging system for gastric cancer:Evaluation and documentation of tumor extension[J]. Scand J Gastroenterol,1987,22(Suppl 133):22-26.
[6] Hundt W, Braunschweig R, Reiser M. Assessment of gastric cancer:value of breathhold technique and two-phase spiral CT[J]. Eur Radiol,1999,9(1):68-72.
[7] 严超,朱正纲,诸琦,等. 内镜超声检查在早期胃癌术前分期的应用[J].中华肿瘤杂志, 2003,25(4): 390-393.
[8] 岳松伟. 胃癌的三期螺旋CT评价及放射病理学对照[J]. 国外医学临床放射学分册, 1999,22(2):113.
[9] Fukuya T, Honda H, Kaneko K, et al. Efficacy of helical CT in T-staging of gastric cancer[J]. J Comput Assist Tomgr,1997,21 (1) :73-81.
[10] Kim AY, Kim HJ, Ha HK. Gastric cancer by multidetector row CT: preoperative staging[J]. Abdom Imaging, 2005, 30 (4) : 465-472.
