自身免疫的调控①
2010-01-23刘燕明长春中医药大学微生物与免疫学教研室长春130117
罗 晶 刘燕明 李 欣 (长春中医药大学微生物与免疫学教研室,长春130117)
自身免疫是机体免疫系统对自身成分产生的免疫应答,但其失控却可引发严重的自身免疫病。因此机体对自身免疫的调控是一个具有重大理论价值和实用意义的课题。但长期以来对自身免疫的调控一直缺乏系统性研究,这不仅影响了对自身免疫功能的深入理解,而且也干扰了免疫理论的完整性。近年研究表明,机体免疫系统存在着对某些自身抗原在识别基础上的免疫应答控制。这里进行简要的讨论,希望能使自身免疫调控的重要性得到充分的认识,以便更深刻、更全面地理解有关免疫现象。
1 自身免疫的基础
已了解到,免疫耐受形成的核心机制是中枢免疫耐受机制,即T细胞在胸腺内经历的发育选择:克隆T细胞在高亲合度结合自身抗原肽-MHC分子复合物(pMHC)时发生凋亡而被清除(阴性选择)[1],或特殊 T细胞(高表达 Foxp3,forkhead box P3,属forkhead/winged helix家族)结合自身pMHC时分化为自然Treg细胞(表型为CD4+CD25+T细胞),可抑制对该pMHC的免疫应答[2]。由于胸腺内正常情况下只有自身抗原,此机制也是机体T细胞识别谱明确“自己/非己”,并获得对“自己”抗原耐受的基础。此外还存在外周耐受机制,如克隆无能(T细胞识别时缺乏必要的协同刺激信号)、免疫忽视(刺激性pMHC表达过低)和调节性T细胞(Treg)的作用等。
由于中枢免疫耐受机制不可能覆盖机体全部自身抗原,而外周耐受机制又不能区分自身或外来抗原,因此理论上免疫系统可能针对某些外周表达的自身抗原进行应答。实际上,人们早已明确生理性自身免疫不仅存在,而且是免疫系统的重要功能,并被一些免疫学者概括为免疫自稳(Immunological homeostasis)及免疫监视(Immunological surveillance)功能。
一般公认,正常的自身免疫反应是生理性的,但其失控就会出现自身免疫病。理论上,机体针对病原生物的免疫应答,也会因其对受染靶细胞的损伤等,可致使大量自身抗原出现,导致自身免疫病理损伤或免疫应答偏离等,但实际上这并不常见。在通常情况下,机体对自身抗原引发的应答有限制性调控作用,以避免自身免疫应答超出生理范围,即自身免疫是免疫系统的基本功能,并受到特殊的调控作用,通常不会出现类似抗感染免疫应答中表现的那种“你死我活”的效应。
2 免疫调控的双重识别机制
近年随着对免疫受体识别模式和免疫调节受体的深入研究,逐渐揭示出识别的差异在免疫应答或耐受形成中的重要作用,对自身免疫调控的具体机制也有了一些认识。目前进展较大的主要涉及不同受体或识别模式的有关研究,大致可归结为识别的双重模式(Dual model)假说,涉及的机制可分为两类:
2.1双重受体模式(Dual receptor pattern) 此类模式是指免疫细胞表面有两类受体,一类是活化受体,另一类是抑制受体,它们之间的动态平衡决定免疫应答的类型及强度。其中最为人熟知的是NK细胞,其活化受体主要结合某些细胞内感染病原诱导或异常发育出现在细胞表面的分子,有的也可结合自身正常抗原。其抑制受体则仅可识别自身细胞广泛表达的MHCⅠ类分子。在NK细胞的典型活动中,抑制受体通常在启动活化时起主导作用,但对于异种细胞、受病毒感染以及恶变的自身细胞,因相应MHCⅠ类分子有所变化(有人称“丧失自我”;实际情况较复杂,如NK细胞也有识别MHCⅠ类分子的活化受体),无法启动抑制信号,从而形成自然杀伤效应。
目前已了解到,双重受体模式是调控免疫应答或耐受的普遍机制。如已发现在效应性T细胞也可见到有关抑制与活化受体[3,4],有关受体对γ δT细胞功能的调节也起关键作用[5,6]。最近发现抗原提呈细胞在识别损伤相关模式分子(Damage associated molecular patterns,DAMP)时也存在双重受体模式调控,如树突状细胞(DC)表面的CD24可结合重要的DAMP并发挥免疫抑制或干扰效应,临床上已观察到CD24基因变异确可影响一些自身免疫病的发生,如可增加个体对多发性硬化症、系统性红斑狼疮等疾病的易感性[7]。
2.2双重识别模式(Dual recognition pattern) T细胞识别时,TCR抗原识别位点与MHC分子肽结合域间并不存在特异的区别自己与非己的结构[8],但由TCR与CD4或CD8组成一个复合受体共同识别抗原肽-MHC复合物(pMHC)也可形成双重识别。近年来有人观察到TCR对同型MHC和异型MHC形成的pMHC有不同的识别策略,其结合的轴角度不同[9]。而且有实验证据显示,在免疫突触中存在一种特殊的双体识别模式,CD4分子可作为联结成分使两对TCR-pMHC偶联起来,而不是作为TCR的辅助受体共同结合同一个pMHC[10],这类似于同类生物学受体寡聚化活化的典型情况[11],表明T细胞识别可能有区分不同MHC分子特殊的生理意义:阳性选择赋予了克隆T细胞对一种MHC分子的同型(“自己”)识别特性,而视其他MHC分子识别时为异型(“非己”)识别,即克隆T细胞具备双重识别模式[12]。由于联(双)体识别是免疫有关受体活化的基本模式,这提示单一克隆T细胞能通过同型(单体)识别和异型(双体)识别的不同机制区分“自己/非己”(图1)。这两者可能分别对应外周的克隆无能和克隆活化应
答[13]。
免疫细胞识别的双重模式假说,与生理学中机体控制各种功能的一般规律吻合,在对进一步认识机体免疫调控方面有重要意义,并可助于理解某些药物对免疫的双相调节作用。
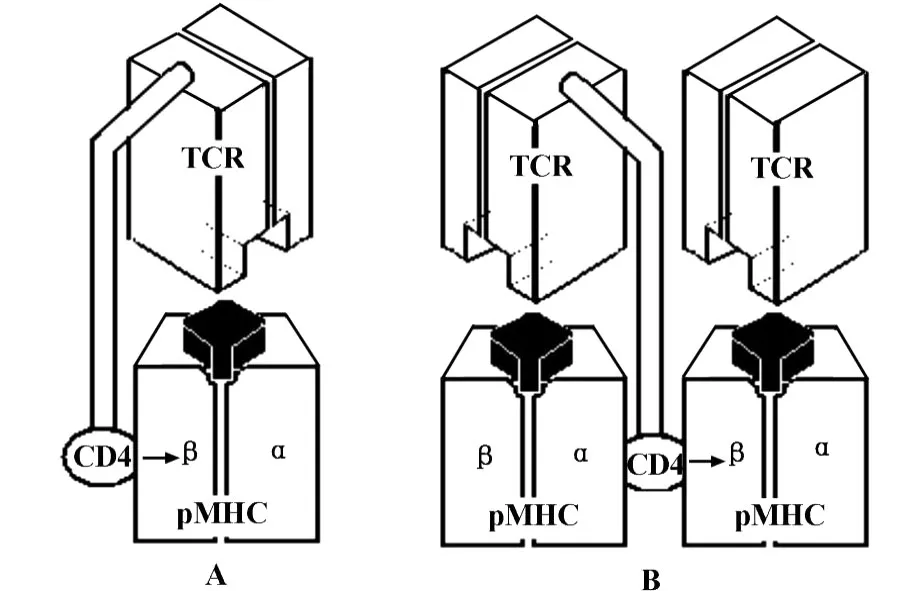
图1 CD4+T细胞识别pMHC的双重识别模式示意图Fig.1 CD4+T cell recognition pMHC diagram of the dual recognition model
3 自身免疫调控的意义
就目前了解而言,参与有关免疫调控双重识别的关键分子是自身成分,主要涉及两类分子:一类为个体标记性的免疫关键分子—MHC分子,其中MHCⅠ类分子(包括一些非经典MHCⅠ类分子)最重要,另一类是损伤相关模式分子(Damage associated molecular patterns,DAMP)。此可赋予免疫应答调控具有区分自我与非我的特质,有重大的生理学意义。
3.1MHCⅠ类分子对自身免疫的调控 MHCⅠ类分子是个体内最具普遍性的自身细胞标志分子,在对MHCⅠ类分子(涉及非典型Ⅰ类分子)识别基础上调控自身免疫也是进化最合理的选择。目前研究表明,除 NK细胞外,γ δT细胞和细胞毒性 T细胞(CT L)均有MHCⅠ类分子有关抑制性受体的表达,表明MHCⅠ类分子是参与对自身免疫调控的重要因素。
需特别指出的还有CD8+Treg细胞的调节。抑制性CD8+T细胞的概念早已被提出,但直到十几年前才在实验性自身免疫病模型的有关研究中有所明确。目前公认的抑制性CD8+T细胞为CD8+Treg细胞,它是由活化的CD4+T细胞诱导形成[14]。已了解到的机制是:由抗原刺激活化的CD4+T细胞表达多种活化蛋白,涉及非经典的MHCⅠ类分子(人类的HLA-E)的短时程表达,CD8+T细胞识别 HLA-E提呈抗原肽而形成CD8+Treg细胞,可在再次对有关抗原应答时抑制CD4+T细胞的活化。一般认为,HLA-E主要提呈自身抗原肽,故CD8+Treg细胞仅在抑制/调节自身免疫反应方面有重要意义,并可能是维持外周自身耐受的一种重要机制。
3.2损伤相关模式分子对自身免疫的调控 损伤相关模式分子(DAMP)是机体组织损伤时产生的可被模式识别受体(Pattern recognition receptor,PRR)识别的自身成分,主要有高迁移率B1族蛋白(High mobility group protein box1,HMG B1)和热休克蛋白(HSP70,HSP90)等。已发现APC在摄取处理DAMP时可有上调CD80/86、CD40等分子的现象,但通常这并不导致针对DAMP的后续免疫应答或理论上难以避免的级联自身免疫损伤,表明至少DAMP有抑制或调节自身免疫的机制。目前对有关作用途径已有一些了解,这里以树突状细胞(DC)为例进行简介。
DC是体内唯一能诱导初始 T细胞产生免疫应答的细胞,同时也可诱导形成免疫耐受。曾有人提出其诱导耐受可能与DC缺少或低表达CD80/86等协同刺激(第二信号)分子有关,但也有研究表明可能并非如此简单。如DC接触自身抗原有 IL-10产量的明显增高,在形成有关免疫耐受或诱导调节性T细胞形成方面有重要意义。最近的有关研究发现了一种可能的机制[15]:DC表面有CD24表达,它可结合重要的DAMP,并借助与细胞表面的具有膜内ITIM基序的分子(Siglec-G)结合,可介导抑制性信号转导。这有利于防止由抗感染免疫效应造成损伤后出现的自身抗原引起继发自身适应性免疫应答的发生,提示DAMP识别的抑制性途径可能也是调控自身免疫的一种普遍机制。
4 简要讨论
机体内具有自身反应性的细胞是淋巴细胞,各种T、B细胞和NK细胞均可参与自身免疫。自身免疫功能不仅奠定了免疫系统在维持自身稳定方面的基础,而且使免疫系统有别于天然防御系统。应该明确自身免疫调控是免疫功能的基本特性,对其进行深入研究有着重大的理论和实际意义。
尽管很多免疫现象已提示自身免疫可能是免疫系统最原始的功能,但由于传统的影响,人们习惯把免疫应答与对病原生物的识别与攻击相联系,这不仅极大地影响了对自身免疫意义与作用的认识,而且也严重干扰了对大量免疫现象的解读。有迹象表明,自身免疫是免疫系统的原始功能,可能在调控机体阶段(变态)发育中有意义[16-18],这里提出自身免疫的调控问题,并非只是为了强调有关研究的新进展,而主要是希望能有助于转换视角,开阔思路,更全面而深刻地理解相关免疫现象,包括有关疾病及其病理,以便建立新的途径或疗法,更好地控制移植免疫排斥和自身免疫病等。
1 Nossal GJ V.Negative selection of lymphocytes[J].Cell,1994;76:229-239.
2 Sakaguchi S.Naturally arising Foxp3-expressing CD25+CD4+regulatory T cells in immunological tolerance to self and non-self[J].Nature Immunology,2005;6:345-352.
3 Junevik K,Wwelenius O,Hasselblom Set al.The expression of NK cell inhibitory receptors on cytotoxic T cells in B-cell chronic lymphocytic leukaemia(B-CLL)[J].Ann Hematol,2007;86(2):89-94.
4 Guma M,Busch L K,Salazar-Fontana L Iet al.The CD94/NKG2C killer lectin-like receptor constitutes an alternative activation pathwayfor a subset of CD8+T cells[J].Eur J Immuol,2005;35(7):2071-2080.
5 Rothenfusser S,Buchwald A,K ock Set al.Missing HLA class I expression on Daudi cells unveils cytotoxic and proliferative responses of human gammadelta T lymphocytes[J].Cell Immuol,2002;215(1):32-44.
6 Poqqi A,Contini P,Catellani Set al.Regulation of gammadelta T cell survival by soluble HLA-I:involvement of CD8 and activating killer Iglike receptors[J].Eur Immunol,2005;35:2670-2678.
7 Bianchi M E,Manfrsdi A A.Danger in and out[J].Science,2009;323:1683-1684.
8 Van Regenmortel M H.Biological complexity emerges from the ashes of genetic reductionism[J].J Mol Recognit,2004;17:145-148.
9 Colf L A,Bankovich AJ,Hanick N Aet al.How a single T Cell receptor recognizes both self and foreign MHC[J].Cell,2007;129:135-146.
10 Li Q J,Dinner A R,Qi Set al.CD4 enhances T cell sensitivity to antigen by coordinatingLvk accumulation at the immunological synapse[J].Nat Immunol,2004;5(8):791-799.
11 Hailman E,Allen P M.Self help for T cells[J].Nat Immunol,2004;5(8):780-781.
12 Liu YM,Luo J,Chen D.A single clone of T cells may identify‘self’from‘non-self’through different recognition mechanisms[J].Frontiers in Biosceince,2008;13:1062-1063.
13 罗 晶,刘燕明.T细胞识别中复杂现象的新解读[J].中国科技论文在线精品论文,2008;1(15):1662-1667.
14 Linrong L,Cantor H.Generation and regulation of CD8+regulatory T dells[J],Cel Mol Immunol,2008;5:401-406.
15 Chen G-Y,TangJ,Zhen Pet al.CD24 and Siglec-10 selectively repress tissue damage-induced immune responses[J].Science,2009;323:1722-1725.
16 刘燕明.免疫系统的原始功能[J].免疫学杂志,1995;11(1):61-64.
17 刘燕明,罗 晶.T细胞识别谱与获得性免疫[J].现代免疫学,2009;29(3):185-189.
18 Salter-Cid L,Flajnik M F.Evolution and developmental regulation of the histocompatability complex[J].Crit Rev Immunol,1995;15:31275-31278.
