肿瘤干细胞研究概述
2010-01-23刘秋霞综述汤静燕审校
刘秋霞 综述 汤静燕 审校
肿瘤组织中存在数量稀少的癌细胞,在肿瘤形成过程中充当干细胞的角色,具有自我更新、增殖和分化的潜能,虽然数量少,却在肿瘤的发生、发展、复发和转移中起着重要作用,由于其众多性质与干细胞相似,这些细胞被称为肿瘤干细胞(TSC)。基于TSC的研究进展,进一步推动了对TSC的各种生物学行为的分子机制的探索,为重新认识肿瘤的起源和本质,以及肿瘤临床治疗提供了新的方向。
1 TSC假说
TSC假说认为在肿瘤组织中存在着一种特殊的细胞群体,这种细胞约占肿瘤细胞的1%,却是癌症演进的关键。该细胞群与正常干细胞有相似的特性,具有自我更新和多向分化潜能,细胞周期长,却很少进入细胞分裂周期,大部分时间处于静止状态,该细胞群称为TSC[1]。TSC是由于正常干细胞自我更新与增殖机制失调,或者分化细胞长期积累突变基因,获得自我更新与无限增殖能力而形成的。肿瘤的形成由TSC启动。近年有报道[2],干细胞微环境在肿瘤的形成中发挥重要作用。正常情况下,干细胞生长在特定的微环境中,称为干细胞灶龛,在维持和调节干细胞的自我更新与分化的平衡中发挥重要作用。当干细胞灶龛发生异常,为TSC提供锚定位点,TSC侵占了正常干细胞的位置,同时干细胞灶龛调控失调,细胞过度增殖,形成肿瘤。
随着各种TSC表面标记的发现,TSC假说得到越来越多证据的证实。TSC的首次发现是在1997年,Bonnet等[3]从人类急性粒细胞白血病(AML)中分离出一种带有CD34+CD38-免疫标记的细胞群体,尽管这类细胞只占AML细胞总数的很小部分,却能在非肥胖型糖尿病/重度联合免疫缺损(NOD/SCID)小鼠体内存活并大量分裂繁殖,使小鼠患有人类AML。而CD34+CD38+白血病细胞却不能在小鼠体内成瘤,由此推测 CD34+CD38-白血病细胞可能是AML的TSC。这一实验首次证实白血病中存在类似于具有干细胞功能的一类细胞群体。随后,Al-Hajj等[4]首先利用NOD/SCID小鼠模型从乳腺癌细胞中分离鉴定出具有类似干细胞生物学特性的细胞群体,从而证明了在实体瘤中也存在类似的细胞群体。之后,多种肿瘤,特别是实体肿瘤的TSC表面标记相继被发现(表1)。
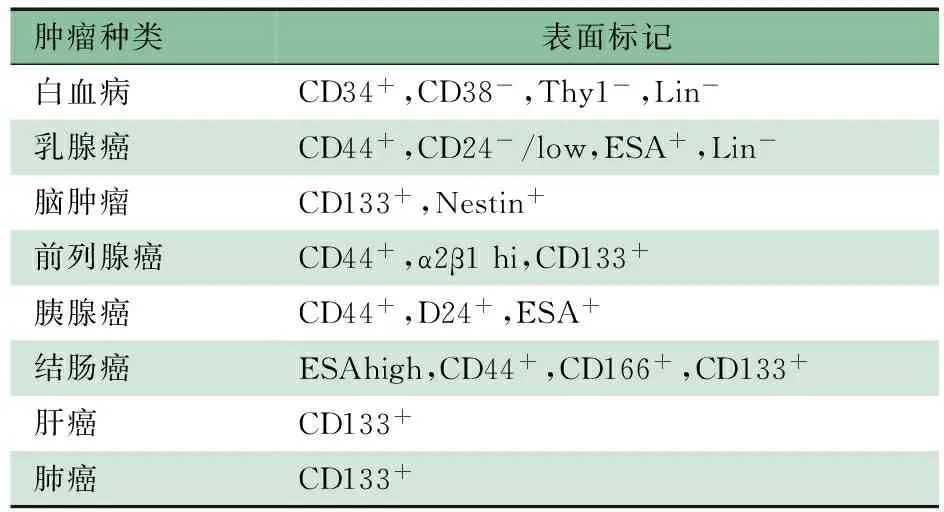
表1 TSC表面标记
2 TSC的生物学特性
TSC与正常组织干细胞有类似的生物学特性,即自我更新和多向分化能力[1]。
2.1 自我更新能力 干细胞通过对称性分裂和非对称性分裂两种形式来维持干细胞池细胞数目的恒定。
对称性分裂: 1个干细胞分裂为2个与母干细胞完全相同的子干细胞。
非对称性分裂: 1个干细胞分裂为1个与母干细胞完全相同的子干细胞和1个具有增殖能力的祖细胞。祖细胞进入细胞周期,成为快速增殖或者分化细胞[5~7]。
因此,只有对称性分裂可以增加干细胞的数目,当干细胞分裂的调节机制出现异常,干细胞对称性分裂增加,非对称性分裂减少,干细胞数目增加,导致组织细胞数目快速增加,肿瘤形成(图1)。

图1 正常干细胞和TSC分裂及分化过程
2.2 多向分化能力 干细胞的另一个特性是具有多向分化的潜能。正常组织中的细胞存在等级,可分为干细胞、祖细胞、快速增殖细胞和最终分化细胞。多能干细胞首先分化为祖细胞,祖细胞也有多向分化能力,进一步分化为快速增殖细胞,最终形成为组织起源的分化细胞。肿瘤组织中也含有各级细胞,类似于干细胞形成正常组织,TSC形成肿瘤的过程也是一个由干细胞启动的级别分化的过程。这一过程在造血系统中得到了很好的证实,通过干细胞移植,骨髓可以重建,恢复造血功能[8,9]。体外实验证实,神经干细胞能分化成神经元、星形胶质细胞和少突胶质细胞[10]。
自我更新、多向分化是干细胞和TSC的两个基本特性,也为TSC的分离、纯化及鉴定打下基础。
3 TSC的分离、纯化及鉴定方法
3.1 研究材料 TSC的研究材料主要来自3个方面:患者的肿瘤标本、肿瘤细胞株及肿瘤移植瘤。目前肿瘤细胞株成为TSC研究的重要材料,易获得和培养,许多研究者利用肿瘤细胞株来研究TSC调节通路,为临床治疗提供靶点,但在脑神经胶质瘤和肺癌中,细胞株是否仍然保持着原代肿瘤的等级结构受到了质疑[11,12]。通过体外实验得到的TSC表面标记或调节通路的调节点分子或基因,最终要通过体内试验验证。免疫缺陷小鼠移植瘤可将原代肿瘤移植到免疫缺陷小鼠,虽然干细胞的生存环境发生变化,但仍是最接近人体的体外实验。
3.2 研究手段 TSC假说提出后,关于TSC的生物学行为的研究却并没有同步发展起来,原因是TSC的分离、纯化和鉴定方法仍较滞后。近年来,TSC的分离和鉴定方法取得了很大进步。
3.2.1 细胞表面标记 通过流式细胞分选仪或免疫磁珠分选仪分离、纯化干细胞,极大地带动了TSC的研究进展。目前许多TSC表面标记已经确立(表1)。某些表面标记为TSC和正常组织干细胞共有,这恰好说明了某些TSC来源于正常干细胞。
3.2.2 链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase,SP)法 SP法用于分离不同组织TSC及干细胞已应用多年,其原理是干细胞能表达细胞膜转运体,如ATP-结合盒蛋白,ABC转运体ABCG2,这些分子能够排除染料如Hoechst33342或者Rhodamin123,但分化细胞不具有这样的特性。在许多肿瘤中证实了侧群细胞(side population cell)具有干细胞的特性,如在乳腺癌的研究中发现[13],侧群细胞在没有经过无血清培养基培养的细胞中只占1%,而在经过无血清培养基培养后的肿瘤球中比例达到27%,而且在分化的培养条件下能分化成多系克隆,提示侧群细胞中富集多能干细胞。同样在神经母细胞瘤中侧群细胞能在米托蒽醌存在的条件下生长为克隆;相反,非侧群细胞却不能,说明侧群细胞具有干细胞特性[14]。在后续研究中,发现小鼠的侧群细胞在NOD/SCID小鼠移植实验中能形成移植瘤,并表达干细胞标记α6-integrin和端粒酶[15,16]。
尽管如此,由于Hoechst具有毒性,侧群细胞不能在体内或体外生长,这直接影响到实验可靠性,而且有实验表明[17,18],在乳腺癌小鼠模型中,功能干细胞并不包含侧群阳性细胞,所以SP法的应用受到了限制。
3.2.3 ALDEFLUOR分析 乙醛脱氢酶1(ALDH1)能被ALDSFLUOR试剂染色,高水平表达的ALDH1会发出荧光并且能够被检测到。研究发现,ALDH1广泛存在于多物种组织的干细胞中,可能在干细胞的早期分化中起到重要作用[19]。ALDH1的高活性与造血系统干细胞及神经系统干、祖细胞有关[20,21]。有研究发现,来自大鼠造血系统的ALDSFLUOR阳性细胞经骨髓移植至受过强烈射线照射的大鼠中,大鼠可以得到长时间的骨髓再生[20]。还有报道显示[22],来自小鼠大脑的ALDSFLUOR阳性细胞,能够自我更新,体外培养形成神经球,并且能多系分化,产生神经元和神经纤维。ALDH的表达与乳腺癌TSC关系密切,用ALDEFLUOR试剂检测乳腺癌细胞系的ALDH活性后发现大多数阳性细胞具有TSC活性,利用该方法分离人乳腺癌TSC得到的ALDSFLUOR阳性细胞包含有乳腺干细胞形态和功能的特点,而且能在NOD/SCID小鼠体内成瘤,该移植瘤具有与原代肿瘤相同的细胞表型。
但是,用ALDH1方法分离不同来源的肿瘤起始细胞时同样具有局限性。例如,ALDEFLUOR(bright)和ALDEFLUOR(low)的肺癌细胞株H522细胞均能在NOD/SCID小鼠体内形成肿瘤,而且ALDEFLUOR(low)细胞形成的肿瘤生长得更快、更大[23]。这说明在肺癌中,ALDEFLUOR阳性细胞相对于阴性细胞并不富集TSC。ALDEFLUOR分析应该与其他细胞标记联合用于鉴定TSC,ALDEFLUOR与CD44、CD24、CD133联合用于分离乳腺癌TSC,发现ALDLUOR+/CD44+CD24-和ALDEFLUOR+/CD44+/CD133+都有很强的致瘤及转移潜能[24]。同样在人类造血干细胞研究中,ALDEFLUOR high/lin-细胞再分别用CD133+和CD133-细胞分离,CD133+/ALDEFLUOR high/lin-有较强的再生能力[21]。
3.2.4 体外培养 具有自我更新与增殖能力的细胞,在体外无血清并添加促细胞分裂素如表皮生长因子(EGF)、碱性纤维生长因子(b-FGF)的培养条件下,不贴壁生长,而是分裂增殖成多细胞的克隆球,这些克隆球富集干细胞和祖细胞,并能沿着多系分化,最终形成三维的功能球状结构[25]。克隆球被分散为单个细胞后仍具有球形成能力,因此能连续传代、扩增(图2),而其他分化细胞则由于没有血清的支持在连续传代培养中死亡,从而体外培养达到初步分离干细胞的目的。能在特定的增殖培养条件下体外成球,并且连续传代被认为是干细胞和祖细胞的特性。用有限稀释法将分散的单个细胞种植到单个孔中,通过形成克隆球的百分率,即克隆形成实验评定干细胞的自我更新能力[26]。

图2 体外培养克隆球的连续传代
注 克隆球被分散为单个细胞后仍具有球形成的能力
体外培养成球实验最初用来研究和分离哺乳动物神经系统及乳腺中的正常干细胞。后来发现肿瘤组织在体外也能形成多细胞球[27],来源于肿瘤组织的干细胞和祖细胞在无血清培养基中增殖分化形成的单克隆性球状细胞团称为肿瘤球。肿瘤球大小不等,所含细胞数数十至数百不等。肿瘤球主要用于研究乳腺癌、脑部肿瘤及神经母细胞瘤。在乳腺癌的研究中[28],发现肿瘤球中侧群细胞比例增加,表达CD44+/CD24-/low干细胞标志的细胞明显增多,过表达新生抗原和细胞保护因子,同时表达干细胞标志物Oct-4,在NOD/SCID小鼠体内具有较高的成瘤能力。Ignatova等[29]第1次在人神经胶质瘤中,分离和扩增了具有神经干细胞特性的神经球,这些细胞表达神经干细胞标志nestin,同时也表达胶质纤维酸性蛋白(GFAP)和β-tubulin Ⅲ 。神经胶质瘤原代培养形成的神经球,不仅保持了神经干细胞的特点,而且还继承了原代的组织形态和基因型。Singh等[30]在其他的脑肿瘤中分离到神经球,包括成神经管细胞瘤、毛细胞性星形细胞瘤、室管膜细胞瘤及神经节神经胶质瘤等。研究发现,这些神经球高表达CD133(prominin-1)最初被视为血液系统前体细胞标志。Singh等[31]将CD133作为脑肿瘤的起始细胞,只有CD133+细胞具有在体外的成球能力,同时在动物体内移植实验中,100个CD133+细胞就可以在NOD/SCID小鼠体内成瘤,而1×105个CD133-细胞不能形成肿瘤。因此CD133+细胞具有干细胞的自我更新特性。但近来研究表明[32],CD133-细胞也具有TSC的标志,甚至CD133-细胞产生了CD133+细胞。提示,通过细胞表面的标志物区分TSC,仍存在一定局限性。
3.2.5 小鼠体内成瘤 仅通过细胞表面标志物鉴定 TSC是远远不够的,因为没有哪一种表面抗原仅表达于干细胞,例如,CD133不仅表达在脑TSC中,同时也表达于正常TSC及许多肿瘤和正常组织的非干细胞中。所以必需将TSC标记与功能分析结合起来综合评定TSC。
自我更新和无限增殖能力是干细胞的基本功能特性,这种特性对于组织的发育至关重要。TSC不仅能启动肿瘤形成,而且可产生原代来源组织中各种类型的细胞,最终形成肿瘤组织。因此,判定TSC也必须从自我更新和增殖形成肿瘤组织两方面考虑。TSC在体外培养能形成连续传代的肿瘤球(图2),同样能在免疫缺陷小鼠体内“重建”组织结构,形成肿瘤团块,并能连续移植成瘤。能够将自我更新和形成肿瘤组织综合,功能评定TSC的最好方法就是在动物模型中接种肿瘤细胞,至少2代移植成瘤[33],是目前确定TSC的金标准。将TSC表面标记和功能分析联合来寻找TSC的方法在白血病和多种实体肿瘤中已经相继取得成功。
最近有研究对用免疫缺陷小鼠移植人类肿瘤细胞提出质疑,该研究指出[34],将10个致病的鼠源白血病细胞注射到与其配型的健康小鼠体内,所有受鼠均致病。体外成瘤实验不能反映人类肿瘤的形成及进展情况,移植小鼠不能提供人类肿瘤生长的适宜环境。
4 调节TSC的分子机制
TSC的生物学行为,以及正常干细胞或者分化细胞向TSC的转变过程,都要追溯到TSC的分子异常改变。
4.1 TSC基因改变 目前,细胞的恶性改变归因于基因的异常已得到公认。通过点突变、缺失或者重组等方式癌基因的激活或者抑癌基因的失活,导致细胞的恶性增殖。将这一理论应用于TSC,对研究TSC的起源不无裨益。已有证据证明,特定基因的改变在决定靶细胞的恶变中起至关重要作用,如PTEN抑癌基因的丧失会导致β-catenin活性的升高,这一过程被认为在正常干细胞向TSC转变中起关键作用[35]。
在肿瘤中存在多种沉默基因,基因的沉默是DNA甲基化和组蛋白共价修饰相互作用的结果。已发现一些蛋白家族通过修饰组蛋白来控制基因表达,主要有三空腔结构蛋白(trithorax group,TrxG)和多梳状结构蛋白(polycomb group proteins,PcG),在基因的调控中发挥相反的作用,如TrxG 使H3K4(histone 3 lysine 4)甲基化对基因的表达起正调节作用, 而PcG作用于H3K27则抑制基因表达。异常的TrxG和PcG会导致基因表达改变,导致肿瘤形成。
PcG家族蛋白在维持基因抑制状态中发挥作用。许多干细胞的基因受PcG控制。Schlesinger等[36]发现在有PcG作用的干细胞中肿瘤特异的启动子甲基化,相对于非PcG作用的干细胞高20倍。PcG 包括两种形式:PRC1 和 PRC2。通过纯化发现,人类PRC1包括Bmi-1、RNF2、 hPC1-3和hPH1-3等亚单位;PRC2 包括核心成分enhancer of zeste-2 (EZH2)、suppressor of zeste-12( SUZ12) 和embryonic ectoderm development(Eed)。PRC1 (如 Bmi-1) 和PRC2 (如 EZH2) 的核心成分在肿瘤细胞中广泛扩增或过表达[37,38]。药物干扰PCR2依赖的基因抑制,结果诱导了肿瘤细胞的凋亡,而非肿瘤细胞不受影响[39]。Eed在肿瘤细胞和非分化的胚胎干细胞中表达,而在分化细胞中不表达[40]。同样,高水平的SUZ12只在肿瘤细胞中被检测到,而正常细胞中却没发现[41]。可见,PRC各组分的表达改变与肿瘤的形成密切相关,同时也给肿瘤的形成及TSC的研究带来线索。
4.2 TSC的调节通路 经过大量的研究,已发现了调节干细胞的几条主要通路,如Notch、Hedgehog、WNT、PETEN及P53等,在调节干细胞自我更新与分化中发挥重要作用。目前,各通路中的主要基因及调节分子逐渐被人们所熟知(表2),将成为抗癌治疗靶点。
TSC与正常干细胞的基因及蛋白表达、调节通路具有很大的相似性,因此必须对TSC的分子机制充分了解,才能寻找TSC和正常干细胞的区别,为高效的临床诊断与抗肿瘤治疗提供线索。
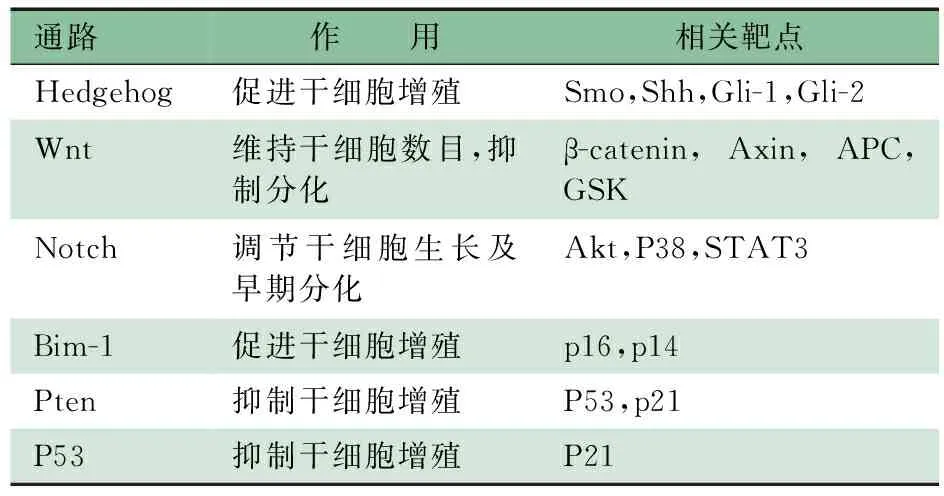
表2 干细胞通路作用及相关靶点
5 TSC与肿瘤的临床诊断和治疗
5.1 TSC与临床诊断 目前,人们已经开始尝试TSC用于肿瘤的临床诊断,如能在肿瘤原发部位及转移部位,在肿瘤转移前期及良性肿瘤向恶性肿瘤转变早期检测到TSC,无疑将给肿瘤的临床诊断带来极大的帮助。
ALDH1是一种在干细胞中高表达的酶,该酶与干细胞的功能调节有关[42]。在体外将甲醛固定过的乳腺癌肿瘤组织用ALDH1进行免疫组化染色,发现30%的乳腺癌病理组织呈现ALDH1弱阳性表达,ALDH1的表达与临床预后密切相关,ALDH1阳性者预后明显较差[43]。那么能否将ALDH1作为一种简单而有力的临床诊断标准?在转基因小鼠中,发现ALDH1的缺乏并不能反映造血干细胞的功能状态[44]。而且ALDH1的异构体ALDH1A3也能被ALDEFLUOR染色。
另外,Abraham等[45]还用CD44、CD24单克隆抗体双标检测乳腺癌病理组织,呈现CD44+/CD24-/low的肿瘤组织比例不到10%,而且与病理类型及临床预后均无相关性,却与淋巴结转移及肿瘤分期有关。同样在其他肿瘤中,用相应的TSC标记寻找干细胞的方法很难应用于临床。
要想在临床上应用TSC诊断肿瘤,首先要有强有力的方法分离鉴定TSC,同时还需要两种或多种方法联合应用。建立简单有效的方法,最终达到诊断肿瘤的目的。
5.2 TSC与临床治疗 传统的放疗和化疗治疗恶性肿瘤主要针对肿瘤中的快速增殖细胞,而不是TSC。虽然短期内肿瘤快速缩小,但远期疗效不佳,复发率高。原因为首先TSC处于相对静止期,偶尔进入细胞周期;再者,干细胞比成熟分化细胞更有耐药性,干细胞表达ABCG2、抗凋亡蛋白,具有增强的DNA修复能力[46]。针对TSC的治疗主要可以分为两种模式,一种是诱导TSC分化,另一种是抑制或清除TSC。
5.2.1 肿瘤分化治疗 通过诱导癌细胞分化,从而防止癌细胞进一步增殖,称为肿瘤分化治疗。这样的尝试在1980年已经开始,到目前唯一成功的例子是用全反式维甲酸(ATRA)诱导早幼粒细胞分化来治疗急性早幼粒细胞白血病(APL)。大部分APL都有t(15:17)(q22:q21)染色体易位和PML-RARapha融合基因,阻止了粒细胞的分化。ATRA治疗APL取得了显著的疗效,完全缓解率达到95%,长期生存率也达到75%左右[47]。但是ATRA不能清除白血病克隆,所以必须与化疗药物联合应用。对于初发患者,ATRA与化疗药物联合治疗相对于单用化疗药物有较高的完全缓解率和较低的复发率。用ATRA与低剂量的化疗药联合维持治疗,可进一步降低复发率。对于初发APL的患者,如果ATRA与As2O3联合治疗,相对于任何一种单一化疗药物,会取得更好的缓解率和生存率[48],使APL成为可以治愈的恶性血液系统肿瘤。
近年来,开展了许多新的诱导分化治疗恶性肿瘤的研究。Butler等[49]研究发现,一些染色体修饰酶使癌细胞维持在增殖周期,而不进入分化通路,所以通过转变异常的染色体修饰酶,可以达到促进癌细胞分化的最终目的。已发现组蛋白脱乙酰基酶抑制剂辛二酰苯胺异羟肟酸(SAHA)在红细胞白血病细胞的体外培养中具有促细胞分化作用,已试验性用于肿瘤的分化治疗中[49]。
5.2.2 抑制或消除治疗 基于TSC假说,抑制和消除TSC无疑是治疗恶性肿瘤的彻底、有效的方法。
5.2.2.1 依赖TSC表面抗原治疗 依赖细胞表面抗原治疗包括肿瘤疫苗和单克隆抗体治疗两种形式。
肿瘤疫苗是指通过激活机体免疫系统对抗肿瘤细胞。针对TSC的肿瘤疫苗就需要对TSC的起源有透彻的认识。研究者已经发现造血系统干细胞不是慢性粒细胞白血病的细胞起源,真正的起源是成血管细胞[50]。因此需要对TSC的分子机制有更深入的了解才能建立有效的药物治疗。
TSC和分化细胞中的基因表达有明显的不同[51]。通过分析TSC基因表达,寻找TSC特有的表面抗原,从而为免疫治疗提供靶点。最近的报道称黏附分子CD44不同程度地表达于各种组织来源的TSC和正常干细胞,成为抗体治疗很有前景的靶点[52]。已有证据证实CD44已经成功地消除了人类AML移植免疫缺陷小鼠中的干细胞[53]。
5.2.2.2 特异分子治疗 有效的肿瘤特异性治疗应选择性地针对一些主要的关键调节基因及信号通路(表2)。
目前,抗肿瘤治疗的最大障碍是肿瘤细胞的耐药性。癌症细胞的抗药性是多基因事件,基因的改变是抗药性形成的主要原因,实验发现,用DNA甲基化酶及组蛋白去乙酰基酶抑制剂能够逆转这些改变,使肿瘤对化疗药物敏感[54]。
治疗肿瘤的方法正在不断涌现,根据肿瘤的分期选择,选择多种合适的治疗方法的组合,肿瘤的根治也将会成为可能。但必须认识到,肿瘤的治疗还有许多困难需要克服,首先,要深入认识不同组织来源的恶性肿瘤的干细胞,从基因及蛋白水平探索TSC与正常干细胞以及其他非TSC的不同之处,这样才能建立有效而且特异的肿瘤治疗策略;再者,还要进一步了解TSC在恶性肿瘤转移中的作用,抑制肿瘤转移,从而将肿瘤局限于原发部位;最后,还应该开辟新的治疗途径,如研究干细胞灶龛在TSC形成中的作用及其起源和分子机制,为肿瘤转移和治疗开辟新的途径。
TSC假说提出了只有一小部分肿瘤细胞产生肿瘤并维持肿瘤生长及异质性,与肿瘤的发生、转移以及复发有着直接的联系,彻底有效地根除肿瘤需要既消灭TSC又避免伤害正常的干细胞,因此发展TSC的筛选鉴定方法,进一步开发只针对TSC的药物以及治疗方法为肿瘤的治疗带来了全新的理念。
[1]Pardal R,Clarke MF,Morrison SJ.Applying the principles of stem-cell biology to cancer.Nat Rev Cancer,2003,3(12):895-902
[2]Moore KA,Lemischka IR.Stem cells and their niches.Science,2006,311(5769):1880-1885
[3]Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell.Nat Med,1997,3(7):730-737
[4]Al-Hajj M,Wicha MS,Benito HA.Prospective identification of tumorigenic breast cancer cells.Proc Natl Acad Sci,2003,100(7):3983-3988
[5]Slack J.Stem cells in epithelial tissues.Science,2000,287(5457):1431-1433
[6]Molofsky AV,Pardal R,Morrison SJ.Diverse mechanisms regulate stem cell self-renewal.Curr Opin Cell Biol,2004,16(6):700-707
[7]Boman BM, Wicha M, Fields JZ,et al.Symmetric division of cancer stem cells: A key mechanism in tumor growth that should be targeted in future therapeutic approaches.Clin Pharmacol Ther,2007,81(6):893-898
[8]Lemischka IR, Jordan CT.The return of clonal marking sheds new light on human hematopoietic stem cells.Nat Immunol,2001,2(1):11-12
[9]Morrison SJ, Weissman IL.The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype.Immunity,1994,1(8):661-673
[10]Davis AA,Temple S.A self-renewing multipotential stem cell in embryonic rat cerebral cortex.Nature,1994,372(6503):263-266
[11]Kondo T,Setoguchi T,Taga T.Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell lin.Proc Natl Acad Sci,2004, 101(3):781-786
[12]Seo DC,Sung JM,Cho HJ,et al.Gene expression profiling of cancer stem cell in human lung adenocarcinoma A549 cells.Mol Cancer,2007,6(1):75-82
[13]Dontu G, Abdallah WM, Foley JM,et al.In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells.Genes Dev,2003,17(10):1253-1270
[14]Hirschmann-Jax C,Foster AE,Wulf GG,et al.A distinct "side population" of cells with high drug efflux capacity in human tumor cells.Proc Natl Acad Sci,2004,101(39):14228-14233
[15]Welm BE,Tepera SB,Venezia T,et al. Sca-1(pos) cells in the mouse mammary gland represent an enriched progenitor cell population.Dev Biol,2002,245(1):42-56
[16]Alvi AJ,Clayton H,Joshi C,et al.Functional and molecular characterisation of mammary side population cells.Breast Cancer Res,2003,5(1):1-8
[17]Montanaro F,Liadaki K,Schienda J,et al.Demystifying SP cell purification: viability, yield, and phenotype are defined by isolation parameters.Exp Cell Res,2004,298:144-154
[18]Pearce DJ,Bonnet D.The combined use of Hoechst efflux ability and aldehyde dehydrogenase activity to identify murine and human hematopoietic stem cells.Exp Hematol,2007,35(9):1437-1446
[19]Sophos NA, Vasiliou V.Aldehyde dehydrogenase gene superfamily:the 2002 update.Chem Biol Interact,2003,143-144:5-22
[20]Armstrong L,Stojkovic M,Dimmick I,et al.Phenotypic characterization of murine primitive hematopoietic progenitor cells isolated on basis of aldehyde dehydrogenase activity.Stem Cells,2004,22(7):1142-1151
[21]Hess DA, Wirthlin L,Craft TP,et al.Selection based on CD133 and high aldehyde dehydrogenase activity isolates long-term reconstituting human hematopoietic stem cells.Blood,2006,107(5):2162-2169
[22]Corti S,Locatelli F,Papadimitriou D,et al.Identification of a primitive brain-derived neural stem cell population based on aldehyde dehydrogenase activity.Stem Cells,2006,24(4):975-985
[23]Ucar D,Cogle CR,Zucali JR,et al.Aldehyde dehydrogenase activity as a functional marker for lung cancer.Chem Biol Interact,2009,178:48-55
[24]Croker AK,Goodale D,Chu J,et al.High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. J Cell Mol Med,2009,13(8B):2236-2252
[25]Tropepe V, Sibilia M, Ciruna BG, et al.Distinct neural stem cells proliferate in response to EGF and FGF in the developing mouse telencephalon.Dev Biol,1999,208(1):166-188
[26]Singec I,Knoth R,Meyer RP,et al.Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology.Nat Methods,2006,3(10):801-806
[27]Nicolis SK.Cancer stem cells and "stemness"genes in neuro-oncology. Neurobiol Dis,2007,25(2):217-229
[28]Ponti D,Costa A,Zaffaroni N,et al.Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties.Cancer Res,2005,65(13):5506-5511
[29]Ignatova TN, Kukekov VG, Laywell ED.Human cortical glial tumors contain neural stem-like cells expressing astroglial andneuronal markers in vitro.Glia, 2002,39(3):193-206
[30]Singh SK,Clarke ID,Terasaki M,et al.Identification of a cancer stem cell in human brain tumors.Cancer Res,2003,63(18):5821-5828
[31]Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells.Nature,2004,432(7015):396-401
[32]Wang J,Sakariassen PO,Tsinkalovsky O,et al.CD133 negative glioma cells form tumors in nude rats and give rise to CD133 positive cells.Cancer,2008,122 (4):761-768
[33]Clarke MF,Dick JE,Dirks PB,et al.Cancer stem cells-perspectives on current status and future directions: AACR Workshop on cancer stem cells.Cancer Res, 2006,66(19):9339-9344
[34]Kelly PN,Dakic A,Adams JM,et al.Tumor growth need not be driven by rare cancer stem cells.Science,2007,317(5836):337
[35]Yilmaz OH,Valdez R,Theisen BK,et al.Pten dependence distinguishes haematopoietic stem cells from leukaemia-initiating cells.Nature,2006,441(7092):475-482
[36]Schlesinger Y,Straussman R,Keshet I,et al.Polycomb-mediated methylation on Lys27 of histone H3 pre-marks genes for de novo methylation in cancer.Nat Genet,2007,39(2):232-236
[37]Valk-Lingbeek ME,Bruggeman SW,van Lohuizen M.Stem cells and cancer;the polycomb connection.Cell,2004,118(4):409-418
[38]Raaphorst FM,Meijer CJ,Fieret E,et al.Poorly differentiated breast carcinoma is associated with increased expression of the human polycomb group EZH2 gene.Neoplasia,2003,5(6):481-488
[39]Tan J,Yang X,Zhuang L,et al.Pharmacologic disruption of Polycombrepressivecomplex 2-mediated gene repression selectively induces apoptosis in cancer cells.Genes Dev,2007,21(9):1050-1063
[40]Kuzmichev A,Margueron R,Vaquero A,et al.Composition and histone substrates of polycomb repressive group complexes change during cellular differentiation.Proc Natl Acad Sci,2002,102(6):1859-1864
[41]Squazzo SL,O′Geen H,Komashko VM,et al.Suz12 binds to silenced regions of the genome in a cell-type-specific manner.Genome Res,2006,16(7):890-900
[42]Duester G.Families of retinoid dehydrogenases regulating vitamin A function: production of visual pigment and retinoic acid.Eur J Biochem ,2000, 267(14):4315-4324
[43]Ginestier C,Hur MH,Charafe JE,et al.ALDH1 Is a Marker of Normal and Malignant Human Mammary Stem Cells and a Predictor of Poor Clinical Outcome.Cell Stem Cell,2007,1(5):555-567
[44]Levi BP, Yilmaz OH, Duester G, et al. Aldehyde dehy- drogenase 1 is dispensable for stem cell function in the mousehematopoietic and nervous systems.Blood,2009,113(8):1670-1680
[45]Abraham BK,Fritz P,McClellan M,et al.Prevalence of CD44+/CD24-/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis.Clin Cancer Res,2005,11(3):1154-1159
[46]Eyler CE,Rich JN.Survival of the fittest:Cancer stem cells in therapeutic resistance and angiogenesis.Clin Oncol,2008,26(17):2839-2845
[47]Lo Coco F,Nervi C,Avvisati G,et al.Acute promyelocytic leukemia:a curable disease.Leukemia,1998,12(12):1866-1880
[48]Shen ZX,Shi ZZ,Fang J,et al.All-trans retinoic acid/As2O3 combination yields a high quality remission and survival in newly diagnosed acute promyelocytic leukemia.Proc Natl Acad Sci,2004,101(15):5328-5335
[49]Butler LM,Zhou X, Xu WS,et al.The histone deacetylase inhibitor SAHA arrests cancer cell growth, upregulates thioredoxin-binding protein-2,and down regulates thioredoxin.Proc Natl Acad Sci,2002,99(18):11700-11705
[50]Fang B,Zheng C,Liao L,et al.Identification of human chronic myelogenous leukemia progenitor cells with hemangioblastic characteristics.Blood,2005,105(7):2733-2740
[51]Akashi K, He X, Chen J,et al.Transcriptional accessibility for genes of multiple tissues and hematopoietic lineages is hierarchically controlled during early hematopoiesis.Blood,2003,101(2):383-389
[52]Miletti-Gonzalez KE,Chen S,Muthukumaran N,et al. The CD44 receptor interacts with P-glycoprotein to promote cell migration and invasion in cancer.Cancer Res,2005,65(15):6660-6667
[53]Jin L,Hope KJ,Zhai Q,et al.Targeting of CD44 eradicates human acute myeloid leukemic stem cells.Nat Med,2006,12(10):1167-1174
[54]Perez PC,Duenas GA.Can the state of cancer chemotherapy resistance be reverted by epigenetic therapy?Mol Cancer,2006,5:27
