孟鲁司特治疗婴幼儿喘息疗效和安全性系统评价
2010-01-23李维辛刘雅莉孙应彪
张 宏 李维辛 刘雅莉 孙应彪
目前,白三烯受体拮抗剂是除糖皮质激素之外唯一可单独应用的长期控制哮喘发作的药物,可作为轻度哮喘的替代治疗药物和中重度哮喘的联合治疗用药。白三烯受体拮抗剂可减轻哮喘症状、改善肺功能和减少哮喘恶化,对轻中度哮喘、运动性哮喘和冷空气诱发的哮喘均有较好疗效[1]。孟鲁司特(商品名顺尔宁)是高选择性半胱氨酸白三烯D4(LTD4)受体拮抗剂,用于预防和长期治疗≥12岁的哮喘患者;2000年3月美国FDA批准用于预防和长期治疗2~5岁哮喘患儿。多项研究表明[2~4],孟鲁司特能减轻≥2岁哮喘患儿的哮喘症状,且有很好的安全性和耐受性。但对于<2岁婴幼儿喘息的疗效及安全性尚无明确结论。因此,本研究检索相关数据库,收集2010年3月前发表的孟鲁司特治疗<2岁喘息患儿的RCT文献,对有效性及安全性指标进行系统评价,以期为临床合理治疗提供循证依据。
1 方法
1.1 文献纳入和排除标准 ①RCT研究。②诊断为支气管哮喘或喘息的患儿;年龄<2岁,种族不限。③哮喘或喘息的诊断符合目前国内外公认的标准[5,6]。④治疗组予孟鲁司特;对照组予安慰剂;剂量和疗程不限。⑤文献语种、发表年限不限。⑥无1.2项下主要和次要观察指标或无法提取资料的文献予以排除。
1.2 疗效判定指标 主要结局指标:①喘息相关病死率; ②喘息症状(包括临床症状评分) ;③使用喘息缓解药物(β2受体激动剂或糖皮质激素)治疗需求量。次要结局指标:①不良反应发生率;②生活质量。
1.3 文献检索
1.3.1 数据库 西文数据库包括EMBASE、PubMed、在研对照试验数据库(databases of ongoing trials-current controlled trials, www.controlled-trials.com)和Cochrane图书馆;中文数据库包括中文科技期刊全文数据库、中国期刊全文数据库和万方数字化期刊群。检索时间均从建库至2010年3月。
1.3.2 检索策略 英文检索词:asthma、wheeze、infant、montelukast、leulzotriene receptor antagonist、 montelukast sodium、singulair;中文检索词:哮喘、喘息、婴幼儿、孟鲁司特、白三烯受体拮抗剂和顺尔宁。检索策略采用主题词与自由词相结合的方式,并根据具体数据库调整,所有检索策略均通过多次预检索后确定。另外,手工检索相关会议论文集、药厂资料及所有纳入文献中的参考文献。
1.4 纳入和排除文献 本文作者张宏和李维辛分别独立阅读经检索所获文献题目和摘要,在排除明显不符合纳入标准的文献后,对可能符合纳入标准的文献阅读全文,以确定是否真正符合纳入标准;两者有分歧时与本文通讯作者孙应彪讨论确定。
1.5 文献资料提取 ①纳入文献的一般情况:作者、发表时间、设计类型、样本量、年龄、干预措施、基线资料的可比性、药物剂量和疗程等;②1.6项中文献质量评价的相关内容;③主要和次要结局指标。
1.6 文献质量评价 采用Cochrane评价手册5.0.2 版推荐的质量评价标准评价纳入文献的方法学质量,包括6项:①随机分配方法;②分配方案隐藏;③对研究对象、治疗方案实施者、研究结果测量者采用盲法;④结果数据的完整性;⑤选择性报告研究结果;⑥ 其他偏倚来源。针对每篇纳入文献,对上述6项作出“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”(缺乏相关信息或偏倚情况不确定)的判断。
1.7 统计学方法 采用RevMan 5.0软件进行Meta分析。连续性变量采用均数差(MD),二分类变量采用RR及其95%CI表示。首先对纳入研究进行临床异质性和方法学异质性分析;再采用χ2检验分析统计学异质性,若P>0.1 和I2<50%,说明无统计学异质性,采用固定效应模型进行分析。若存在统计学异质性(P< 0.1,I2≥50%)时,先分析异质性来源,对不同药物使用亚组分析,对交叉设计的文献进行敏感性分析;若仍不能消除异质性,数据从临床意义角度能够进行合并者,则采用随机效应模型进行合并分析。P<0.05为差异有统计学意义。若纳入文献提供的数据不能进行Meta 分析,则进行描述性分析。
2 结果
2.1 一般情况 初检获得相关文献906篇(英文文献897篇,中文文献9篇),未检出灰色文献。通过阅读文题和摘要,7篇RCT文献可能符合纳入标准;通过阅读文献排除1篇无安慰剂对照的文献[7],最终纳入6篇RCT文献[8~13],文献的筛选流程见图1。

图1 文献筛选流程图
Fig 1 Flow chart of article screening and selection process
文献[8~12]为在研对照数据库登记的研究。纳入的6篇文献实施地分别为以色列[8]、 美国[10~12]、丹麦[9,12]和比利时[13],其中4篇[8~10,12]为多中心研究。研究时间最长为4年。纳入的样本量最大为952例[9],最小为12例[12]。患儿年龄为1~24个月。文献[8]纳入毛细支气管炎患儿为研究对象;文献[9,13]以呼吸道合胞病毒(RSV)感染所致毛细支气管炎患儿为研究对象;文献[10]以哮喘或有哮喘类似症状患儿为研究对象;文献[11,12]以毛细支气管炎或有喘息类似症状患儿为研究对象。2篇文献[8,9]报告了患儿的依从性>90%,其余文献未描述;2篇文献报告失访率分别为21.7%[9]和32.1%[13]。纳入6篇RCT文献的一般情况见表1。
2.2 纳入文献的质量评价 4篇文献[8~10,12]详细描述了随机化分组的方法,3篇文献[8,9,13]描述了分配隐藏,6篇文献[8~13]均采用双盲法,5篇文献[8~12]存在选择性报告研究结果,2篇文献[8,9]描述了其他偏倚来源。4篇文献[9~12]进行了ITT分析,5篇文献[8~12]的报告结果符合在研试验对照数据库中登记的研究方案,4篇文献[8~10,13]孟鲁司特组和安慰剂组的基线具可比性,并给出详细资料,1篇文献[11]的基线水平有差异,但无显著临床意义。
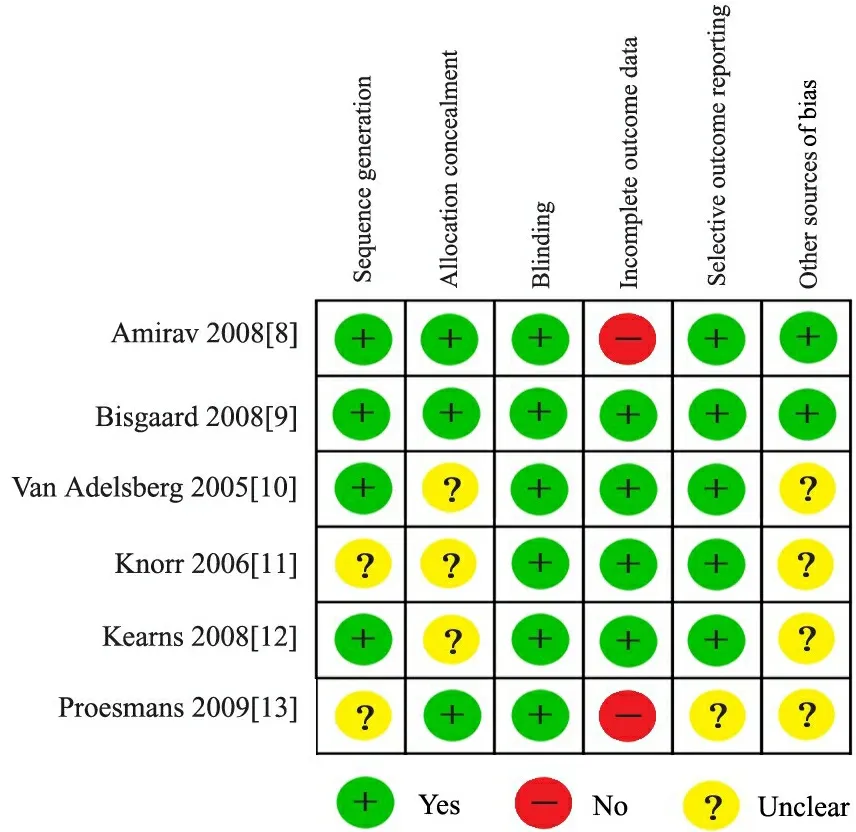

图2 纳入6篇RCT文献的质量评价结果
Notes T:treatment; C:control; MLK:montelukast;w:weeks
2.3 系统评价结果
2.3.1 病死率 6篇纳入的RCT文献均无喘息相关死亡的报道。文献[9]报道研究期间有2例患儿死亡,其中1例死于呼吸窘迫综合征和脓毒症,1例死于房间火灾热灼伤。研究者经评价认为与使用孟鲁司特无关。
2.3.2 喘息症状评分 2篇RCT文献[8,9]报道了喘息的临床症状评分,因各文献纳入的患儿年龄、孟鲁司特的治疗疗程以及症状评分的方法均不同,无法进行Meta分析,进行描述性分析。
文献[8]报道了孟鲁司特组与安慰剂组的喘息临床症状评分(采用Wang氏评分法[14]),结果显示,安慰剂组临床症状评分低于孟鲁司特组,(4.8±2.2)分vs(6.1±2.4)分,但差异无统计学意义(P=0.06)。
文献[9]报道了孟鲁司特组和安慰剂组的喘息临床症状评分(根据患儿咳嗽、喘息、干湿啰音和胸部矛盾运动评分)。治疗4周时的临床症状评分:孟鲁司特4 mg·d-1亚组为0.59±0.48 ,孟鲁司特8 mg·d-1亚组为0.60±0.47,安慰剂组为0.61±0.51,3组差异总体上无统计学意义(P>0.05);治疗24周时的临床症状评分:孟鲁司特4 mg·d-1亚组为0.34±0.35,孟鲁司特8 mg·d-1亚组为0.37±0.37,安慰剂组为0.39±0.39,3组差异总体上无统计学意义(P>0.05)。
2.3.3 使用喘息缓解药物治疗需求量 文献[9,10,13]报道了研究期间使用喘息缓解药物治疗需求量,因各研究观察的指标不同,无法进行Meta分析,故而进行描述性分析。
文献[9]报道了孟鲁司特组和安慰剂组使用β2受体激动剂和全身糖皮质激素天数的百分比。治疗4周未使用β2受体激动剂天数的百分比:孟鲁司特4 mg·d-1亚组为(63.6±31.2)%,孟鲁司特8 mg·d-1亚组为(66.2±29.2)%,安慰剂组为(66.2±32.1)%,3组差异总体上无统计学意义(P>0.05);治疗24周全身糖皮质激素使用的百分比:孟鲁司特4 mg·d-1亚组为22.5%,孟鲁司特8 mg·d-1亚组为19.4%,安慰剂组为19.2%,3组差异总体上无统计学意义(P>0.05)。
文献[10]报道了孟鲁司特组和安慰剂组未使用β2受体激动剂天数、每天使用β2受体激动剂人数和口服糖皮质激素的百分比。未使用β2受体激动剂天数的百分比:孟鲁司特组为(66.5±33.1)%,安慰剂组为(59.5±33.1)%,两组差异无统计学意义(P=0.081)。每天使用β2受体激动剂的人数:孟鲁司特组为0.75±0.90,安慰剂组为0.87±0.80,两组差异无统计学意义(P=0.218)。需口服糖皮质激素的百分比:孟鲁司特组为14.9%,安慰剂组为7.4%,两组差异无统计学意义(P=0.106)。
文献[13]报道了治疗期间需吸入糖皮质激素治疗的人数,孟鲁司特组为5/31例,安慰剂组为3/27例,两组差异无统计学意义(P=0.72),两组均无患儿使用口服糖皮质激素治疗。
2.3.4 药物不良反应发生率 6篇文献[8~13]均报道了研究过程中药物不良反应的发生率,均报道患儿对孟鲁司特有较好的耐受性。6篇文献均报道孟鲁司特组和安慰剂组有不同程度的不良反应发生,但两组差异无统计学意义(P>0.05)。由于每篇文献报道的不良反应不尽相同,存在显著的异质性,无法进行Meta分析,进行描述性分析。
文献[8]报道研究期间发现10种药物不良反应,未见严重不良反应,没有因药物不良反应退出研究的患儿。
文献[9]报道孟鲁司特4 mg·d-1亚组、8 mg·d-1亚组和安慰剂组临床不良反应的发生率分别为84.1%、82.1%和81.4%,药物相关不良反应的发生率分别为4.4%、2.8%和4.1%,严重不良反应(包括肺炎、细支气管炎、肠胃炎和药物过量等)发生率分别为13.0%、16.6%和16.0%,因临床不良反应而退出研究分别为1.9%、2.8%和2.8%,生化指标异常发生率分别为9.0%、8.2%和8.4%,因生化指标异常退出研究分别为0.6%、1.6%和0.3%。3组间上述不良反应、生化指标异常发生率及退出研究人数的比例差异均无统计学意义(均P>0.05)。
文献[10]报道孟鲁司特组与安慰剂组临床不良反应发生率差异无统计学意义。常见的不良反应为上呼吸道感染、哮喘、发热、腹泻和呕吐,两组发生率均>10%,两组各有3例因不良反应而退出。生化指标异常发生率两组均<5%,差异无统计学意义,没有患儿因生化指标异常而退出研究。
文献[11]报道8例患儿发现24种临床不良反应,未见严重的不良反应发生,无患儿因不良反应而退出研究;常见的不良反应是哮喘和腹泻;认为腹泻和恶心等不良反应与孟鲁司特相关。孟鲁司特组和安慰剂组分别有2例和1例患儿出现贫血,研究者认为与孟鲁司特无关。
文献[12]报道1~3月龄患儿对孟鲁司特4或8 mg·d-1亚组均有良好的安全性和耐受性,未见严重的临床不良反应发生,常见的不良反应有喘息、腹泻、呕吐和发热等,孟鲁司特组和安慰剂组均有发生,研究者认为与药物无关;孟鲁司特组3例患儿AST升高(治疗14~41 d),研究者认为可能与药物相关,但不严重。
2.3.5 生活质量 纳入的6篇RCT文献均无患儿生活质量的研究报道。
3 讨论
3.1 纳入文献的总体质量 本系统评价纳入的6篇RCT文献中,4篇文献[8~10,12]详细描述了随机化分组的方法,3篇文献[8,9,13]描述了分配隐藏,6篇文献均采用双盲法,5篇文献[8~12]存在选择性报告研究结果,2篇文献[8,9]描述了其他偏倚来源。提示本系统评价纳入的文献质量较好,证据等级强度中等。
3.2 孟鲁司特治疗<2岁喘息患儿的疗效 本系统评价纳入6篇RCT文献,由于临床异质性的原因,无法进行Meta分析。系统评价结果显示,在毛细支气管炎急性期患儿的研究中[8],孟鲁司特组和安慰剂组喘息临床症状评分差异无统计学意义,提示孟鲁司特在因毛细支气管炎住院的<2岁喘息患儿治疗中无明显优势。与Bisgaard等[15]研究结果相似,孟鲁司特在喘息发作或恶化时治疗无效。在RSV感染所致毛细支气管炎患儿研究[10],孟鲁司特4和8 mg·d-1亚组在治疗4周和24周时的哮喘临床症状评分与安慰剂组差异无统计学意义。一项纳入RSV感染所致的毛细支气管炎3~36个月患儿双盲RCT研究显示[16],孟鲁司特组与安慰剂组的无症状天数的百分比分别为22%和4%,两组差异有统计学意义(P=0.015),提示孟鲁司特能增加症状缓解的天数,降低喘息的发作,但同时指出孟鲁司特在毛细支气管炎感染的前2周无明显疗效。Harmanci等[17]对2~5岁哮喘患儿的研究显示,使用孟鲁司特12个月,能使哮喘恶化程度减少31%,延迟了哮喘第1次发作的时间,减少了吸入糖皮质激素的使用。此外,有研究显示孟鲁司特对病毒导致喘息的2~14岁患儿有效[18]。本系统评价结果显示,在喘息临床症状评分及β2受体激动剂、糖皮质激素使用方面,孟鲁司特组与安慰剂组差异均无统计学意义,提示目前的研究证据不能证明孟鲁司特在治疗<2岁喘息患儿中的优势。
3.3 孟鲁司特治疗<2岁喘息患儿的安全性 本系统评价结果显示,研究期间无药物相关死亡及喘息并发症(如呼吸衰竭等)的发生。孟鲁司特组和安慰剂组均有不同程度的不良反应发生,表现为腹泻、呕吐、发热、喘息、AST增高和贫血等,两组不良反应发生率差异均无统计学意义。提示,<2岁患儿口服孟鲁司特4~8mg·d-1有较好的安全性和耐受性,但由于本系统评价纳入的RCT文献孟鲁司特最长疗程为20周,故孟鲁司特的长期安全性和耐受性目前尚不能确定。
哮喘患儿治疗时间较长,除要考虑疗效外,还有考虑不良反应,也应当关注哮喘治疗期间的生活质量,本研究正是考虑到这一方面在次要结局指标中特别设计了生活质量指标的项目,但遗憾的是纳入的6篇文献均未观察生活质量指标,应当在今后的相关研究中给予重视。
本系统评价的不足之处和局限性:①本系统评价仅纳入了中英文及公开发表的文献,对灰色文献的检索可能不够全面,而且可能存在发表偏倚。②纳入的2篇RCT文献的失访率较高,分别为21.7%和32.1%;同时纳入RCT文献中研究对象的年龄和孟鲁司特疗程不同,存在明显的临床异质性,无法采用Meta分析对相关指标进行定量合并。
本研究结果显示,目前尚无足够证据证明孟鲁司特在治疗<2岁婴幼儿喘息中有明显疗效,但孟鲁司特治疗20周也未见明显的不良反应。
[1]Chipps BE. Asthma in infants and children. Clin Cornerstone,2008,8(4):44-61
[2]Knorr B, Franchi LM, Bisgaard H, et al. Montelukast, a leukotriene receptor antagonist, for the treatment of persistent asthma in children aged 2 to 5 years. Pediatrics, 2001,108(3):34
[3]Reiss TF, Chervinsky P, Dockhorn RJ, et al.Montelukast, a once-daily leukotriene receptor antagonist, in the treatment of chronic asthma: a multicenter, randomized, double-blind trial. Montelukast Clinical Research Study Group.Arch Intern Med, 1998,158(11):1213-1220
[4]Knorr B, Matz J, Bernstein JA, et al.Montelukast for chronic asthma in 6- to 14-year-old children: a randomized, double-blind trial. Pediatric Montelukast Study Group.JAMA,1998,279(15):1181-1186
[5]Global strategy for asthma management and prevention. Global Initiative for Asthma(Gina), 2006. Available at: www.ginasthma.org
[6]中华医学会儿科学分会呼吸学组. 儿童支气管哮喘诊断与防治指南.Chin J Pediatr(中华儿科杂志), 2008, 46(10):745-753
[7]Migoya E, Kearns GL, Hartford A, et al.Pharmacokinetics of montelukast in asthmatic patients 6 to 24 months old.J Clin Pharmacol, 2004,44(5):487-494
[8]Amirav I, Luder AS, Kruger N, et al.A double-blind, placebo-controlled, randomized trial of montelukast for acute bronchiolitis. Pediatrics,2008,122(6):1249-1255
[9]Bisgaard H, Flores-Nunez A, Goh A, et al.Study of montelukast for the treatment of respiratory symptoms of post-respiratory syncytial virus bronchiolitis in children. Am J Respir Crit Care Med,2008,178(8):854-860
[10]Van Adelsberg J, Moy J, Wei LX,et al. Safety, tolerability, and exploratory efficacy of montelukast in 6- to 24-month-old patients with asthma. Curr Med Res Opin,2005 ,21(6):971-979
[11]Knorr B, Maganti L, Ramakrishnan R, et al.Pharmacokinetics and safety of montelukast in children aged 3 to 6 months. J Clin Pharmacol,2006,46(6):620-627
[12]Kearns GL, Lu S, Maganti L, et al.Pharmacokinetics and safety of montelukast oral granules in children 1 to 3 months of age with bronchiolitis. J Clin Pharmacol,2008,48(4):502-511
[13]Proesmans M, Sauer K, Govaere E, et al.Montelukast does not prevent reactive airway disease in young children hospitalized for RSV bronchiolitis.Acta Paediatr,2009 ,98(11):1830-1834
[14]Wang EE, Milner RA, Navas L, et al. Observer agreement for resperatory signs and oximetry in infants hospitalized with lower respiratory infections. Am Rev Respir Dis,1992,145(1):106-109
[15]Bisgaard H, Zielen S, Garcia-Garcia ML, et al. Montelukast reduces asthma exacerbations in 2-to 5-year-old children with intermitten asthma. Am J Respir Crit Care Med,2005,171(4):315-332
[16]Bisgaard H. Study Group on Montelukast and Respiratory Syncytial Virus. A randomized trial of montelukast in respiratory syncytial virus postbronchiolitis. Am J Respir Crit Care Med,2003,167(3):379-383
[17]Harmanci K, Bakirtas A, Turktas I, et al. Oral montelukast treatment of preschool-aged children with acute asthma. Ann Allergy Asthma Immunol,2006,96(5):731-735
[18]Robertson CF, Price D, Henry R, et al. Short-course montelukast for intermittent asthma in children: a randomized controlled trial. Am J Respir Crit Care Med,2007,175(4):323-329
