红树林种植-养殖耦合系统中尼罗罗非鱼的食源分析*
2010-01-23徐姗楠陈作志黄洪辉黄小平李适宇
徐姗楠,陈作志,黄洪辉,黄小平,李适宇
(1.中山大学环境科学与工程学院,广东广州510275;2.农业部海水养殖生态与质量控制重点开放实验室,中国水产科学研究院南海水产研究所,广东广州510300;3.中国科学院海洋生物资源可持续利用重点实验室,中国科学院南海海洋研究所,广东广州510301)
近年来,被誉为“蓝色农业”的海水养殖业发展迅速,逐渐成为开发利用海洋资源的重要产业[1]。海水养殖业在带来重要经济与社会效益的同时,也影响了近海的生态环境,其中养殖水环境的污染已成为制约水产养殖业持续健康发展的最突出问题[2]。因此,如何净化养殖水体,改善养殖水环境,保证养殖系统的生态安全和食品健康,是管理者、研究人员和水产从业者所面临共同挑战。红树林种植-养殖生态耦合模式即利用红树植物有效吸收水产动物生长过程中代谢产生的氮、磷等营养物质,从而降低养殖自身污染,改善海区环境,避免养殖海区富营养化,从而促进养殖水产动物健康生长。经实践证明[3],红树林种植-养殖耦合系统是一种新型的、环境友好的滩涂海水养殖模式。
在特定的生态系统中,各种生物种群之间的摄食关系、营养物质和能量流动是生态学研究的难题。目前,对天然红树林生态系统的营养关系及食物网结构已有了充分的研究[4-6],然而,人工红树林种植-养殖耦合系统中养殖动物的食物来源以及红树植物与养殖动物之间的互利耦合机制还未见报道。本研究以稳定同位素技术为手段,结合胃含物分析法,追踪和比较了不同生境中(红树林种植-养殖耦合人工系统和无红树林的对照养殖塘)大规格尼罗罗非鱼Oreochrom is niloticus的食物来源,初步评价了不同养殖系统中初级生产力对鱼类的能量贡献,为建立健康、安全、高效的滩涂养殖模式及其推广应用提供科学的理论依据。
1 材料与方法
1.1 研究地点
研究地点位于深圳市宝安区沙井镇海上田园风光旅游区(113°45′53.0″E,22°43′14.4″N)内的红树林种植-养殖系统示范区。该地区濒临珠江口东海岸,滩涂资源丰富,从东北向西南每隔2~3 km有一条河涌入海,成片鱼塘分布于河涌之间。鱼塘与河涌由围堤相隔,涨潮时(平均高潮位2.40 m,平均低潮位1.04 m)海水进入河涌,并通过水闸控制流入或流出鱼塘。该区域属南亚热带海洋季风气候,全年温暖湿润,雨量充沛,年平均气温24℃,多年平均降雨量1 875 mm。
在国家863计划的支持下,我们于2007年4月构建了红树林种植-养殖耦合系统,由1个种植木榄Bruguiera gym norrhiza纯林、1个种植红海榄Rhizophora stylosa纯林、1个种植木榄-红海榄混交林(种植比1∶1),1个不种红树植物的对照塘组成,面积共9.85×105m2,塘内养殖水直接由海排入且养殖过程不换水。采用种植岛的方式种植红树,均以1年生树苗种植,种植面积占养殖塘总面积的15%。2007年8月分别在不同系统中投放尼罗罗非鱼苗种,鱼苗体长20~30 mm,平均体质量(0.22±0.05)g,均不投饵,在天然条件下养殖。系统运转1 a后的监测结果表明,在新型种植-养殖耦合系统中,木榄-红海榄混交林养殖塘的红树生长良好,对养殖水体的净化能力也较纯林种植塘更强。本研究的尼罗罗非鱼样品均来自木榄-红海榄混交林养殖塘和无红树的对照塘内,红树处理塘以T(Treatment pond)表示,对照塘以C(Control pond)表示。
1.2 样品处理与分析
1.2.1 胃含物分析法 2008年9月至2009年1月间采用手抛网和刺网进行游泳动物采样,以10 mm体长段为取样间隔单位,共采集尼罗罗非鱼样品125尾,样品体长范围为100~280 mm,其中红树处理塘65尾,对照塘60尾。在红树塘采集的65尾中,其中空胃10个,摄食率为84.6%;对照塘60尾中,其中空胃11个,摄食率为81.7%。从尼罗罗非鱼体内取出消化道后编号,并用纱布包好置于10%福尔马林溶液中固定保存。小型食料生物种类借助双筒解剖镜和显微镜进行鉴定和计数。饵料生物的残体以及不易被消化之器官、肢体或外壳作为鉴定的依据,然后计数胃含物中各种饵料的质量和出现频率,以分析鱼类的食性组成[7]。
用于评价饵料重要性的指标为:

1.2.2 稳定同位素分析 在采集尼罗罗非鱼样品的同时,现场使用浮游生物网同步采集其可能摄食的饵料。对尼罗罗非鱼及其饵料生物分别进行处理:除去消化道的尼罗罗非鱼,取其背鳍周围肌肉适量,混合相同体长组样品,3~5尾混成1个样。底栖动物:用采泥器(0.025 m2)进行采集,每站采集4次,合并为1个样品,泥样放入底栖动物旋涡分选装置淘洗,三层套筛进行分离与筛检,及时除去胃含物并用纯水冲洗。动物组织样品冷藏带回实验室后,用冻干机(Toffod T YD-2)进行冻干处理(-60℃)48 h,最后用石英钵充分研磨后以备同位素分析。对于植物样品,每个混合样由10株红树植物的叶子混合而成,蒸馏水冲洗除去附着的碎屑,在60℃下烘干至恒质量,磨细过1 mm网筛,封口袋干燥保存。有机碎屑样品:小心采集表层1 cm沉积物样品,60℃下烘干至恒质量,过0.42 mm网筛以去除粗糙颗粒(主要是草根和贝壳等),混匀磨细,干燥保存。底栖微藻:在潮滩或种植岛的可见底栖硅藻斑块上,铺上经前处理的商业沙薄层,用过滤的塘内水保持沙湿润。1~2 h后,取下尼龙网及其上层沙放入烧杯内,用蒸馏水冲洗搅拌,将悬浮物(不含沙)过滤到GF/C滤膜上。带回实验室酸化处理后保存[8]。浮游生物:取10 L海水,先过JP36#(0.169 mm)筛绢过滤去除浮游动物,然后将过滤液用0.035 mm生物网采集浮游植物,分别收集并过滤到GF/C滤膜上,之后处理方法与底栖微藻同。
稳定同位素分析在中国林业科学研究院稳定同位素质谱分析实验室进行,采用最新一代的同位素比率质谱仪(Finnigan MAT Delta V advantage)和元素分析仪(Flash EA 1112 HT)进行测定。为了保证测试结果的准确性,每测试5个样品后加测1个标准样。碳氮稳定同位素比值精密度为±0.02×10-3;碳氮含量精密度为0.71%和0.31%。测得样品的碳氮百分含量用%表示,碳氮稳定同位素比值以国际通用的δ值表示:
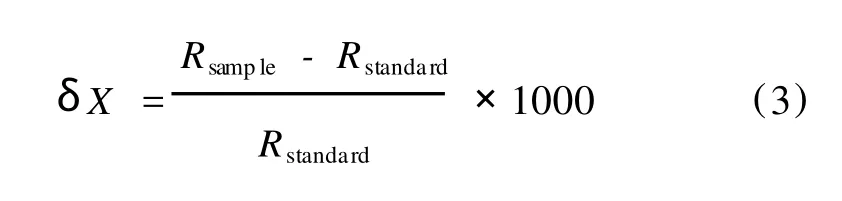
其中,R=13C/12C或15N/14N,δ值越小表示样品重同位素(13C或15N)含量越低。碳氮稳定同位素不同来源的饵料贡献比例采用Phillips[9]以质量守恒模型为基础编写的IsoSource1.3.1软件计算。
1.2.3 数据处理 数据用单因子方差(ANOVA)及Duncan多重比较进行分析处理,所得数据均以平均值±标准差表示。
2 结 果
2.1 胃含物分析结果
镜检结果显示,红树塘和对照塘中,尼罗罗非鱼的主要食物组成基本相同,主要以有机碎屑、泥土、浮游生物、底栖微藻为主,其中有机碎屑和泥土出现的频率均为100%。从食物的重量百分比可看出,红树塘中罗非鱼的主要食物为有机碎屑、蓝藻、凋落物和硅藻,这4种生物的重量百分比和为71.59%,而对照塘中的主要食物为有机碎屑、蓝藻、泥土和长尾类,其重量百分和为61.90%(表1)。红树塘中罗非鱼摄食种类的多样性也高于对照塘。红树塘中的罗非鱼除摄食有机碎屑、浮游生物、凋落物等主要食物外,还摄食少量的腹足类、甲壳类以及仔鱼等(表1)。
2.2 稳定同位素特征
用于同位素分析的尼罗罗非鱼样品体长范围为100~280 mm。红树塘中罗非鱼δ13C值的范围为-23.52‰~-19.02‰,δ15N的范围为10.04‰~13.95‰。对照塘中罗非鱼的δ13C的范围为-22.8‰~-19.50‰,δ15N的范围为10.62‰~13.40‰。与对照塘相比,红树塘中罗非鱼的δ13C值的范围较宽,变化较大,而δ15N比值相对比较接近,这说明红树塘中罗非鱼的食物种类多样,碳的来源较为复杂,而氮来源相对稳定。对于同一体长组,对照塘罗非鱼的碳、氮同位素的富集度往往高于红树塘(表2)。

表1 红树林种植-养殖耦合系统中尼罗罗非鱼的食物组成Table 1 Diet composition ofO reochrom is niloticusin the mangrove and plantation-aquaculture ecological coupling systems
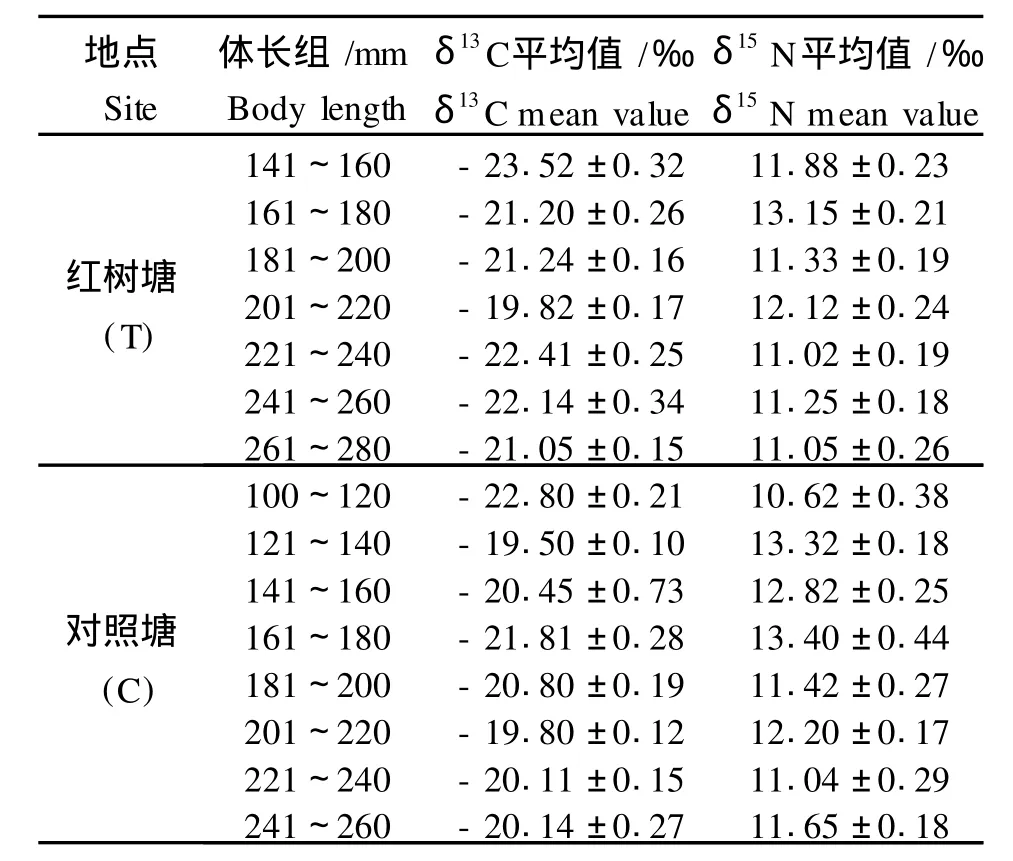
表2 不同池塘中尼罗罗非鱼的δ13C和δ15N的测试结果Table 2 Summary ofδ13C andδ15N signatures of O reochrom is niloticusin different ponds
分析尼罗罗非鱼可能饵料的碳、氮同位素比值见表3。根据捕食者的C、N同位素比值与其生境中所摄取饵料的同位素相一致的原则,判断红树林种植—养殖耦合系统中尼罗罗非鱼可能的食物,包括有机碎屑、底栖微藻、浮游植物、浮游动物、红树植物凋落物、底栖动物和仔鱼等。在不同的系统中,各饵料生物的同位素比值也不尽相同。其中,浮游生物、底栖微藻和有机碎屑的碳同位素比值基本一致(P>0.05);浮游植物的氮同位素比值则差异极显著(P<0.001),这可能与它们的优势种组成有关。调查发现,红树塘中浮游植物主要以小球藻Chlorella vulgaris、条纹小环藻Cyclotella stelligera为主,而对照塘则主要以小颤藻Oscillatoria tenuis占优势。此外,维管束植物的碳氮同位素比值相差较大,这主要是由于它们的植物类型不同。红树塘的维管束植物主要是C3途径的木榄和红海榄,而对照塘的维管束植物为C4途径的野生盐沼植物:喜盐草和二药藻。
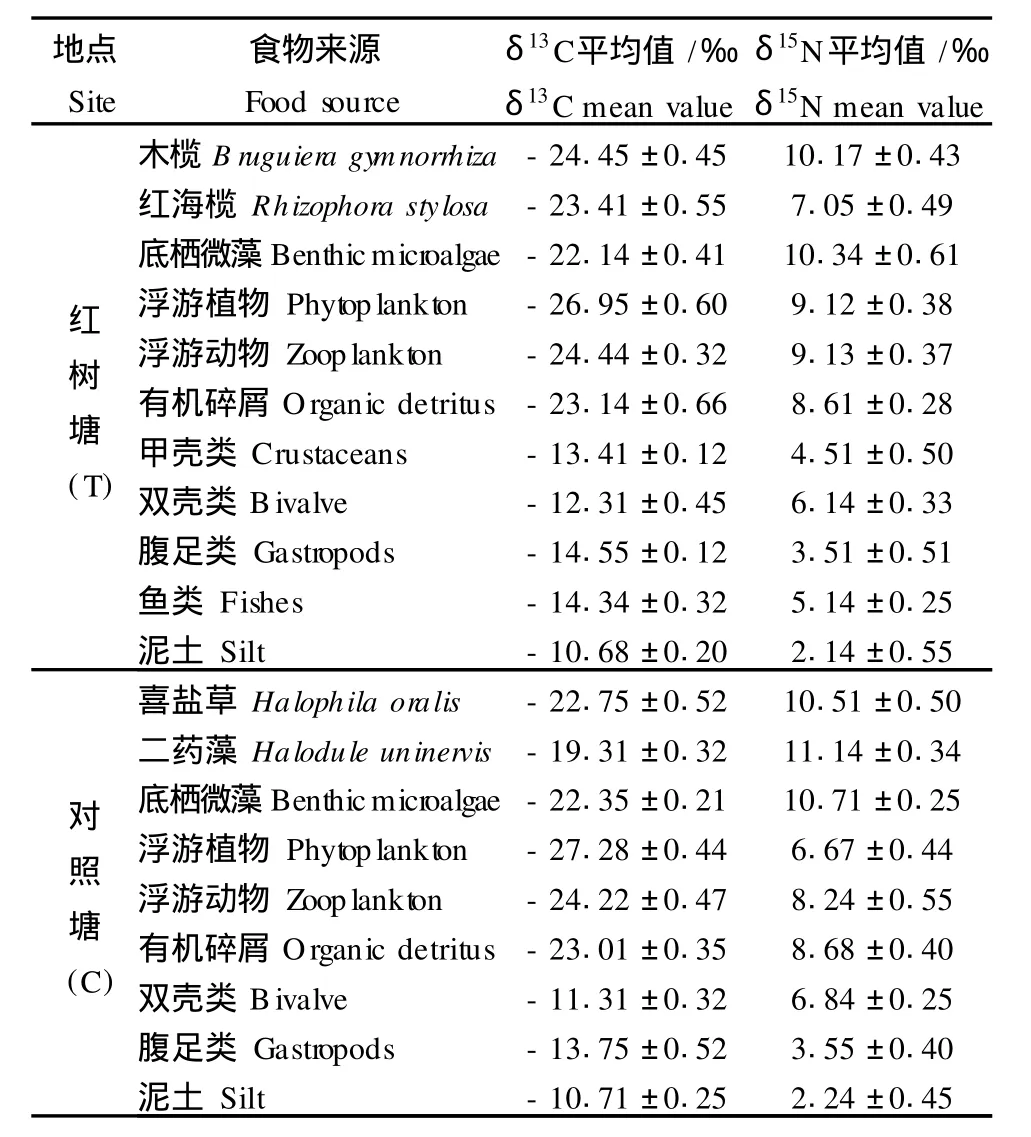
表3 不同池塘中尼罗罗非鱼可能饵料的δ13C和δ15N的测试结果Table 3 Summary ofδ13C andδ15N of potential food sources of Oreochrom is niloticusin different ponds
3 讨 论
尼罗罗非鱼是世界范围内沿岸、河口、滩涂等水域养殖的主要鱼类,也是我国集约化养殖的主要种类[10]。以往的研究表明,尼罗罗非鱼是摄食浮游生物为主的杂食性鱼类[11-14],主要摄食碎屑、藻类、轮虫、枝角类,以浮游动物为主,这与我们进行同位素分析的结果差别较大。根据各种可能饵料和尼罗罗非鱼同位素比值的结果(图1),有机碎屑、浮游植物、植物凋落物和底栖微藻是其主要食物,这与胃含物的观察结果是一致的,只是在不同系统中各饵料生物对尼罗罗非鱼的贡献比例不同。

图1 红树塘(T)和对照塘(C)中尼罗罗非鱼及其潜在食源的δ13C和δ15N值Fig.1 δ13C和δ15N of food sources forO reochrom is niloticusin different ponds
利用IsoSource软件计算各种饵料生物对尼罗罗非鱼的贡献比例,红树塘中罗非鱼的主要饵料为有机碎屑,浮游植物和凋落物,这3种的贡献比例依次5%~55%、10%~40%和15%~26%,其它饵料的贡献比例依次为底栖微藻2%~8%、浮游动物0%~2%。对照塘中罗非鱼的主要饵料为有机碎屑、浮游植物、凋落物、底栖微藻、浮游动物,它们的饵料贡献比例分别为8%~64%、25%~55%、1%~12%、0%~5%和0%~3%。可见,尽管尼罗罗非鱼的食物来源丰富,然而,无论在红树塘还是对照塘中,有机碎屑对尼罗罗非鱼食物组成的贡献比例都超过50%,这说明尼罗罗非鱼是典型的碎屑食性鱼类。
在天然红树林区,初级生产对对消费者的能量贡献关系比较复杂。Rodell等[15]发现红树碎屑很难被消费者所同化,原因是碎屑的不溶解性和高的C/N比。理论模拟也发现[16],潮汐的稀释作用会使得红树林输出的有机质对周围的生态系统的影响不明显。本文研究表明植物凋落物也是尼罗罗非鱼胃含物的主要成分。红树塘的尼罗罗非鱼食物来源中,植食性占了较大比重,其中,为15%~26%主要来源于红树凋落物。在对照塘中,凋落物的比例为1%~12%,主要来自于滩涂上的盐沼植物。对不同栖息地间尼罗罗非鱼的同位素分析结果表明,对照塘中罗非鱼的13C/12C值明显高于红树塘,分析可能与其食物来源及种类有关。红树塘中尼罗罗非鱼的饵料主要为有机碎屑、浮游植物、植物凋落物等,其中,浮游植物以小球藻和条纹小环藻为主,植物凋落物主要来自C3途径的红树植物;而对照塘中,尼罗罗非鱼的主要饵料为有机碎屑、浮游植物、凋落物、底栖微藻和浮游动物。其中,浮游植物以小颤藻占优势,植物凋落物则主要来自C4系列的盐沼植物。可见,尼罗罗非鱼的摄食习性与其栖息环境有着密切的关系。
δ15N值的高低可用来考察生物的食物组成中动物性食源的摄入状况[17]。因为较高的δ15N值,反映了较高的蛋白摄入量。一般食肉动物体内的δ15N比值高于食草动物的,食浮游动物的鱼类高于浮游植物食性的鱼类[18]。从不同栖息地间尼罗罗非鱼的δ15N测定值可看出,对照塘δ15N略高于红树塘,说明对照塘中的鱼类摄食了较多的浮游动物,而红树塘的罗非鱼则摄食了较多的浮游植物和红树凋落物,这与我们胃含物分析的观测结果也是一致的。
在胃含物分析中,泥土曾是尼罗罗非鱼胃含物的主要组成部分,在红树塘和对照塘的罗非鱼中出现的频率均为100%。然而,从稳定同位素分析结果来看,泥土却对罗非鱼的食物毫无贡献,分析认为这可能与其取食习性有关,高比例的泥土可能是罗非鱼在摄食底层碎屑时所带入。鱼类、双壳类和甲壳类的贡献比例也较小,这几种可能是罗非鱼的偶然性食物。
[1] 张福绥.21世纪我国的蓝色农业[J].中国工程科学,2000,2(12):21-27.
[2] 董双林,潘克厚,UWE B.海水养殖对沿岸生态环境影响的研究进展[J].青岛海洋大学学报:自然科学版,2000,30(4):575-582.
[3] CHU H Y,CHEN N C,YEUNGM C,et al.Tide-tank system s imulating mangrove wetland for removal of nutrients and heavy metals from wastewater[J].Water Science and Technology,1998,38(1):361-368.
[4] SHUKIA V P.Modelling the dynamicsofwetland macrophytes:Keoladeo National Park wetland,India[J].EcologicalModelling,1998,109:99-114.
[5] N IEKERSON D J.Trade-offs ofmangrove area development inthe Philippines[J].Ecological Economics,1998,28(2):279-298.
[6] NAGELKERKEN I,FAUNCE C H.Colonisation of artificial mangroves by reef fishes in a marine sea scope[J].Estuarine,Coastal and Shelf Science,2007,75:417-422.
[7] HYSLOP E J.Stomach contents analysis-A review of methods and their application[J].Journal of Fish Biology,1980,17:411-429.
[8] JACOB U,M INTENBECK K,BREY T,et al.Stable isotope food web studies:a case for standardized sample treatment[J].Marine Ecology Progress Series,2005,287:251-253.
[9] PH ILL IPS D L,GREGG J W.Source partitioning using stable isotope:coping with too many sources[J].Ecologia,2003,136(2):261-269.
[10] 李家乐,李思发.中国大陆尼罗罗非鱼引进及其研究进展[J].水产学报,2001,25(1):90-95.
[11] 王天宇.尼罗罗非鱼的食性观察[J].淡水渔业,1981,2:47-48.
[12] 胡玫,张中英.尼罗罗非鱼仔鱼、稚鱼和幼鱼消化系统的发育及其食性的研究[J].水产学报,1983,7(3):207-217.
[13] GETACHE W T,FERNANDO C H.The food habits of an herbivorous fish(Oreochrom is niloticus Linn.)in Lake Awasa,Ethiopia[J].Hydrobiologia,1989,174:195-200.
[14] TADESSE Z.The nutritional status and digestibility of Oreochrom is niloticusL.diet in Lake Langeno,Ethiopa[J].Hydrologia,1999,416:97-106.
[15] RODELL IM R,GEAR ING J N,GEAR ING P J,et al.Stable isotope ratio as a tracer of mangrove carbon in Malaysian ecosystem s[J].Oecologia,1984,61(3):326-333.
[16] ODUM W E.Dual gradient concept of detritus transport and processing in estuaries[J].Bulletin of Marine Science,1984,35(3):510-521.
[17] HILL A M,SINARSD M,LODGED M.Invasion of an occupied niche by the crayfish Orconectes rusticus:potential importance of growth and mortality[J].Oecologia,1993,94:303-306.
[18] WHITLEDGE GW,RABENIC F.Energy sources and ecological role of crayfishes in an Ozark stream:insights from stable isotope and gut analysis[J].Canadian Journal of Fisheries and Aquatic Sciences,1997,54:2555-2563.
