农药对土壤微生物群落的副作用的研究方法
2010-01-19李少南
李少南
浙江大学农药与环境毒理研究所,杭州310029
1 引言
微生物群落对于土壤肥力的保持起着十分重要的作用.这种肥力多是通过对植物材料的分解和从空气中固氮并与植物共生等微生物活动来实现的.近来人们还认识到微生物群落在土壤适应性进化中的贡献.这种贡献体现在对土壤微生物基因库的维持,使土壤中能够很快产生新的基因组,以应对土壤使用方式的多样性变化(Soulas and Lors,1999).考虑到农药中的许多品种直接在土壤中使用,即使用于叶面处理的药剂,使用后亦有70%~80%落在了土壤表面,人们关注它们对土壤微生物群落的影响就不难理解了.农药管理部门规定,用于农艺、园艺、林业等的植物保护剂(即农药),生产商必须提供有关产品对土壤微生物群落影响的资料.这些资料必须足以阐明其产品在推荐剂量和方法下使用后对土壤微生物群落是否有不利影响;如果有,影响所持续的时间究竟有多长.
2 资料要求
化学品对土壤微生物群落的影响是多方面的,人们可以从不同角度进行研究.Locke和Zablotowicz(2004)将研究终点归纳为3类,即生物量(Biomass)、土壤酶活性(Soil enzyme activity)和氮素可矿化性(Mineralizable N).美国California州环保署在最近起草的一份文献中将研究终点归纳为4类,即生物量(Biomass)、种群(Population)、活性(Activity)和多样性(Diversity).每一类当中又包含若干种不同的终点(OEHHA,2008).对于这些终点的研究,有助于人们从不同侧面了解农药对土壤微生物负面影响.从实践角度,只有那些与风险管理目标相对吻合的研究终点,才可能被纳入风险评估的“资料要求”.
评估农药对土壤微生物的风险,其“资料要求”主要涉及微生物群落的“碳转化(Carbon turnover)”和“氮转化(Nitrogen turnover)”功能在暴露期间所受的影响(FAO,1981;1989;EPPO,2003).所谓“碳转化”是指土壤微生物转化有机碳成为二氧化碳的能力.而所谓“氮转化”是指土壤微生物通过氨化和硝化反应转化含氮有机物成为硝酸根的过程.“氮转化”与“碳转化”是关系密切的生命过程.对“氮转化”的检测,往往可以折射出待测物对土壤“碳转化”能力的影响.因为氨化和硝化过程是紧随有机物“碳—氮”键的断裂而发生的.如果硝酸根的形成速率在处理和对照土之间没有差异,则可以有把握地推断,土壤的“碳转化”功能没有受到显著影响(OECD,2000a).
研究农药对土壤微生物的影响,既可以在室内,也可以在温室或田间进行.所谓室内试验,就是农药的添加、土壤微生物的暴露、功能检测等环节均在室内条件下进行.温室或田间试验与室内试验的主要区别在于前两者是将供试药剂施用于田间,并在施药后的不同时间选点取样,然后在室内完成功能检测.农药风险评估试验一般从室内开始.对许多农药来说,室内试验已经能够满足风险评估的需要.当室内试验证明农药对土壤微生物群落存在风险,或者风险性难以通过室内试验加以判断时,需要进一步开展温室或田间试验.
目前国内外尚未制订出与风险评估模型相配套的土壤微生物田间试验方法.农药管理机构正在讨论和酝酿制订相关的试验准则(EPPO,2003).本文以室内试验为例,对土壤微生物试验的方法学要素加以剖析.
3 试验要素
3.1 土样
土壤中包含多种微生物.它们在土壤中的关系复杂,具有一定的抗外界干扰能力.外来化学品对土壤微生物群落某一部分造成损害,因此而丧失的功能,有可能被群落的另一部分所补偿.现今人们普遍认同,研究农药对土壤微生物的影响,其着眼点应该放在群落的整体功能上.以土壤中分离的菌株作为研究对象时,虽然也能提供不少有关农药和土壤微生物相互作用的信息,但此类信息并不能反映群落整体在土壤中的实际情况.因此人们在研究农药对土壤微生物影响时,大多以具有微生物活性的土壤,而不是纯培养的微生物菌株作为研究单位.
3.1.1 物理性能
土壤的一些物化特征,如粘粒含量、阳离子代换量、pH值、有机质含量等,会不同程度地影响农药在土壤中的吸附与挥发,进而影响农药对土壤微生物的生物有效性(Bioavailability).因此在大多数情况下,土壤微生物试验需要以一种以上的不同性质的土样(如砂土和壤土)作为试验材料.
美国EPA(1996)要求供试土样达到以下标准:pH 4~8、有机质含量1%~8%、阳离子代换量大于70meq·kg-1、砂粒(作者注——粒径介于2~0.02mm之间)含量不超过70%.
OECD(2000a;2000b)给出了其对供试土样的要求:砂粒含量介于50%~75%之间;pH值介于5.5~7.5之间;有机碳含量介于0.5%~1.5%之间;土样的微生物碳含量不低于该土样有机碳总含量的1%.
上述指标范围被OECD称作是对土样的“最差状况(Worst cast situation)”.所谓“最差状况”,意味着此类土样为农药提供了相对高的生物有效性.如果以该土样作为测试单元,测得的农药影响不明显,就无需用其他土样再进行测试(OECD, 2000a;2000b).
3.1.2 土样采集
OECD认为取土深度应该控制在土表以下0~ 20cm.如果在温室或非耕地取土,深度可延伸到土表以下25cm.土样最好取自谷类作物(玉米除外)或密植的绿肥田.选中的田块应该停用农药至少1年,并且应该至少6个月未使用化肥或至少3个月未使用有机肥(OECD,2000a;2000b).
3.1.3 筛分和贮存
手工剔除土样中的蚯蚓、节肢动物、石子、植物根系等大块杂质(如果有的话).然后将土样晾置到可以过筛为止(对一般农田土样而言,此时的含水量大约为12%).使土样过2mm筛.调节土样含水量至其饱和持水量的40%~60%.按上述步骤处理过的土样,可在温度(4±2)℃、通风、避光的条件下贮存.但OECD认为即使在上述条件下,土样的贮存期最长也不宜超过3个月,过长时间的贮存会使土壤微生物活性明显下降,或使微生物区系的原始状况发生改变(OECD,2000a;2000b).
3.1.4 恢复培养
经过较长时期贮存的土样一般不能直接用于试验,而是应该经过适当的恢复性培养,以恢复贮存过程中丧失的土壤微生物活性.恢复培养是否达到预期的效果,应该经过适当程序加以验证. OECD对恢复培养合格土样的生物量指标提出了以下要求,即土样中微生物碳含量不低于该土壤有机碳总含量的1%(OECD,2000a;2000b).
3.2 底物
底物的作用首先在于提高土样中微生物的生物量,使之达到试验准则所要求的水平.根据实际需要,底物既可在加药前的恢复培养期,也可在加药后的培育过程中添加.至于底物的种类,OECD主张使用鲜苜蓿粉,由紫花苜蓿Medicago sativa制成,其C/N介于12/1~16/1之间,一般按照每kg干土5g的比率添加(OECD,2000a).美国EPA推荐的底物是经过0.6mm筛分选的苜蓿干粉.该底物添加率多为6%(w/w)(EPA,1996).
除了用于提高微生物的生物量,底物还具有启动和刺激微生物功能发挥的作用.如OECD的“碳转化”试验要求在每次测试中向每kg干重的土样中添加高剂量(2000~4000mg)葡萄糖以刺激微生物的碳转化活性(OECD,2000b).
3.3 培育系统
3.3.1 培育容器
按照美国EPA(1996)的测试准则,培育容器应该能够容纳50g土样,并且具有足够的换气空间(100mL左右的玻璃广口瓶能满足这方面要求).如果土样的用量增加,容器的体积应该相应扩大.为了减少容器内的水分散失,瓶口可用聚乙烯薄膜等覆盖,但是这种覆盖不应该过分阻隔空气流通;也可以将瓶口完全敞开,每隔一定时间(如7d)补充一次水份,以恢复土壤含水量到起始水平.
3.3.2 加药方式
水溶性原药和可以在水中分散的农药制剂,如乳油、可湿性粉剂、水乳剂、悬浮剂等,可以直接用水稀释,然后使稀释液与土样混匀.
如果药剂难溶于水,又难以直接与土样混合,可先用少量有挥发性机溶剂(如丙酮、氯仿)将其溶解,再将药液涂布在少量细土或石英细砂(粒径0.1~0.5mm)表面,待溶剂挥发后,将吸附有药剂的细土或石英细砂进一步分散到土样中去.注意不可将溶解于有机溶剂的药液直接与土样混合.因为这样做有可能会破坏土样中微生物区系的完整性.
有些内含石砾核心的颗粒剂,由于体积较大而难以与土样均匀混合.遇到这种情形,可先用水或有机溶剂将外包物洗脱,再做下一步处理.
3.3.3 剂量设置
如果农药在环境中的起始浓度可以推测,应优先以起始环境浓度为依据进行测试;反之,当环境浓度无法推测时,人们可以主观地选择一系列浓度进行测试,直至获得 EC50数值(EPA,1996; OECD,2000a;2000b).
起始环境浓度的推测,一般以施药剂量为依据.如此推测时,OECD认为可以设定施用的药剂100%进入土壤,并且均匀分布于地表0~5cm的土层,土壤密度为1.5g·cm-3(OECD,2000a;2000b).
OECD认为农药的测试剂量至少应该包括“推测环境浓度(Predicted Environmental Concentration, PEC)”以及PEC的5倍浓度.对于那些多次使用的药剂,可以考虑以PEC乘以使用次数的模式确定最高测试浓度.然而最高测试剂量不必超过单次用药PEC的10倍(OECD,2000a;2000b);
美国EPA的测试准则规定,农药试验可选择PEC的0.1倍、1.0倍和10倍作为测试剂量.若采用主观设定的系列浓度法进行测定,最高测试浓度一般不超过1000mg·kg-1(干土).EPA认为在1000mg·kg-1(干土)的测试浓度下,如果供试药剂对土壤微生物活性的抑制率低于50%,试验即可终止(EPA,1996);
蔡道基等(1986)根据我国当时的农药平均使用量,提出采用1、10、100mg·kg-13个浓度进行测试.考虑到不同农药田间用量的差别,国家环保局在稍后制定的《化学农药环境安全评价试验准则》中对此项内容做了修改,主张以农药常用量(即推荐的最大用量)、常用量的10倍量、常用量的100倍量时表层土壤中农药的推测含量作为测试剂量(蔡道基,1989).
微生物试验的每一浓度组(包括对照)应该设置重复.美国EPA要求每一浓度组设5个重复(EPA,1996).OECD认为每一浓度组至少需设3个重复(OECD,2000a;2000b).
3.3.4 培育条件
温度方面,OECD准则规定药剂处理过的土样应该在20℃下培育,培育期间的温度变幅不应超过±2℃(OECD,2000a;2000b).美国EPA推荐的培育温度为22℃(EPA,1996).也可以将试验当地土壤微生物最为适应的生长温度作为活性土壤的培育温度(EPA,1996;OECD,2000a;2000b).我国的化学农药环境安全评价试验准则将25℃作为活性土壤的培育温度(蔡道基,1989).
湿度方面,以旱地微生物区系作为研究对象时,土壤的培育湿度一般控制在饱和持水量的40%~60%(OECD,2000a;2000b)或者10kPa(EPA, 1996).如果试验对象涉及藻类,培育湿度可以提高到土壤的饱和持水量.“氮转化”试验中可采用的土样培育方法有两种:即“散装培育”或“分装培育”.一个处理的“散装培育”土样包含多个分样,在整个培育过程中,各分样可以被分批采集;而一个处理的“分装培育”土样中只包含一个分样,该分样只能在培育终结时采集.在加药操作上,“散装培育”具有省工的优点,也有助于减少试验误差.但是如果供试药剂挥发性较强,“分装”则被认为是唯一可供选择的培育方式(OECD,2000a; 2000b).
培育过程中一般要避免光照.这样做一方面为了避免农药见光分解,另一方面可以抑制土壤中藻类的生长.
3.3.5 取样规划
对于农药类化学品,OECD规定土壤微生物试验的持续时段至少应达到28d.土样(包括分样)的采集应该在药剂处理后的第0d、第7d、第14d和第28d进行.在对第28d的样品进行检测后,如果发现处理组和对照组土壤微生物活性的差异超过25%,OECD认为应适当延长试验周期,直至处理组和对照组土壤微生物活性的差异低于25%,但延长的最大时限不应超过 100d(OECD,2000a; 2000b).
对于非农药类化学品,OECD将试验持续的时段设定为28d,在第7d和第28d取土样或采集分样,利用第28d的数据计算ECx值(OECD,2000a; 2000b).
将美国EPA试验持续的时段设定为28d,土样或分样的采集在第5d和第28d进行,利用第28d的数据计算ECx值(EPA,1996).
我国的《化学农药环境安全评价试验准则》规定15d作为农药对土壤微生物影响的一个试验周期,取样在药剂处理后的第0d、第5d、第10d和第15d进行(蔡道基,1989).
3.3.6 系统质量要求
土壤微生物试验结果多是以处理组相对于对照组功能的下降率(±25%)作为评判依据,若试验组内各重复之间的测定值差异过大,将会影响对试验结果的评判.OECD规定对照组内各重复间的测定值差异不应超过±15%(OECD,2000a; 2000b).
3.4 检测方法
3.4.1 “氮转化”
微生物的“氮转化”活性,通常以有机氮转化为NH4+的速率和/或NH4+转化为NO3-的速率来表示.而农药对“氮转化”活性的影响则通过处理组相对于对照组NH4+和/或NO3-生成的下降率来表示.为此需要将土样中的NH4+和NO3-加以提取. OECD和美国EPA分别给出了NH4+和NO3-的提取方法:
按照OECD试验准则,将5mL 0.1mol·L-1的KCl加入相当于1g干重的土样,初步摇动后,将混合液置于150rpm的摇床上振荡60min,离心,取上清液,测定其中NH4+和NO3-浓度.来不及测定的上清液可在室温(20±5)℃下保存,OECD认为贮存期不宜超过6个月(OECD,2000a).
按照美国EPA的试验准则,将80mL 0.1mol· L-1的KCI加入内含相当于50g干重土样的试验容器中.初步摇动后,将容器至于摇床上继续振荡1h,提取液经低氮滤纸(如Whatman 42号定量滤纸) 过滤后,用于 NO3-或 NH4+检测(EPA, 1996).
NO3-和NH4+检测方法很多.具体可参见严昶生(1988).
3.4.2 “碳转化”
微生物的“碳转化”活性通常以土壤在单位时间内对氧气的吸收率或对二氧化碳释放率来表示.而农药土壤微生物“碳转化”活性的影响,可通过处理组相对于对照组氧气的吸收或对二氧化碳释放的下降率来衡量.
对于二氧化碳释放,美国EPA推荐在气体流通状态下测量.其原理是将内含土样并经过一段时间密闭的培育容器,经由进、出气体的两个通道,分别与气泵和红外气体检测器(Infrared gas analysis,IRGA)相连.通道上分别安装有可控开关.气泵提供的不含二氧化碳的湿润气流通过进气通道进入培育容器,气流携带土壤呼吸作用释放出的二氧化碳,经出气通道和干燥器而到达IRGA.在气体的流速确定的前提下,土样在容器内的密闭培养时间需要通过预试验加以调节,使出气通道内二氧化碳的分压与IRGA的检测灵敏度相匹敌,同时又不会因为密闭培养而使容器内氧气过多下降,以致影响土壤微生物的正常生长. EPA认为密闭培养的时间以 1~77h为宜(EPA, 1996).
为了刺激土样的瞬时呼吸率,OECD推荐在每一测试之前按2000~4000mg·kg-1(干土)的量向土样中添加葡萄糖,经过12h左右密闭培养之后加以测定(OECD,2000b).
除了使用IRGA,土壤呼出的二氧化碳还可以用氢氧化钠吸收,再通过滴定或气相色谱法检测.我国国家环保局推荐了一种简易的土壤二氧化碳吸收装置,目前被我国的农药登记试验单位普遍采用(蔡道基,1989).该装置以密闭的广口瓶作为培养容器.植入土样的同时,每只广口瓶中放入一只盛有5mL NaOH标准溶液的小烧杯,再将整个广口瓶移至(25±1)℃的恒温箱中培养.至于取样计划,起初是在试验开始后的第0d、第5d、第10d和第15d进行(蔡道基,1989),后来变更为试验后的第1d、第2d、第4d、第7d、第11d和第15d.此处所谓“取样”,是指从密闭广口瓶中取出培养开始时(第0d)放置的小烧杯,同时将一个新的小烧杯放在原来位置以继续CO2的吸收.“取样”的同时也更换了广口瓶中的空气,不至于使瓶中氧气分压下降到明显影响土壤呼吸作用的程度.
碱液中吸收的CO2可以参考中科院南京土壤研究所微生物室(1985)的方法进行测量.
目前我国室内测量农药对土壤“碳转化”的影响,其测量终点与OECD和美国EPA的稍有不同:前者测的是土壤微生物在整个温育时段(如0~1d、0~2d、0~4d、0~7d、0~11d、0~15d)的“碳转化”效率,而后者测的是土壤微生物在温育的某一时间点(如第0d、第7d、第14d、第28d)的“碳转化”效率.除了作用强度,农药在土壤中发挥作用的时间也是衡量其对微生物影响的一个重要因素.我国以整个暴露时段内土壤二氧化碳的释放量作为测量终点,从这一点上看,具有其合理的一面.但是在温室和田间试验中,人们很难进行类似的测定,而比较容易测量土壤微生物在试验阶段的某一时间点的碳转化效率,因此OECD和美国EPA的测量方法可用于不同层次间的试验,也易于试验结果的相互比较.
3.5 评价
Johnen和Drew早在1977就年提出了一套以功能的恢复时间作为关注水平(Level of concerns, LOCs)的风险评估体系.此体系中,对于室内试验和野外试验而言,恢复时间<15d和<30d,为无风险;恢复时间15~30d和30~60d,为略有风险但可以忍受;>30d和>60d,为有风险.比如某一农药对土壤微生物的影响需要20d恢复,对于野外试验而言,该农药属于“无风险”等级,对于室内试验,该农药则属于“略有风险但可以忍受”.Johnen和Drew评估体系,其室内试验的评价标准严于室外.之所以如此设置,目的在于防止室内试验出现“假阴性”结果:如果室内试验证明农药对土壤微生物“无风险”,风险也不可能在野外发生;反之,如果室内试验显示农药对土壤微生物“有风险”,可以进一步开展温室或田间试验,以确认类似的风险是否会在野外发生.Johnen和Drew的这一评估体系得到了联合国粮农组织(FAO)的认可(FAO, 1981).凡以环境浓度为依据的试验,其结果均可应用该体系进行评估.
在微生物风险的评估中,联邦农林生物研究中心(Biologische Bundesanstalt für Land-und Forstwirtschaft,BBA)将对照组和处理组微生物活性的差异作为关注目标.它为室内和野外试验设定的LOCs分别是15%和25%.按照这套评估体系,在历时不超过90d的室内暴露之后,对照组和处理组之间土壤微生物活性的差异如果低于15%,供试药剂对微生物的影响被认为“可以接受”;反之,如果差异超过15%,则需要进一步开展温室或田间试验.BBA规定的温室或田间试验历时不超过120d.通过试验,对照组和处理组之间土壤微生物活性的差异如果低于25%,供试药剂的影响被认为“可以接受”,如果差异超过25%,供试药剂则被认为对土壤微生物有不良影响.为了消除或减轻这种不良影响,农药管理部门或许会对该药剂的使用范围施加某种限制(Ehle,1993).
欧洲和地中海植保组织 (European and Mediterranean Plant Protection Organization,EPPO)将农药的土壤微生物风险等级进行了如下划分并给出了相应的处理意见(EPPO,2003):1)通过28d的室内暴露,如果处理组相对于对照组土壤微生物活性的差异未超过25%,该药剂被认为“低风险”;2)通过28d的室内暴露,如果处理组相对于对照组土壤微生物活性的差异达到或超过25%,应该延长暴露时间进一步测试,但最终的暴露时间不应超过100d;3)延长暴露时间后,如果处理组相对于对照组土壤微生物活性的差异未超过25%,该药剂被认为具有“中等风险”;反之,如果处理组相对于对照组土壤微生物活性的差异达到或超过25%,该药剂被认为具有“高风险”;4)对于室内判断为“高风险”的药剂,一般需开展温室或田间试验,以明确供试药剂在实际应用中的风险程度、范围和持续时间.
蔡道基等(1986)针对15d室内试验提出了毒性等级划分的下列标准:1)在1mg·kg-1(干土)的试验浓度下,如果处理组相对于对照组的土壤微生物活性下降率达到或超过50%,供试药剂对土壤微生物“高毒”;2)在10mg·kg-1(干土)的试验浓度下,如果处理组相对于对照组的土壤微生物活性下降率未达到50%,供试药剂对土壤微生物“低毒”;3)在10mg·kg-1(干土)的试验浓度下,处理组相对于对照组的土壤微生物活性下降率达到或超过50%,而在1mg·kg-1(干土)的试验浓度下,如果处理组相对于对照组的土壤微生物活性下降率未达到50%,供试药剂对土壤微生物具有“中等毒性”.
上述划分主要基于以下假设:1)大多数农药的最高田间用量不超过750g·hm-1;2)均匀施用的农药大多分布在距地表0~5cm、容重为1.5g·cm-3的土层中;3)基于上述两个假设大多数农药在土壤中的最高起始浓度不超过1mg·kg-1干土;4)在最高起始浓度下,如果处理组相对于对照组的土壤微生物活性下降幅度达到或超过50%,说明该农药对土壤微生物“高毒”;5)在“条施”或“点施”等特殊施药条件下,农药在农田中的分布面积仅有均匀施药时的1/10,或者说农药在局部农田中的最高起始浓度可能达到均匀施药时的10倍,即10mg·kg-1(干土).在此前提下,如果处理组相对于对照组的土壤微生物活性下降幅度未能达到50%,说明该农药对对土壤微生物“低毒”.
衡量农药对土壤微生物的影响,除抑制程度之外,抑制作用所持续的时间具有同样重要的意义.蔡道基等(1986)综合抑制程度、抑制所持续的时间,以及造成该抑制所需的暴露浓度三方面因素,提出使用“危害系数”评估农药对土壤微生物影响的设想.“危害系数”,可由下列公式来计算:
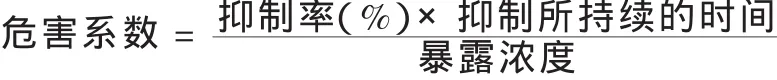
农药的“危害系数”可以被划分成下列3个等级:1)“危害系数”≥200,具有“严重危害”;2)200>“危害系数”≥20.0,具有“中等危害”;3)“危害系数”<20.0,“无实际危害”.
上述划分的主要依据是:1)在1mg·kg-1(干土)的浓度下,经过120d(即4个月,相当于1个生长季)的暴露期,如果处理组相对于对照组的土壤微生物活性下降幅度仍然能够达到或超过50%,说明该农药对对土壤微生物具有“严重危害”;2)在10mg·kg-1(干土)的浓度下,经过120d的暴露期,如果处理组相对于对照组的土壤微生物活性下降幅度未能达到50%,说明该农药对对土壤微生物“无实际危害”;3)在10mg·kg-1(干土)的浓度下,经过120d的暴露期,处理组相对于对照组的土壤微生物活性下降幅度达到或超过50%,但是在1mg·kg-1(干土)的浓度下,经过同样的暴露期,处理组相对于对照组的土壤微生物活性下降幅度未能达到50%,说明该农药对对土壤微生物具有“中等危害”.
“危害系数”可用于田间试验的结果评估.需要指出的是,为计算“危害系数”所开展的田间试验,其持续时间应该是120d,而不是室内试验所采用的15d.
研究和确定农药对土壤微生物的影响,是农药生态风险评估和风险管理的客观需要.而关注这方面问题,是农药环境毒理学向生态毒理学发展的一个重要标志.针对土壤微生物的化学品评估试验,无论在室内、温室,还是在田间进行,均属于系统层次的研究.室内就相当于一个土壤微宇宙试验.此类试验之所以选择功能性指标作为测试终点,是因为这类指标是土壤生态系统物质和能量循环水平以及系统抗胁迫能力的集中体现.对土壤微生物而言,以室内试验结果推测其在野外可能受到的影响,比起其他类型的非靶标生物做类似推测时的结果可靠性要强得多.室内试验关键的一点,是要保持土样中微生物群落结构和功能的完整性,在试验过程中不会受到药剂以外的因素的破坏.
Cai D J,Jiang X L,Cai Y Q.1986.Safety assessment of chemical pesticides for eco-environment-I.Effects and assessment of chemical pesticides on soil microbes[J].Rural Eco-Environment,(2):9-13(in Chinese)
Ehle H.1993.Side-effects on soil microflora[A].//BBA(Biologische BundesanstaltfürLand-und Forstwirtschaft,Berlin-Dahlem). Criteria for assessment of plant protection products in the registration procedure[C],Berlin undHamburg:KommissionsveriagPaul Parey,84-86
EPA(United StatesEnvironmentalProtection Agency).1996. Ecological effects test guidelines OPPTS 850.5100 Soil microbial community toxicity test[S].Washington,D.C.: EPA Public Access Gopher 712-C-96-161
EPPO(European and Mediterranean Plant Protection Organization). 2002.Normes OEPP/EPPO Standards PP 3/7(2)Environmental risk assessment scheme for plant protection products,Chapter 8: Soil organisms and functions[S].Paris:EPPO
FAO(Food and Agricultural Organization of the United Nations). 1981.Second expert consultation on environmental criteria for registration of pesticides[R]. FAO Plant Production and Protection Paper 28.Rome:FAO Sales Agents,1-60
FAO(Food and Agriculture Organization of the United Nations). 1989.Revised guidelines on environmental criteria for the registration of pesticides[Z].Rome:FAO Sales Agents,1-47
Johnen B G.1977.Ecologicaleffects ofpesticides on soil microflora[J].Soil Science,123(5):319-324
Institute of Soil Science,Chinese Academy of Sciences.1985. Method of Soil Microorganisms-Determination of Soil Respiration[M].Beijing:Science Press,216-222(in Chinese)
Locke M A,Zablotowicz R M.2004.Pesticides in soils-benefits and limitations soil health [A].//Schjonning P,Elmholt S, Christensen B T.Managing Soil Quality:Challenges in Modern Agriculture[C].Oxfordshire,UK:CAB International,239-259
Ministry of Environmental Protection of People’s Republic of China.1989.Guidelineson the Safety AssessmentChemical Pesticides[Z].Beijing:Ministry of Environmental Protection of People’s Republic of China(in Chinese)
OECD/OCDE (Organization for Economic Cooperation and Development). 2000a. OECD guideline for the testing of chemicals 216 Soil microorganisms:nitrogen transformation test[S].Paris:OECD
OECD/OCDE (Organization for Economic Cooperation and Development). 2000b. OECD guideline for the testing of chemicals217 Soilmicroorganisms:carbon transformation test[S].Paris:OECD
OEHHA(Office of Environmental Health Hazard Assessment). 2008.Soil toxicity and bioassessment test methods for ecological risk assessment[Z].Sacramento,CA,USA:California Environmental Protection Agency,16-39
Soulas G,Lors C.1999.Perspectives and limitations in ssessing side-effects of pesticides on the soil microflora[A].//Bell C R, Brylinsky M, Johnson-Green P. Proceedings of the 8th International Symposium on Microbial Ecology,Halifax,Canada: Atlantic Canada Society for Microbial Ecology,1-6
Yan C S.1988.Soil Fertility Research Methods-Determination of Ammonification and Nitrification in Soil[M].Beijing:Agricultural Press,218-224(in Chinese)
中文参考文献
蔡道基,江希流,蔡玉琪.1986.化学农药对生态环境安全评价研究—I.化学农药对土壤微生物的影响与评价[J].农村生态环境,(2):9-13
严昶生.1988.土壤肥力研究方法 土壤氨化和硝化作用测定[M].北京:农业出版社,218-224
中科院南京土壤研究所微生物室.1985.土壤呼吸量测定 土壤微生物研究法[M].北京:科学出版社,216-222
国家环境保护局.1989.化学农药安全评价试验准则[Z].北京:国家环境保护局
