二氟尼柳衍生物的研究进展
2010-01-14胡红丹茅松青钟光祥
胡红丹 茅松青 钟光祥
(浙江工业大学药学院,浙江 杭州 310032)
0 前言
二氟尼柳(1,氟苯水杨酸,Diflunisal,CAS:22494-42-4),化学名:5-(2,4-二氟苯)水杨酸[5-(2,4-difluorophenyl)salicylic acid],是一种新型的非甾体抗炎镇痛药,临床上用于治疗风湿性关节炎、类风湿关节炎、骨关节炎、扭伤、劳损和镇痛[1-3]。目前,在我国仅有巨化集团制药厂生产二氟尼柳原料药。
二氟尼柳是由美国Merck Sharp&Dohme公司以氟尼柳(flunisal)为先导化合物,从500多个水杨酸衍生物中筛选出来的,于1975年上市。目前是默克公司年销售额超1亿美元的品种之一,并且已在英、美、日、意、法等70多个国家上市,历版美国药典和英国药典均有收载,我国2005年把此药收入中国药典,已有二氟尼柳片剂和二氟尼柳胶囊批准生产。二氟尼柳的抗炎和镇痛作用为阿司匹林的7.5~13倍,解热作用为阿司匹林的1.4倍,作用时间可持续8~12h,每日只需给药2次即可[4-7]。二氟尼柳的发现及合成方法可见于参考文献[4-9]。
但由于二氟尼柳具有胃肠道、中枢神经系统等副作用,存在损害肾功能、引起消化道溃疡、药物蓄积等危害,极大限制了二氟尼柳广泛使用;且其水溶性差,限制了给药方式和途径。为了降低二氟尼柳的毒副作用、拓展其应用领域,许多科研工作者从不同角度对其进行了结构修饰,取得了较好的结果[1-3,10]。
本文对二氟尼柳进行结构修饰而合成的许多衍生物,以及所显示的生物活性进行了总结,对今后二氟尼柳的结构修饰与活性研究将会产生较大的促进作用。
1 结构修饰及活性研究
1.1 形成咪唑盐,降低胃肠道毒性
二氟尼柳,同其他的非甾体类抗炎药相似,具有一定的胃肠道毒性,限制了其更广泛的临床应用。为了降低胃肠道毒性,Raccardo Stradi将二氟尼柳与等摩尔的咪唑进行成盐,得到化合物2。

药理测试显示,该化合物具有更强的抗炎、镇痛及退热效果;并且没有胃肠道毒性副作用。这可能是由于咪唑能提高大多数抗炎物质,特别是水杨酸类化合物的抗炎活性,及抑制一些炎症前兆,比如,通过阻断组氨酸脱羧酶来抑制组胺等[11]。
1.2 通过膦酸化,提高水溶性
由于二氟尼柳的水溶性很差,极大地限制了给药途径及剂型开发。Dr.Mario Brugioni与Dr.Mauro Fedi经过研究,将二氟尼柳先与五氯化磷反应,然后水解制成磷酸酯(化合物3及其盐类),以增加其水溶性。
反应过程如下:
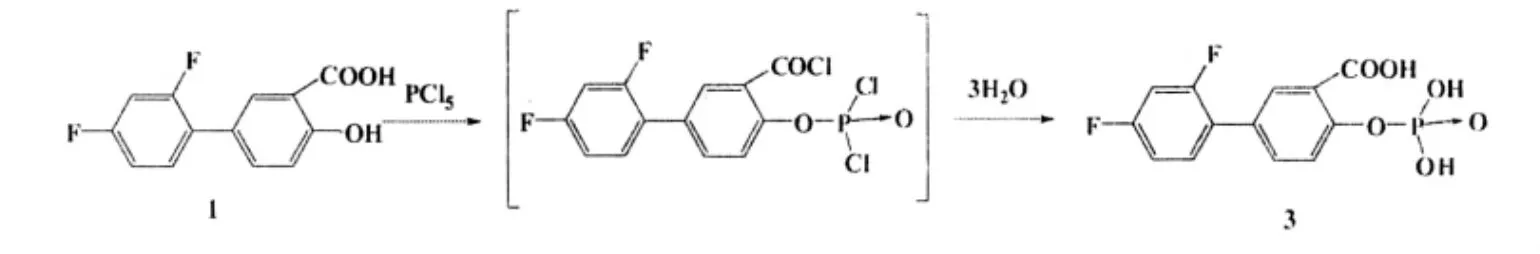
化合物3具有很好的水溶性,使其能方便地制成片剂、胶囊、滴剂、药膏等多种剂型,进行口服、注射、直肠及外用等多途径给药[12]。
1.3 制成二氟尼柳前药,增加生理活性
Yu Chongxi等则将二氟尼柳,水杨酰水杨酸,水杨酸与合适的醇、硫醇、胺反应制成荷正电前药。此类含荷正电的胺基基团前药,不但增强了化合物溶解性,降低副作用,而且能与黏膜上带负电的磷酸头基团结合,把前药推入胞液中。在血浆中,90%以上的前药可以在几分钟内转化为母药。前药可以口服或经皮给药来治疗二氟尼柳,水杨酰水杨酸,水杨酸治疗的症状,而且可以避免消化不良,胃炎,胃溃疡等副作用[13]。前药结构通式为4和5:

1.4 通过O-酰基化,具有抗血小板聚集活性
Daniel Y.Hung将二氟尼柳与适当的酸酐或酰氯进行酯化反应,合成了一系列O-酰基化的二氟尼柳衍生物,并详细研究了化合物6的合成,并对其在体外的水解、溶解性、稳定性及与蛋白质的结合等等方面进行了研究[14]。其合成通式如下:

且进一步的研究发现:随着二氟尼柳衍生物中O-酰基部分的碳原子数的增加,能显著增强肝的提取率,同时减少溃疡的发生。更惊奇的是,这些及其他一些二氟尼柳的酯类化合物具有抗血小板聚集活性及羟基自由基消除特性,这使它们能作为活性物质来治疗和(或)控制血栓及肝等组织的缺血再灌注损伤[15]。此类化合物7通式如下:

1.5 引入噻唑烷酮及氨基硫脲基团,具有抗病毒活性
由于4-噻唑烷酮衍生物具有抗菌、抗真菌、抗病毒、抗结核等性质,而二氟尼柳具有抗炎、镇痛等作用。Güniz Kücükgüzel等通过以下设计的路线,合成目标化合物,期望其能在体内通过水解产生的活性代谢物,而同时具有以上两种药理活性。
但对目标化合物进行抗菌活性研究发现,化合物9对Staphylococcus epidermis HE-5和Staphylococcus aureus HE-9具有抑制作用,而化合物11则没有活性,以此说明二氟尼柳的4-噻唑烷酮和氨基硫脲衍生物没有抗菌作用。
同时,对化合物进行M.tuberculosis H37Rv抗真菌测试,发现所有化合物都不具有抗真菌活性。
而对化合物进行的抗病毒研究发现,个别引入噻唑烷酮及氨基硫脲基团的衍生物具有较好的抗病毒活性,而且发现:二氟尼柳氨基硫脲衍生物12,13比二氟尼柳-4-噻唑烷酮衍生物11活性好[16,17]。合成路线如下:

1.6 二氟尼柳酯类化合物的生物活性
二氟尼柳为一具有酚羟基的酸类衍生物,对黏膜具有较强刺激性的特性,特别是长期大剂量的使用。为寻找具有更高的生物利用度、在含水溶剂中更稳定、刺激性更小及更长作用时间的化合物,Shen Tsung-ying[18]等合成化合物14系列:

特别是当Ar为苯基,R为氟,R1为氢或者Ar为1-吡咯,R和R1都为氢时具有抗炎、镇痛及退热活性,且详细的研究了其给药剂型。
Conrad P.Dorn[19]等合成了化合物15系列:

此类化合物在水介质中稳定,对嘴、喉、胃等黏膜无刺激性。
1.7 二氟尼柳酰胺类化合物的生物活性
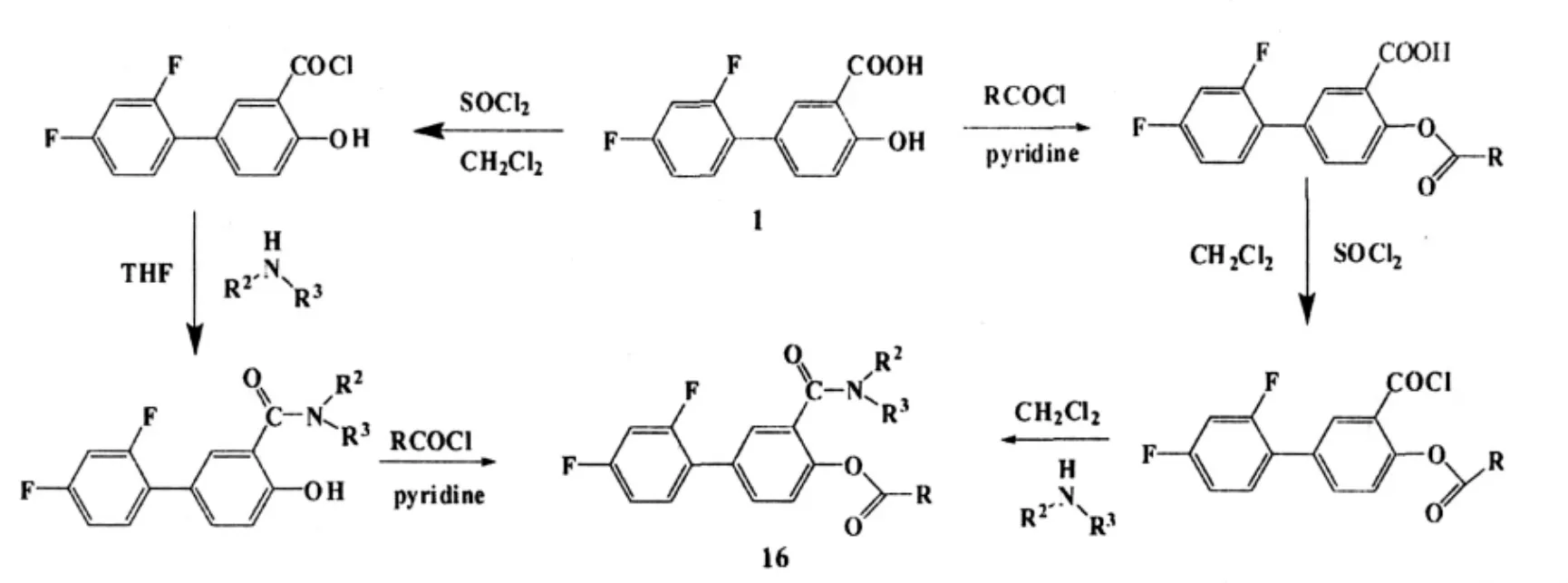
钟光祥等研究小组,利用以下两条反应路线,合成了一系列二氟尼柳衍生物16,测试了化合物的抗炎活性及抗肿瘤活性,并研究了此类化合物的构效关系,发现部分化合物具有显著的抗炎、镇痛、抗肿瘤活性,尤其对于人子宫内膜癌Ishikawa细胞株具有非常显著的抑制作用,已经申请了多项发明专利。目前,该课题组正加大力度进行二氟尼柳衍生物的抗肿瘤活性研究[20,21]。
1.8 发现转甲状腺素蛋白聚集的抑制活性
Transthyretin(TTR),转甲状腺素蛋白是一种由肝和脑脉络丛合成的,在血浆和脑脊髓液中发现的蛋白质。其作用是运载甲状腺激素T4及视黄醇。目前已发现,80多种TTR变种与不同类型的遗传性淀粉样变性疾病有关。研究发现,TTR淀粉样纤维的形成,需在聚集前从四聚体分离成单体,而一些相分子能与T4在结合通道中结合。这些通道穿过分子中心,并诱导形成新的亚基间相互作用,能稳定蛋白质的原生状态,阻止淀粉样纤维形成的早期阶段[22,23]。

目前已发现,二氟尼柳等非甾体抗炎药及衍生物能作为转甲状腺素蛋白聚集的抑制剂。Sara L.Adamski-Werner等[23]合成了26个二氟尼柳类似物,都具有很高的抑制活性,其中8个与TTR具有非常好的结合选择性,且大幅度的减慢四聚体分离。Luis Gales,Sandra Macedo-Ribeiro等经筛选发现,二氟尼柳的碘化物与TTR具有很高的结合能力与选择性,且在血浆中对TTR四聚体具有有效的稳定作用[23,24]。Teresa Mairal等以二氟尼柳为母体,分别合成了一系列含碘与不含碘二氟尼柳衍生物(17),对其进行生物化学,生物物理的研究比较,确定了碘原子在寻找治疗与TTR有关的淀粉样变性病的药物中具有十分重要的意义[25]。
2 结束语
二氟尼柳衍生物不仅在抗炎、镇痛、副作用等各方面都比二氟尼柳等非甾体抗炎药物具有优势,而且特定基团的引入更有可能使其同时具有抗炎及抗肿瘤等其他的活性,为新药的发现提供了方向。总之,二氟尼柳衍生物具有很高的研究和发展前途。
[1]冯雪松,刘雅茹,王立坤,等.二氟尼柳的药理作用与临床应用[J].山西医药杂志,2005,34(6):86-487.
[2]梁诚.二氟尼柳开发前景广阔[J].中国医药情报,2004,10(1):26-27.
[3]孙德本.新型非甾体抗炎镇痛药-二氟尼柳[J].中国新药杂志,2000,9(7):494-495.
[4]孟繁浩,王立升,贾伟儒.非甾体抗炎药二氟尼柳的合成[J].精细化工,2002,19(5):252-253.
[5]陆鹤忠,张纪立.二氟尼柳的合成[J].中国应用化学,1998,15(1):27-28.
[6]张奎,许文松.氟苯水杨酸的合成进展[J].化工中间体,2003,17:8-12.
[7]周窑生.氟苯水杨酸合成路线图解[J].中国医药工业杂志,1992,23(7):333-334.
[8]Claudio G,Laura C,Francesco M.Process for the preparation of 5-(2,4-difluorophenyl)-salicylic acid:EP,0494419[P].1992-07-15.
[9]Hannah J,Ruyle WV,Jones H,et al.Discovery of Diflunisal[J].Br J clin Pharmac,1977,4:7-13.
[10]胡金清.二氟尼柳酰胺衍生物的合成及生物活性研究[D].浙江省杭州市:浙江工业大学,2009.
[11]Stradi R.Imidazolium salt of 2,4-difluo-4-hydroxydiphenyl-3-carboxylicacid:GB,2174699[P].1986-11-12.
[12]Brugioni M,Fedi M.Anti-inflammatory,analgesic,antipyretic,water-soluble compound and processforits preparation:GB,2101135[P].1983-01-12.
[13]Yu C X.Positively charged water-soluble prodrugs of Diflunisal and related compounds with very fast skin penetration rate:WO,2008012603[P].2008-01-31.
[14]Hung Y D,Mellick D G,Prankerd J R,et al.Synthesis,identification,characterization,stability,solubility,and protein binding of ester derivatives of salicylic acid and Diflunisal[J].Int J Pharm,1997,153:25-39.
[15]Hung Y D,Roberts S M.Novel Diflunisal esters and related compounds:US,2003220497[P].2003-11-27.
[16]Kücükgüzel G S,Mazi A,Sahin F,et al.Synthesis and biological activities of Diflunisal hydrazide-hydrazones[J].Eur J Med Chem,2003,38:1005-1013.
[17]Kücükgüzel G,Kocatepe A,Clercq D E,et al.Synthesis and biological activity of 4-thiazolidinones,thiosemicarbazides derived from Diflunisal hydrazide[J].Eur J Med Chem,2006,41:353-359.
[18]Shen T Y,Jones H,Mulvey M D.Acetaminophen esters of aryl salicylic acids:US,3892769[P].1975-07-01.
[19]Dorn P C.Prodrug esters of Diflunisal and related compouds:US,4542158[P].1985-09-17.
[20]Zhong G X,Chen L L,Li H B,et al.Synthesis and biological evaluation of amide derivatives of Diflunisal as potential anti-tumor agents[J].Bioorg Med Chem Lett,2009,19:4399-4402.
[21]Zhong G X,Hu J Q,Zhao K,et al.Synthesis and biological evaluation of amide derivatives of Diflunisal as potential anti-inflammatory agents[J].Bioorg Med Chem Lett,2009,19:516-519.
[22]Gales L,Macedo-Ribeiro S,Arsequell G,et al.Human transthyretin in complex with iododiflunisal:structural features associated with a potent amyloid inhibitor[J].Biochem J,2005,388:615-621.
[23]AdamskiWerner L S,Palaninathan K S,Sacchettini C J,et al.Diflunisal Analogues Stabilize the Native State of Transthyretin.Potent Inhibition of Amyloidogenesis[J].J Med Chem,2004,47(2):355-374.
[24]Almeida R M,Macedo B,Cardoso I,et al.Selective binding to transthyretin and tetramer stabilization in serum from patients with familialamyloidotic polyneuropathy by an iodinated diflunisal derivative[J].Biochem J,2004,381:351-356.
[25]Mairal T,Nieto J,Pinto M,et al.Iodine Atoms:A New Molecular Feature for the Design of Potent Transthyretin Fibrillogenesis Inhibitors[EB/OL].[2009-01-06].http://www.plosone.org/article/info:doi/10.1371/journal.pone.0004124.
