肥大细胞释放生物活性介质促进TNCB致敏淋巴细胞分泌IL-17
2010-01-11王庆辉吕昌龙陈鲲鹏单风平
王庆辉,吕昌龙,施 鹏,刘 军,庞 维,冯 辉,陈鲲鹏,单风平*
(1.中国医科大学基础医学院免疫学教研室,辽宁沈阳 110001;2.沈阳医学院附属奉天医院妇产科,辽宁沈阳 110024)
接触性超敏反应(Contact hypersensitivity,CHS)是由于接触金属、橡胶、化学制品、化妆品和药物等外界物质而引发的皮肤炎症性改变,被认为是由抗原特异性T细胞介导的迟发型超敏反应。利用氯化苦咪酸(Trinitrochlorobenzene,TNCB)和二硝基氟苯(Dinitrofluorobenzene,DNF-B)等半抗原诱导CHS的小鼠模型的实验结果表明,T细胞通过释放TNF-α和IFN-γ等前炎症性细胞因子,诱导局部组织细胞释放趋化因子,募集白细胞至受侵部位,造成组织水肿、红斑,反复刺激甚至可发生出血坏死。近年来,研究报道显示I L-17也参与了CHS的致病过程。 IL-17主要是由Th17细胞分泌的一种前炎症性细胞因子。Th17特异性转录因子ROR-γt在CHS的表达增加[1]; IL-17-/-小鼠CHS的反应和炎细胞的浸润程度均低于野生对照小鼠[2];利用抗 IL-17抗体进行体内阻断,也表明 IL-17在CHS的效应阶段发挥重要作用[3]。但抗原物质如何诱导机体产生 IL-17尚未见报道。天然免疫的重要细胞—肥大细胞可释放组胺、细胞因子等生物活性介质,阻止病原体的感染,构筑了机体的第一道防线。据报道,肥大细胞通过释放TNF-α等介质,募集中性粒细胞,参与CHS[4]。由于肥大细胞具有分泌多种细胞因子的能力,推测其可能具有诱导T细胞分泌 IL-17的潜能,为此,本实验利用TNCB致敏C57BL/6小鼠,检测肥大细胞体外诱导致敏淋巴细胞分泌 IL-17的能力,为进一步揭示CHS的致病机制提供相关实验数据。
1 材料与方法
1.1 材料
1.1.1 实验动物 C57BL/6小鼠(本校实验动物部提供),6~8周龄,雌性。
1.1.2 主要试剂 TNCB(Tokyo Kasei Co.,Tokyo,Japan);RPM I 1640培养基(Ther mo);FCS(Biological Industries,Haemek,Israel);小鼠 IL-3(PeproTech EC,London,United Kingdom);小鼠SCF(PeproTech EC);TNBS(Sigma);2.4G2(Pha rMingen);PE-anti FcεR I抗体(MAR-1,eBioscience),FITC-anti-c-kit抗体(BD Pharmingen);I L-6、TNF-α和 IL-17 EL ISA试剂盒(R&D Systems,Minneapolis,MN)。
1.1.3 主要仪器 FACSCalibur流式细胞仪(Becton-Dickinson,Franklin Lakes,N.J.,USA);酶标仪(Inte rMed NJ-2100);CO2孵箱(Harasawa,Japan)。
1.2 方法
1.2.1 骨髓来源的肥大细胞(born marrow-derived mast cells,BMMC)的制备 C57BL/6小鼠,雌性,6~8周龄。无菌钝性分离小鼠双侧股骨,用1 mL注射器吸取少量RPM I-1640培养液冲洗股骨骨髓内细胞至10 cm无菌平皿中。收集细胞至10 mL离心管中,1 000 r/min,4℃离心5 min,弃上清。用10 mL BMMC培养液(含100 U/mL小鼠 IL-3和0.5 U/mL小鼠SCF的10%FCS-RPM I1640培养液)重悬细胞,移至10 cm无菌培养皿,于37℃,5%CO2孵箱孵育。常规换液,培养4周后待用。
1.2.2 流式细胞仪检测 收集BMMC,调细胞悬液浓度至5×106个/mL。在预先加入FcγⅢ/Ⅱ封闭抗体2.42G的流式细胞仪专用染色管中加入细胞悬液0.1 mL,再加入PE-anti FcεR I单克隆抗体和FITC-anti-c-kit单克隆抗体,4℃避光孵育1 h后,加入1 mL PBS,1 000 r/min,4℃离心5 min,弃上清,洗细胞2遍。加入0.4 mL PBS混匀细胞。用FACSCalibur流式细胞仪分析细胞表面FcεR I和c-kit表达,即利用FACS CELLQUEST软件获取细胞,每个样品分析10 000个细胞,使用前向散射角(FSC)及侧向散射角(SSC)确定目的细胞群,然后以二维点阵图显示FcεR I+c-kit+的细胞百分数。
1.2.3 BMMC体外活化 收集BMMC,调BMMC细胞悬液浓度至1×106个/mL,接种于96孔细胞培养板,0.2 mL/孔,再加入LPS(终浓度为1μg/mL),同时设只加培养液的阴性对照,于37℃,5%CO2孵箱孵育3 h(TNF-α)或6 h( IL-6)。收集培养上清,-20℃保存,待细胞因子检测。
1.2.4 体外细胞共同培养 用溶于丙酮的100 μL 5%TNCB在去毛的C57BL/6小鼠腹部涂抹致敏,同时设未经致敏的正常对照组。4 d后颈椎脱位处死小鼠,常规无菌分离腹部淋巴结,制备淋巴细胞悬液,用10%FCS-RPM I 1640培养液调细胞悬液浓度至1×106个/mL。同时,无菌取正常小鼠脾脏,常规制备脾细胞悬液,经100μg/mL丝裂霉素C于37℃,5%CO2孵箱孵育30 min后,再经溶于PBS的10 mmol/L TNBS于37℃孵育10 min,PBS洗细胞2遍,用10%FCS-RPM I 1640培养液调细胞悬液浓度至2×106个/mL,作为抗原提呈细胞(APC)。另将LPS活化的BMMC经丝裂霉素C于37℃孵育30 min后,PBS洗细胞2遍,调细胞浓度至2×106个/mL(MC)。将TNCB致敏小鼠的淋巴结细胞(TNCB-LN)和未经致敏的正常小鼠淋巴结细胞(N-LN)分别与APC和MC以细胞数1:1:1比例接种于96孔细胞培养板中,37℃,5%CO2孵箱孵育共同培养,即分别为TNCB-LN+APC+MC实验组和N-LN+APC+MC对照组,同时设单纯培养的TNCB-LN和NLN对照组。培养72 h后收集培养上清,-20℃保存,待 IL-17分泌检测。
1.2.5 EL ISA试剂盒检测细胞因子 按照EL ISA试剂盒说明书操作步骤分别检测培养上清中TNF-α、 IL-6和 IL-17的分泌水平,每份标本设3个复孔。用酶标仪测定样本的OD450值。以试剂盒提供的标准品绘制标准曲线,应用Sof tMax Pro 4.3.1LS软件分析,计算细胞因子含量(pg/mL)。
2 结 果
2.1 成熟BMMC表型鉴定
小鼠BMMC培养4周后,经流式细胞仪检测,>95%的细胞表达成熟肥大细胞的特异性表型(FcεR I+/c-kit+)(见图1)。
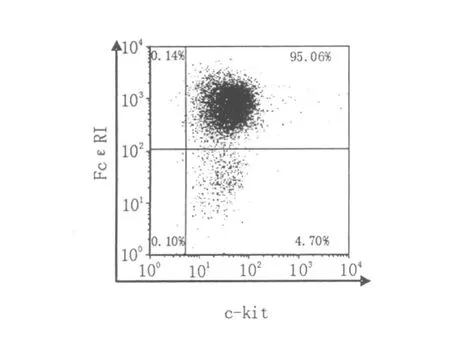
图1 BMMC特异性表面分子的表达Fig.1 The expressions of specific markers on BMMC
2.2 成熟BMMC经LPS刺激后细胞因子的分泌
如图2和图3所示,小鼠BMMC培养4周后,培养上清中TNF-α和 IL-6的分泌处于较低水平,经1μg/mL LPS孵育后,TNF-α(3 h)和 IL-6(6 h)的分泌水平分别高达(152.3±4.19)pg/mL和(1 285.5±446.5)pg/mL,提示LPS活化的BMMC具有分泌炎症性细胞因子的能力。
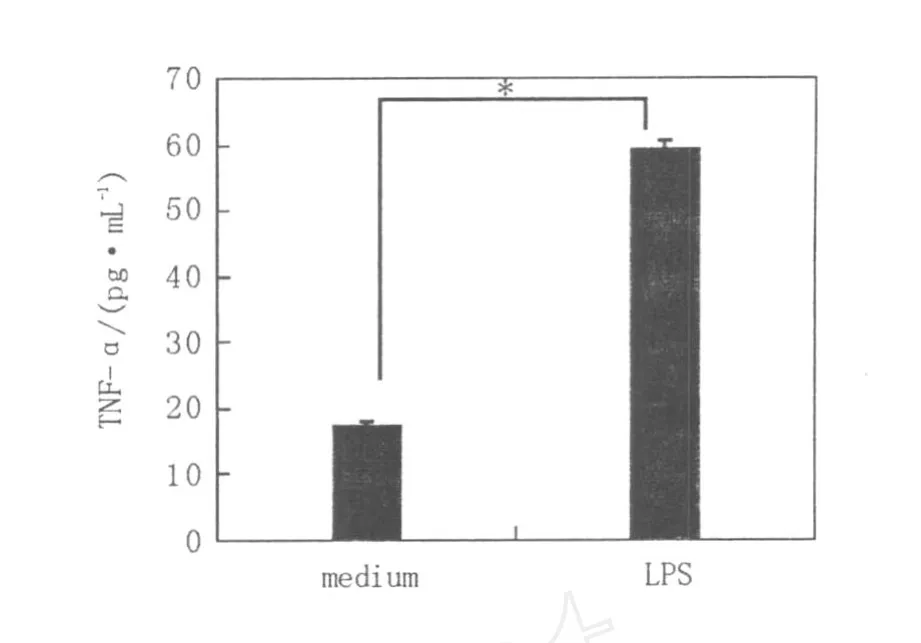
图2 BMMC经LPS刺激后TNF-α的分泌水平Fig.2 The level of TNF-αin the supernatant of LPS incubated BMMC
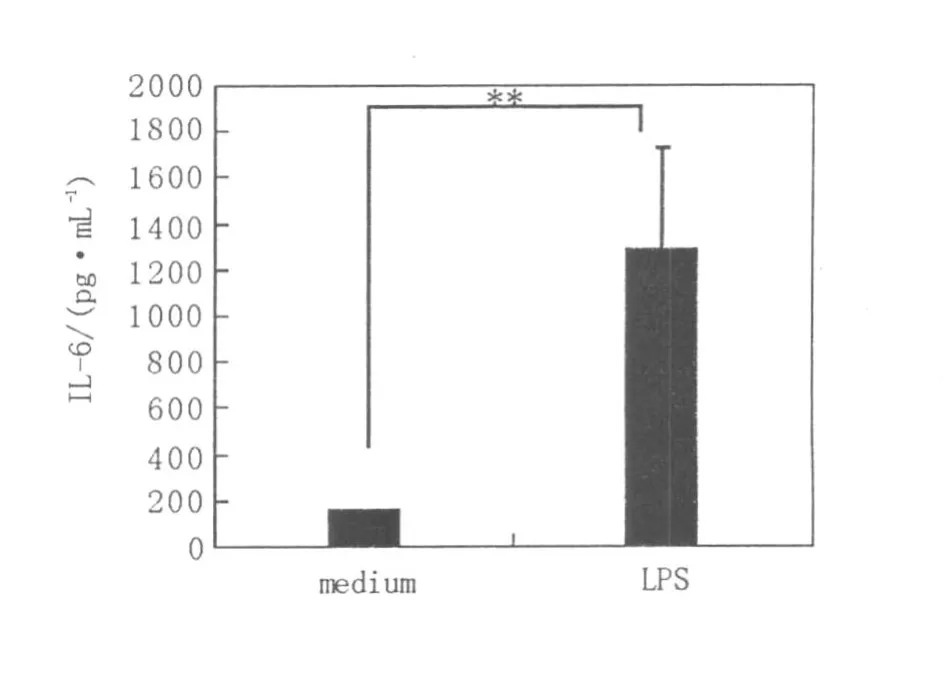
图3 BMMC经LPS刺激后I L-6的分泌水平Fig.3 The level of IL-6 in the supernatant of
2.3 活化的BMMC诱导TNCB致敏小鼠淋巴细胞I L-17的分泌
如图4所示,未致敏的淋巴细胞(N-LN)和TNCB致敏的淋巴细胞(TNCB-LN)单纯培养后,
IL-17的分泌水平均较低;在TNBS处理的脾细胞作为抗原提呈细胞和活化的BMMC的存在下,TNCB致敏的淋巴细胞 IL-17的分泌水平(TNCBLN+APC+MC组)显著高于未致敏的淋巴细胞(N-LN+APC+MC组)。由此提示,肥大细胞可促进TNCB致敏淋巴细胞的 IL-17分泌。
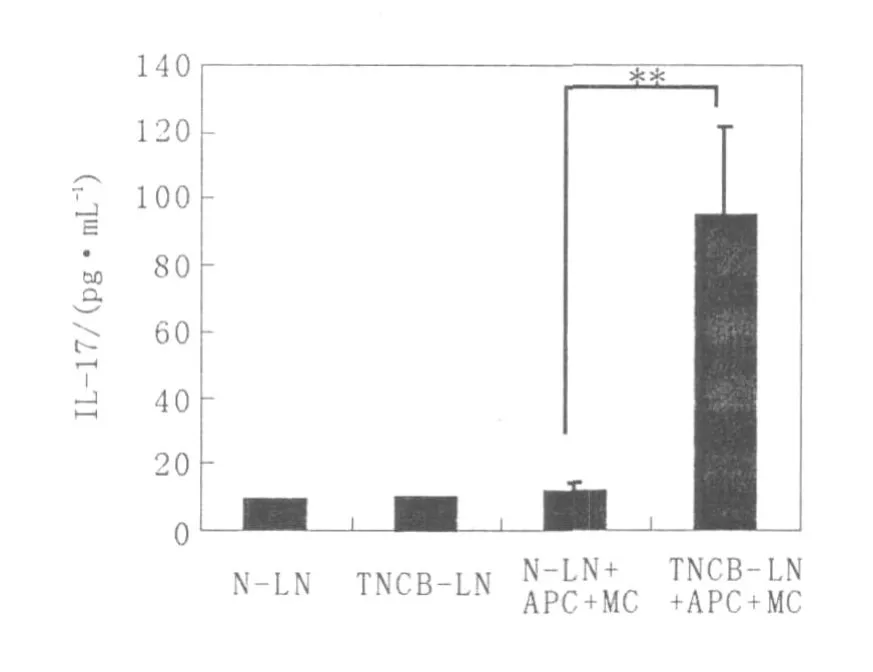
图4 细胞混合培养上清中I L-17的分泌水平Fig.4 The level of IL-17 in the co-cultured supernatant
3 讨 论
IL-17是介导Th17细胞发挥致炎效应的关键性细胞因子[5],动员并活化炎症部位的中性粒细胞[6],参与过敏性炎症、自身免疫病、器官移植及肿瘤等疾病的发生[7-8]。近年来,研究结果显示IL-17和Th17细胞也参与了CHS的免疫病理过程[1-3]。因此,探讨影响 IL-17分泌的相关因素对CHS的防治具有重要意义。本实验主要利用CHS的诱导剂TNCB致敏C57BL/6小鼠,旨在研究肥大细胞诱导TNCB致敏淋巴结细胞分泌 IL-17的能力。
肥大细胞主要位于黏膜和结缔组织中,由于其数量少,不易分离、纯化,研究者们通常用成熟的骨髓来源的肥大细胞(BMMC)进行体外肥大细胞功能的研究。本实验中小鼠骨髓细胞在肥大细胞培养液中培养4周之后,经流式细胞仪检测>95%的细胞表面表达肥大细胞特异性标志FcεR I和c-kit,提示BMMC培养成熟。进而,非特异性活化的BMMC可以分泌多种细胞因子,如TNF-α、IL-6和 IL-12/23p40等[9]。其中 IL-6和 IL-23是维持促进Th17细胞分化的关键因素[10];TNF也被报道可以促进Th17细胞依赖性的中性粒细胞的募集[11]。因此,我们推测活化的BMMC可能具有诱导TNCB致敏淋巴细胞分泌 IL-17的能力。将小鼠淋巴结细胞与TNBS体外孵育后的脾细胞和活化的BMMC共同培养后,结果显示与未致敏的淋巴细胞对照组相比,BMMC能够刺激TNCB致敏小鼠淋巴细胞 IL-17的分泌。由此提示在CHS的致敏阶段,肥大细胞可能通过释放IL-6、TNFα-等生物活性介质,促进Th17细胞的分化和 IL-17的分泌。肥大细胞在 IL-17依赖的CHS的作用还有待体内试验的进一步研究。
[1] Martiniuk F,Lee DS,Gaspari A,et al.Expression of CD70 and the TH17 transcription factor RORgammaT in human contact dermatitis[J].J DrugsDermatol,2008,7(10):956-960.
[2] akae S,Komiyama Y,NambuA,et al.Antigen-specific T cell sensitization is impaired in IL-17-deficient mice,causing suppression of allergic cellular and humoral responses[J]. Immunity,2002,17(3):375-387.
[3] He D,Wu L,Kim HK,et al.CD8+IL-17-producing T cells are important in effector functions for the elicitation of contact hypersensitivity responses[J].J Immunol,2006,177(10):6852-6858.
[4] Biedermann T,KneillingM,Mailhammer R,et al.Mast cells control neutrophil recruitment during T cell-mediated delayedtype hypersensitivity reactions through tumor necrosis factor and macrophage inflammatory protein 2[J].J Exp Med,2000,192(10):1441-1452.
[5] Bettelli E,Korn T,OukkaM,et al.Induction and effector functionsof T(H)17 cells[J].Nature,2008,453(7198):1051-1057.
[6] Kolls JK,Linden A.Interlukin-17 family members and inflammation[J]. Immunity,2004,21:467-476.
[7] CarlsonMJ,WestML,Coghill JM,et al.In vitro-differentiated TH17 cells mediate lethal acute graft-versus-host disease with severe cutaneous and pulmonary pathologic manifestations[J].Blood,2009,113(6):1365-1374.
[8] Wang YH,Liu YJ.The IL-17 cytokine familyand their role in allergic inflammation[J].CurrOpin Immunol,2008,20(6):697-702.
[9] NakanoN,Nishiyama C,Kanada S,et al.Involvement ofmast cells in IL-12/23 p40 production is essential for survival from polymicrobial infections[J].Blood,2007,109(11):4846-4855.
[10] Aggarwal S,Ghilardi N,Xie MH,et al.Interleukin-23 promotes a distinct CD4 T cell activation state characterized by the production of interleukin-17[J].J Biol Chem,2003,278(3):1910-1914.
[11] Nakae S,Suto H,Berry GJ,et al.Mast cell-derived TNF can promote Th17 cell-dependent neutrophil recruitment in ovalbumin-challenged OTIImice[J].Blood,2007,109(9):3640-3648.
