多重PCR方法快速检测4种主要致腹泻性大肠埃希菌
2010-01-11徐义刚崔丽春李苏龙姜艳春谢晓峰刘新亮
徐义刚,崔丽春,李苏龙,姜艳春,谢晓峰,刘新亮
(1.黑龙江出入境检验检疫局检验检疫技术中心,黑龙江哈尔滨 150001;2.东北林业大学,黑龙江哈尔滨 150040)
大肠埃希菌(Escherichia coli)由Escherich于1885年首次发现,起初一直被认为是肠道菌群的正常组成部分,属于条件致病菌。20世纪中叶,人们认识到某些特殊血清型大肠埃希菌对人和动物有致病性,尤其对婴儿和幼畜(禽),常引起严重腹泻和败血症[1-2]。与人类疾病有关的大肠埃希菌,统称为致泻性大肠埃希菌(diarrheogenicE.coli),根据生物学特性主要分为4类[3-4]:产肠毒性大肠埃希菌(ETEC)、肠致病性大肠埃希菌(EPEC)、肠侵袭性大肠埃希菌(EIEC)和肠出血性大肠埃希菌(EHEC)。致泻性大肠埃希菌作为人畜共患性致病菌,其研究具有重要的公共卫生意义。ETEC主要感染儿童和旅游者,发展中国家尤为严重,被污染的水和食物是主要传染来源,主要致病因素是大肠埃希菌肠毒素LT或ST[5],感染的临床症状轻度时为温和性腹泻,严重时可发展为霍乱样腹泻症状[6];EPEC是婴儿腹泻的主要病原菌,具有高度传染性,严重者可致死,病原菌主要感染肠上皮细胞或组织培养细胞表面形成特征性的组织病理学损伤[7];EIEC主要引起大龄儿童和成年人腹泻,曾爆发流行,临床症状为水样腹泻,有时呈现痢疾症状[8];EHEC主要血清型是O157:H7,引起散发性或暴发性出血性结肠炎,可产生志贺毒素样细胞毒素[9]。目前我国针对致泻性大肠埃希菌的检测方法主要采用国标法(GB 4789.6-1994),经样品→增菌→分离培养→革兰染色镜检/生化及菌落观察/生化反应试验/肠毒素检查等,操作复杂繁琐,检测时间长,完成整个检测程序需要4~7 d,且检测单一。本文结合致泻性大肠埃希菌的危害性和感染的普遍性,建立一种多重PCR方法,实现一次性完成4种主要致泻性大肠埃希菌的检测。
1 材料与方法
1.1 材料
1.1.1 菌株 大肠埃希菌ATCC 25922、肠出血性大肠埃希菌O157:H7 ATCC 35150、产肠毒素大肠埃希菌ATCC 35401、侵袭性大肠埃希菌ATCC 43893、肠致病性大肠埃希菌ATCC 11775、阪崎肠杆菌ATCC 51329、单核细胞增生李斯特菌ATCC 19111、绵羊李斯特菌ATCC 33090、英诺克李斯特菌ATCC 19119、威尔斯李斯特菌ATCC 35897、西尔李斯特菌ATCC 35967、类志贺单胞菌ATCC 14030、嗜水气单胞菌ATCC 7966、空肠弯曲菌ATCC 33560、普通变形杆菌ATCC 49027、猪霍乱沙门菌ATCC 10708、福氏志贺菌ATCC 12022、金黄色葡萄球菌ATCC 29213、溶血性链球菌CMCC 32121、霍乱弧菌ATCC 14035、副溶血性弧菌ATCC 27519、溶藻性弧菌ATCC 33839、创伤弧菌ATCC 33149和小肠结肠炎耶尔森菌ATCC 9610,分别由美国典型菌种保藏中心(ATCC)和中国医学微生物菌种保藏管理中心(CMCC)提供。
1.1.2 试剂 TaqDNA Polymerase,NEB公司;细菌基因组DNA提取试剂盒,大连TaKaRa公司;复合增菌培养基BPW,北京兰伯瑞生物技术公司。
1.2 方法
1.2.1 引物设计 根据GenBank中发布的EHEC O157:H7 O-antigen基因、ETEC LT基因、EPECbfpA基因和EIEC invasion plas mid基因,利用引物设计软件Pr imer 5.0设计4对多重PCR引物,详细信息见表1,引物由大连TaKaRa公司合成。

表1 PCR引物序列Table 1 The primers sequence of PCR
1.2.2 细菌培养及基因组DNA提取 将试验菌株分别接种于5 mL复合增菌培养基BPW中,按照每种细菌最适生长温度培养过夜,吸取1 mL培养菌液,利用细菌基因组DNA提取试剂盒进行提取DNA,详见说明书。
1.2.3 单一PCR反应体系及条件的优化 PCR反应体系为25μL,不含Mg2+的Buffer(10×)2.5 μL,将Mg2+、dNTP、TaqDNA Polymerase和引物配制成不同浓度的组合,用去离子水补充至25μL。Mg2+、dNTP、TaqDNA Polymerase和引物的浓度范围依次为:Mg2+浓度范围1.0~8 mmol/L,以0.5 mmol/L递增;dNTPs浓度范围0.1~0.8 mmol/L,以0.05 mmol/L递增;TaqDNA Polymerase浓度范围0.5~3.5 U,以0.5 U单位递增;引物浓度范围0.1~0.6μmol/L,以0.1μmol/L递增。采用矩阵法进行对比试验。反应条件:95℃5 min,95℃20 s,为了提高PCR反应的灵敏度和特异性,根据设计的引物退火温度,以55℃为基础,以0.5℃递加,直至62℃,时间30 s,进行35个循环。
1.2.4 多重PCR反应条件的优化 多重PCR反应体系为25μL,以提取的致病菌基因组作为模板,进行多重PCR扩增,反应条件及体系优化参考单重PCR方法进行。
1.2.5 多重PCR方法的特异性 采用试剂盒法提取试验菌株的基因组DNA,利用所建立的多重PCR方法进行扩增,验证本方法的特异性。
1.2.6 多重PCR方法的敏感性 测定所提取的4种致泻性大肠埃希菌基因组DNA浓度,然后分别进行10倍递进系列稀释,从每种致病菌基因组DNA的每个稀释度中各取1μL混合,以此作为模板进行多重PCR扩增,以确定其敏感性。
1.2.7 验证试验 将建立的多重PCR检测方法应用于检验检疫实践工作中,检测124份肉类、奶类制品及人工污染样品等,其结果与国标法(GB 4789.6-1994)进行比较,验证该方法的可靠性。
2 结果与分析
2.1 多重PCR反应条件的确定
首先对单一PCR反应体系进行了优化,经对比分析确定单一PCR反应体系中的Mg2+浓度为2.5 mmol/L、dNTP浓度为0.2 mmol/L、TaqDNA Polymerase用量为1.5 U、引物浓度为0.2μmol/L,在该反应体系下的PCR产物经琼脂糖凝胶电泳检测,结果见图1。在单一PCR反应体系扩增的基础上,优化了多重PCR反应体系及条件,最佳反应体系为:Mg2+浓度为4 mmol/L、dNTP浓度为0.3 mmol/L、TaqDNA Polymerase用量为2.0 U,PCR扩增引物浓度比例为ETEC:EHEC:EIEC:EPEC=1:1:1.3:1。反应条件为:95℃5 min、95℃15 s、60℃20 s、72℃60 s,进行35个循环,多重PCR扩增产物琼脂糖凝胶电泳检测结果见图2。
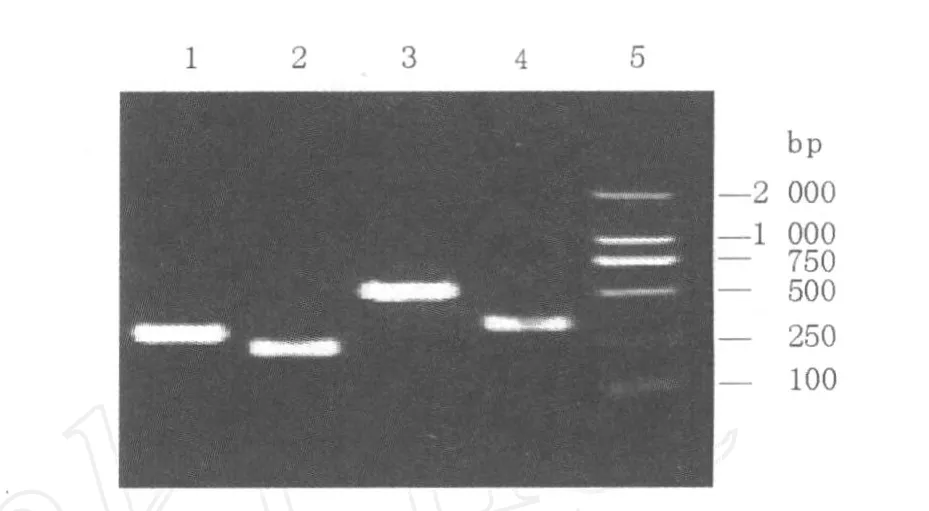
图1 致泻性大肠埃希菌单一PCR检测结果Fig.1 The detection results of diarrheogenicEscherichia coliby single PCR
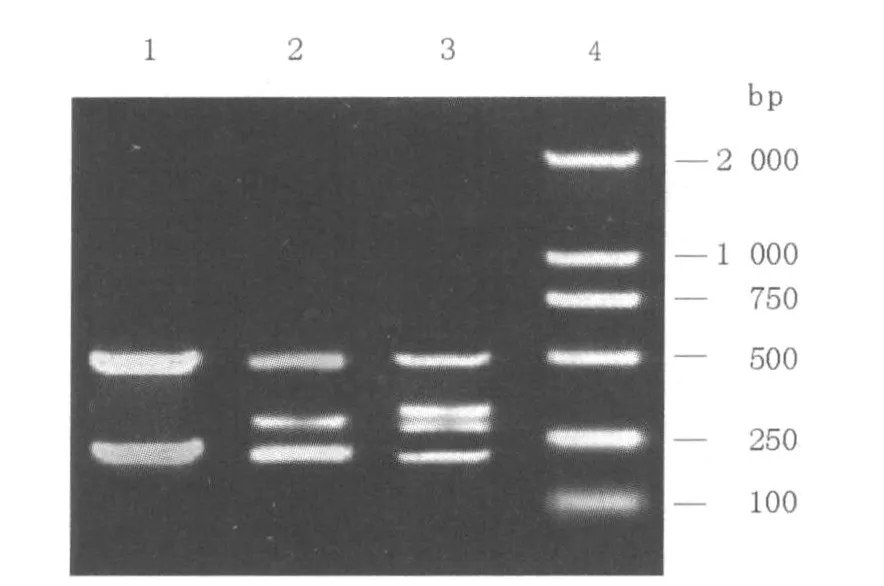
图2 4种致泻性大肠埃希菌多重PCR扩增结果Fig.2 The amplification results of four diarrheogenic Escherichia colibymulti-PCR
2.2 多重PCR的特异性
利用多重PCR方法对表2中24株细菌进行特异性检测试验,结果显示所试肠出血性大肠埃希菌、肠侵袭性大肠埃希菌、肠致病性大肠埃希菌和产肠毒性大肠埃希菌等4种致泻性大肠埃希菌均为阳性,说明本研究所建立的多重PCR方法具有高度特异性。

表2 多重PCR特异性结果Table 2 The specificity results ofmulti-PCR assay
2.3 多重PCR的敏感性
将已知浓度的4种致泻性大肠埃希菌基因组DNA进行梯度稀释,从每个稀释度中各取1μL混合,以此作为模板进行多重PCR扩增,以确定其敏感性。结果表明,该多重PCR方法能同时检测到128 pg的EHEC、EPEC、EIEC和ETEC的基因组DNA,其中EHEC和ETEC的最低基因组DNA检出浓度为32 pg。
2.4 多重PCR的实践应用
利用多重PCR方法对124份肉类、奶类制品及人工污染食品样品进行检测,同时采用国标进行验证,结果见表3。多重PCR方法共检出15份阳性样本,与国标检测结果符合率为100%,说明所建立的多重PCR方法具有良好的可靠性。

表3 多重PCR方法实际应用结果Table 3 The application ofmulti-PCR assay in practice
3 讨 论
食品安全是全球性的重大公共卫生问题,已报道的食源性疾病致病因子有250多种,其中肠道致病菌是食源性疾病中最常见的生物致病因素。据世界卫生组织(WHO)报道[10],全球每年因食源性微生物污染引起的腹泻病例达数亿起,死亡的0~15岁儿童约170万人。目前,致泻性大肠埃希菌仍是引起腹泻的重要病原之一,特别是婴幼儿腹泻,在我国及国外腹泻患者中致泻性大肠埃希菌检出率、构成比、优势类型及血清型不同[11-15],给临床诊断带来不便。
在此情况下,采用多重PCR方法一次性检测出单一病原感染或混合感染,对保障食品安全和人类健康具有现实意义。因此,本研究针对4种主要的致泻性大肠埃希菌相关基因设计了4对特异性引物,通过体系及反应条件优化,建立了一步反应同时检测4种致泻性大肠埃希菌的多重PCR方法。检验检疫实践证实,该方法比常规的细菌分离鉴定敏感度高,检测快速,可用于临床病例的快速诊断和流行病学调查,具有一定的实用性。
[1] 孙贵娟,林毓宁,邓其军,等.南宁市致泻性大肠埃希菌病原监测与研究[J].广西医学,2000,22(4):684-686.
[2] 陈萍,李泽鸿,邴伟.致泻性大肠埃希菌研究进展[J].上海畜牧兽医通讯,2007,4:11-13.
[3] Rodríguez-Angeles G.Principal characteristics and diagnosis of the pathogenic groups of Escherichia coli[J].Salud Publica Mex,2002,44(5):464-475.
[4] Nataro JP,Kaper JB.Diarrheagenic Escherichia coli[J].Clin Microbiol Rev,1998,11(1):142-201.
[5] Levine MM.Escherichia colithat cause diarrhea:enterotoxigenic,enteropathogenic,enteroinvasive,enterohemorrhagic,and enteroadherent[J].J Infect Dis,1987,155:377-389.
[6] Qadri F,Svennerholm AM,Faruque ASG,et al.Enterotoxigenic Escherichia coliin developing countries:epidemiology,microbiology,clinical features,treatment,and prevention[J].ClinMicrobiol Rev,2005,18(3):465-483.
[7] Torres AG,Zhou X,Kaper JB.Adherence of diarrheagenic Escherichia colistrains to epithelial cells[J].Infect Immun,2005,73:18-29.
[8] Lan R,AllesMC,Donohoe K.,et al.Molecular evolutionary relationships of enteroinvasive Escherichia coliand Shigella spp[J].Infect Immun,2004,72(9):5080-5088.
[9] Rowe PC,Orrbine E,OgbornM,et al.EpidemicEscherichia coliO157:H7 gastroenteritis and hemolytic-uremic syndrome in a Canadian Inuit community:intestinal illness in family members as a risk factor[J].J Pediatr,1994,124:21-26.
[10] 张红波.我国食品安全现状分析及其对策[J].中国安全科学学报,2004,14(1):15-17.
[11] 赵瑞珍,李连青,朱庆义,等.产志贺样毒素且具侵袭力的大肠埃希菌性小儿腹泻[J].中华儿科杂志,2006,44(2):136-137.
[12] 张道玲,邵长喜.感染性腹泻病原菌调查分析[J].中国自然医学杂志,2005,7(2):83.
[13] 凌苏,赵星祥,华冰,等.感染性腹泻病原菌及药敏分析[J].中华传染病杂志,2005,23(5):347-348.
[14] Kebede A,Polderman A M.Etiology of Acute Diarrhea in A-dults in Southwestern Nigeria[J].J Clin Microhiol,2004,42(8):3909-3910.
[15] KeskimäkiM,Mattila L,Peltola H,et al.Prevalence of Diarrheagenic Eecherichia coliin Finns with or without Diarrhea during a Round-the-World Trip[J].J Clin Microbiol,2000,38(12):4425-4429.
