嗜麦芽寡养单胞菌D2株单加氧酶基因的克隆与表达
2010-01-11辛晓妮闫志勇宋旭霞
辛晓妮,闫志勇,杨 丽,吴 瑶,王 斌,宋旭霞,罗 玮
(青岛大学医学院,山东青岛 266070)
嗜麦芽寡养单胞菌(Stenotrophom onas m alto-phila)属黄单胞菌科寡养单胞菌属,是一种需氧革兰阴性杆菌,广泛分布于水、土壤、植物根系、人和动物的体表与消化道中,具有很强的代谢活性及广泛的适应能力。近年来研究发现,该菌能产生多种具有较高研究开发价值的生物活性物质,如蛋白酶、氧化酶、碱性磷酸酶、酪氨酸酶、纤溶酶、脂肪酶、淀粉酶等[1-2]。本实验室从海洋生物双齿围沙蚕消化道中分离出1株嗜麦芽寡氧单胞菌(D2株),前期研究结果显示其具有显著的蛋白酶活性和纤维蛋白溶解活性[3]。在分析构建D2株基因组文库时发现,该菌株具有编码单加氧酶(monooxgenase,MO)的基因片段。单加氧酶是一种在有机氧化反应中起关键作用的生物催化剂,能有效地、特异地向有机底物中插入1个氧原子,具有反应条件温和、速度快、专一性强等特点,在环保、工业等领域中具有重要作用[4]。本研究通过基因重组技术获得了D2菌株单加氧酶的完整的编码基因序列,构建了融合表达载体,并成功进行了原核表达。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 嗜麦芽寡养单胞菌D2株由本室闫志勇副教授分离自海洋生物双齿围沙蚕消化道,已被中国微生物菌种保藏管理委员会普通微生物中心(CG MCC)收藏,收藏号CG MCC 1868;pMD18-T购自大连宝生物工程有限公司;pET32a(+)、大肠埃希菌JM109、BL21(DE3)为本实验室保存。
1.1.2 主要试剂和仪器 ①试剂:细菌基因组DNA抽提试剂盒、DNA凝胶回收试剂盒、Taq酶购自Promega公司;DNA Marker、dNTPs购自TAKARA公司,质粒小提试剂盒购自Omega公司;X-gal、氨苄青霉素、IPTG购自Sigma公司;②仪器:基因扩增仪购自德国Eppendorf公司;UVP GDS8000型凝胶成像系统购自美国UVP公司。
1.2 方法
1.2.1 D2菌株基因组DNA的提取 将D2接种于LB培养基,48 h后挑取单个菌落,接种于LB液体培养基,12 h至菌液OD600值约为0.6,参照Promega细菌基因组DNA抽提试剂盒的说明书提取基因组DNA。
1.2.2 D2株基因组文库的构建及部分克隆的分析 用Sau3A I酶切D2株基因组DNA,回收0.2~2 kb的DNA片段,连接至pUC18质粒载体,转化大肠埃希菌JM109,在含有Amp的LB平板上筛选重组子,酶切鉴定后建库保存;随机挑取阳性克隆测序,在网络数据库中进行BLAST分析。
1.2.3 PCR扩增单加氧酶全基因序列 经对D2株基因组文库中部分克隆的分析发现,有一克隆序列与GenBank中嗜麦芽寡养单胞菌R551-3和K279a单加氧酶基因具有较高的同源性,为单加氧酶基因的部分基因片段。为获得该菌的全基因序列,将上述2株细菌的单加氧酶基因用DNA Star软件进行分析,根据保守区序列使用设计引物:For ward:5′-GATCGGCGAGCAGGACCAGT-3′,Reverse:5′-AGTTCTACATCGACATCGCGCGT-3′,扩增产物长度约1 300 bp,由上海Invitrogen公司合成。在100μL体系中分别加入模板DNA 1.0μL,dNTPs 10μL,MgCl24.0μL,上下游引物各4.0μL,TaqDNA聚合酶1.5μL;PCR的循环条件为94℃变性5 min,然后94℃1 min、56℃1 min、72℃1 min,30个循环后72℃延伸10 min。PCR结束后取将产物1.2%的琼脂糖凝胶电泳,用UVP GDS8000型凝胶成相系统分析结果。
1.2.4 单加氧酶基因的克隆和序列测定 使用Promega公司W izard PCR preps DNA purificaton system试剂盒纯化PCR产物。纯化后的产物按常规方法与pMD18-T于4℃过夜后连接,TSS法制备大肠埃希菌JM109感受态并转化,蓝白斑筛选阳性克隆,Omega公司质粒提取试剂盒提取重组质粒,EcoR I酶切鉴定。将经过酶切鉴定的含阳性克隆的菌液送上海Invitrogen公司用AB I3730自动测序仪测序。
1.2.5 D2株单加氧酶基因的体外原核表达克隆的构建和表达 ①引物的设计与PCR扩增:根据1.2.3获得的基因序列,找出单加氧酶基因的ORF,并设计表达扩增引物,Forward:5′-CG ggatcc ATGAGCTATCAGATCAGCGTC-3′,Reverse:5′-TAT aagctttCAGGCCACCGCCGCG-3′,下划线部分分别为BamHⅠ和HindⅢ的酶切识别位点,产物长度996 bp。以重质粒为模板进行PCR扩增;②表达克隆的构建和鉴定:使用Promega公司的试剂盒纯化PCR产物,将该回收产物及pET-32a(+)分别用B amHⅠ和HindⅢ进行双酶切,凝胶电泳后用Omega公司Cycle-Pure kit试剂盒纯化回收酶切产物。将回收的目的基因片段和表达载体pET32a(+)片段用T4连接酶于16℃过夜链接,然后TSS法转化大肠埃希菌BL21,在ALB平板上挑选重组克隆,提取质粒后用BamHⅠ和HindⅢ双酶切鉴定;③目的基因的表达:挑取酶切鉴定正确的重组子,用ALB液体培养基37℃过夜培养至OD600值为0.8时,1:100接种入新的ALB液体培养基,37℃培养至OD600值约为0.8后,加入终浓度为1 mmol/L的IPTG,37℃诱导5 h,取菌液沉淀SDSPAGE电泳观察表达蛋白。
2 结 果
2.1 嗜麦芽寡养单胞菌D2株单加氧酶基因的序列测定
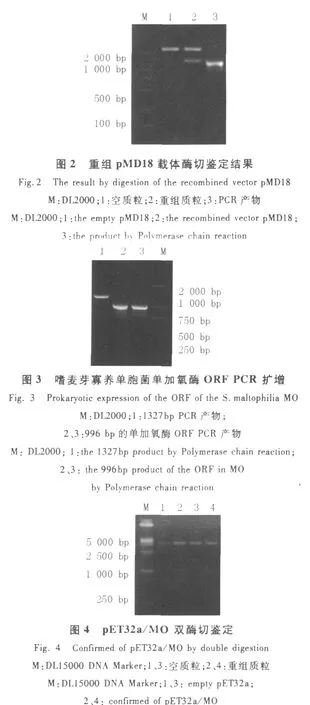
以嗜麦芽寡养单胞菌D2株的基因组DNA为模版进行PCR扩增,获得了包含嗜麦芽寡养单胞菌D2株单加氧酶编码基因在内的约1 300 bp的产物,见图1,将其连接到pMD18,挑选重组载体EcoRⅠ酶切鉴定,见图2,经鉴定证实后的重组基因测序,获得了长度为1 327 bp的基因序列信息(GenBank收录号GQ122330)。
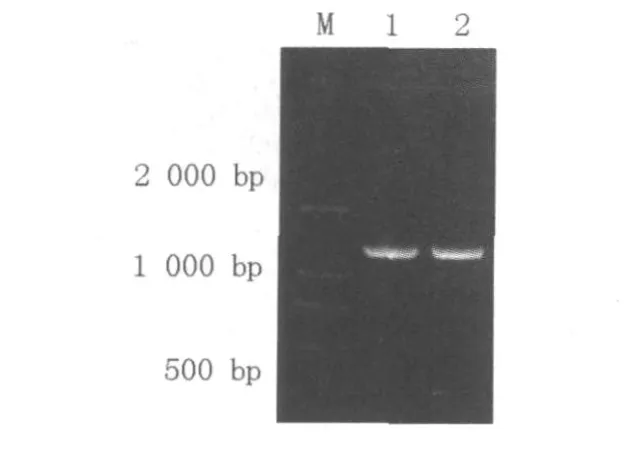
图1 包含编码基因在内的PCR扩增产物Fig.1 the amplified product by polymerase chain reaction including coding gene
2.2 嗜麦芽寡养单胞菌D2株单加氧酶基因表达克隆的构建与鉴定
对2.1的测序结果进行分析,发现其中包含了1个长度996 bp的完整ORF,根据其序列设计引物,以重组pMD18为模版进行PCR扩增,获得了嗜麦芽寡养单胞菌D2株单加氧酶编码基因完整的编码基因,见图3。将该基因片段连接到表达载体pET32a(+)中,重组克隆pET32a/MO经B amHⅠ、HindⅢ双酶切鉴定证实,见图4。
经PubMed中分析发现,D2株单加氧酶与GenBanK中收录的S.m altophiliaR551-3(GI 194346582)及S.m altophiliaK279a(GI1900100-13)相比,ORF基因序列的同源性分别为90%和89%,而氨基酸序列同源性高达96%和95%;且该氨基酸中含有flavin-utilizing monooxygenase超家族的共同保守区。
2.3 嗜麦芽寡养单胞菌D2株单加氧酶基因的体外原核表达
重组pET32a/MO转化宿主菌BL21后,经过IPTG诱导,表达出大小约54 ku的融合目的蛋白,与设计相符,见图5。
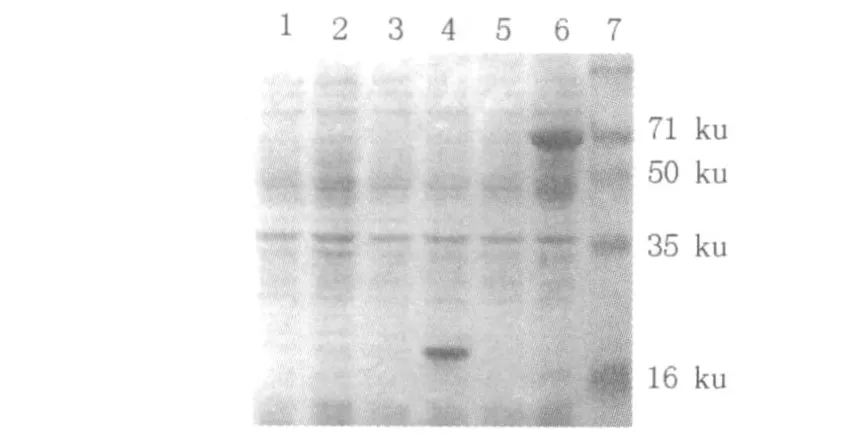
图5 重组pET32a/MO在宿主菌BL21中的表达Fig.5 Expression of the recombined vector pET32a/MO inE.coliBL21
3 讨 论
嗜麦芽寡养单胞菌广泛分布于人体内和外界环境中,因其既能导致人或动植物疾病,又可分泌多种生物活性物质,因而近年来引起广泛关注。2008年分离自医院感染的肿瘤病人血液的该菌K279株[5]和植物毛果杨(Populus trichocarpa)中的R551株[6]的全基因序列测序先后完成;对上述2株细菌的全基因组序列进行了系统的比较,发现该菌具有许多基因组岛(genomic islands,GEIs),其编码蛋白与嗜麦芽寡养单胞菌的天然耐药、生物活性物质的合成和分泌有关[7]。
海洋中蕴含丰富的微生物资源,其中包含了非常有研究价值的海洋微生物基因信息,“海洋生物基因组计划”项目成为世界各海洋大国的焦点,目的在于通过获得相应的遗传序列,全面寻找有价值的遗传信息,更有效地开发和应用海洋微生物等资源。嗜麦芽寡养单胞菌D2株是本实验室自2003年从生活于海岸潮间带的海洋生物双齿围沙蚕消化道内分离出的一种海洋微生物,能分泌产生许多胞外的生物活性物质[8];在对构建的D2株基因组文库分析时,发现一克隆的基因序列与K279株和R551株荧光素样单加氧酶基因序列有较高的同源性。
单加氧酶是将单个氧原子加入到一个有机化合物分子中的一类酶,能使非反应烃转化为可利用烃,把烷烃转化为醇或脂肪酸,把烯烃转化为环氧化物,使芳香烃开环[5],高度特异性催化作用是其最显著特征。单加氧酶具有降解体内潜在的毒性化合物,合成次级代谢物、激素、信号分子等生理作用;此外,因其具有选择性生物氧化的特性,某些单加氧酶能参与药物之间的相互作用而被用于新药的开发和研制,而有的则能应用于降解工业环境中有害的有机物。由此可见,单加氧酶在环境保护、药物研制等方面具有潜在应用价值。然而,对于荧光素样单加氧酶的酶学特征和生物学功能目前尚未见报道。
本文根据GenBank收录的单加氧酶全基因序列设计引物,从D2基因组DNA中扩增出包含该单加氧酶完整开放读码框(ORF)的核酸片段,并将该ORF亚克隆到pET32a中,最终成功地在体外原核系统中表达出了单加氧酶的融合蛋白,为将来进一步研究该荧光素样单加氧酶的生物学功能、结构等奠定了基础;同时,本文也再次证实D2菌株具有产生多种生物活性物质的能力,丰富了海洋微生物基因信息。
[1] Tachibana S,Naka N,Kawai F,et al.Purification and characterization of cytoplasmic NAD-dependentpoly propylene glycol dehydrogenase from Stenotrophom onas maltophilia[J].FEMS Microbiol Lett.,2008,288(2):266-272.
[2] Miyaji T,Otta Y,Shibata T,et al.Purification and characterization of extracellular alkaline serine protease from Stenotrophomonasmaltophilia strain S-1[J].Lett Appl Microbiol,2005,41(3):253-257.
[3] 代玉梅,闫志勇,王斌,等.沙蚕消化道产蛋白酶菌D2株的筛选及其酶学性质[J].中国生物制品学杂志,2007,20(10):493-496.
[4] 周世水,姚汝华.海洋微生物天然活性物质的开发应用进展[J].微生物学杂志,2002,22(2):42-43.
[5] Crossman LC,Gould VC,Dow JM,et al.The complete genome,comparative and functional analysis of Stenotrophomonas maltophilia reveals an organism heavily shielded by drug resistance deter minants.Genome Biol.2008.9:R74.Azerad,R.(1999)Microbialmodels for drugmetabolis m.Adv.Biochem.Eng[J].Biotechnol,63,169-218.
[6] Lucas S,CopelandA,LapidusA,et al.Complete sequence of Stenotrophomonas maltophilia R551-3.EMBL/GenBank/DDBJ databases,Submitted JUN-2008.
[7] Francesco R,Eliana DG,Bianca C,et al.Stenotrophomonas maltophilia genomes:A start-up comparison[J].International Journal of Medical Microbiology,2009,299:535-546.
[8] L.Hauben,L.Vauteri,E.R.B.Moore,et al.Genomic diversity of the genus Stenotrophomonas[J].International Journal of Systematic Bacteriology,1999,49:1749-1760.
