荧光增白剂生产废水不同预处理方法的比较
2010-01-07李江颂王健行李日强王爱英山西大学环境与资源学院山西太原030006山西大学黄土高原研究所山西太原030006
李江颂,王健行,李日强*,王爱英 (.山西大学环境与资源学院,山西 太原 030006;.山西大学黄土高原研究所,山西 太原 030006)
荧光增白剂生产废水是一类特殊的高浓度、难降解有机废水,含有大量带有氨基、硝基和磺酸基等取代基团的苯及其衍生物以及三聚氯氰等有机卤化物,生物毒性强,可生化性非常差[1].另外,废水中盐分含量很高,更增加了其处理难度.目前,国内外对荧光增白剂生产废水的研究较少,已有处理工艺的处理效果普遍较差,处理出水不能达标排放[1-2].
对于高浓度、难降解的有机废水,直接采用生物方法进行处理难以达到理想效果,而化学处理作为一种高效的废水处理方法被应用于多种废水的预处理中,其中研究较多、较普遍的有Fenton试剂氧化法、O3氧化法、铁炭微电解法,已被应用于处理焦化废水、印染废水、医药废水、垃圾渗滤液、腈纶废水等各类废水中[3-9],但是关于荧光增白剂生产废水的处理研究较少.章一丹等[1]采用催化铁内电解—生物膜法处理了荧光增白剂生产废水,经催化铁内电解预处理,荧光增白剂生产废水 CODcr可由 5532mg/L降至3074mg/L,去除率达44.4%.
本研究采用Fenton试剂氧化法、O3氧化法、曝气铁炭微电解法 3种方法对荧光增白剂生产废水进行了处理,考察了 3种处理方法的不同影响因素对处理效果的影响,旨在找出适于荧光增白剂生产废水的预处理方法以及处理的最佳条件,为荧光增白剂生产废水的最终达标处理提供依据.
1 材料与方法
1.1 材料及试验装置
1.1.1 试验用水 试验用废水取自山西某化工厂荧光增白剂系列产品(主要有CBS-X、CBS-L、CBW、DMS、APC、VBL、BBU、CXT、OB、ER330等系列产品和对氨基苯磺酸)生产废水,废水中的主要有机物质有三聚氯氰、DSD酸、苯氨、二乙醇氨、对氨基苯磺酸等.废水中CODCr、BOD5、NH3-N、SS、Cl-浓度分别为5619.7,1316.9,93.5,567.5,18000mg/L,浊度为356.2NTU, pH值为9.2.
1.1.2 试验材料 H2O2(浓度 30%,分析纯,北京北化精细化学品有限责任公司); FeSO4·7H2O(分析纯,北京化工厂);铁屑:取自太原市某钢铁制品生产厂的废铁屑,使用前先用质量百分比为10%NaOH溶液浸泡1.0h以去除表面油渍,用清水冲洗至中性,再用质量百分比为1%稀硫酸浸泡10min去除表面氧化物,用清水冲洗至中性后使用;颗粒活性炭(分析纯,天津市天大化工试验厂),使用前用荧光增白剂生产废水充分浸泡,使其吸附饱和.
1.1.3 试验装置 臭氧反应器:采用10L下口瓶作为臭氧反应器,瓶底放有与臭氧发生器相连的曝气石,臭氧通过曝气石均匀扩散到废水中.曝气铁炭微电解反应器:采用底部装有微孔曝气装置、下端设有取样口的不锈钢反应器作为曝气铁炭微电解反应器.
1.2 试验方法
1.2.1 Fenton试剂氧化处理 取300mL荧光增白剂生产废水于 500mL塑料烧杯中,调节废水pH 值分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0,H2O2/Fe2+(物质的量比)分别为2、5、10、15、20、25、30、35、50、100,一次性投加0.02,0.03,0.07,0.10,0.13,0.20,0.26,0.33mol/L的30%H2O2和相应量的FeSO4·7H2O,120r/min搅拌30s使之迅速混合均匀,30r/min搅拌反应 0.5,1.0,1.5,2.0,2.5,3.0h,沉淀 2.0h后测定上清液的CODCr.每组试验重复3次,结果取平均值.
1.2.2 O3氧化处理 取 2L荧光增白剂生产废水于臭氧反应器中,调节气流量为1L/min(O3浓度为71.61mg/L)、pH值分别为7.0、8.0、9.0、10.0、11.0、12.0,持续通入O3,分别于 10,20,30,40,50,60,70,80,90,100,110min取样,沉淀 1.0h后测定上清液的CODCr.每组试验重复3次,结果取平均值.
1.2.3 曝气铁炭微电解处理 取 3L荧光增白剂生产废水于曝气铁炭微电解反应器中,调节pH值分别为2.0、2.5、3.0、3.5、4.0、5.0、6.0、7.0、8.0,控制铁炭质量比分别为0.3、0.5、1.0、2.0、3.0,总投加量为400g,调节气流量为0.1L/min,底部曝气使其分别反应 0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0h后取样,沉淀2.0h后测定上清液的CODCr.每组试验重复3次,结果取平均值.
1.3 分析项目
CODCr的测定采用重铬酸钾法,BOD5的测定采用稀释接种法,NH3-N的测定采用纳氏试剂光度法,Cl-的测定采用硝酸银滴定法,SS的测定采用重量法[10],浊度的测定采用 WGZ-100型散射式光电浊度仪,pH值的测定采用PHBJ-260雷磁便携式pH计.
2 结果与讨论
2.1 Fenton试剂氧化处理
2.1.1 H2O2投加量对处理效果的影响H2O2的投加量是影响Fenton试剂氧化的主要因素.在pH值为3.0,H2O2/Fe2+(物质的量比)为10,反应时间为1.0h条件下,考察 H2O2投加量对处理效果的影响,结果见图1.

图1 不同H2O2投加量对CODCr去除率的影响Fig.1 Effects of H2O2 dosage on CODCr removal rate using Fenton’s reagent oxidization method
由图1可知,CODCr去除率随着H2O2投加量的增加而增加,当 H2O2投加量达到0.13mol/L时,CODCr从5619.7mg/L降至 3633.1mg/L,去除率达到最大值 35.4%.之后继续增大投加量,去除率基本保持不变.这是因为增加 H2O2的量,·OH生成量增加,CODCr去除率提高,但达到一定程度后,由于废水中存在着较多难以被·OH 氧化的有机物质,所以继续增大 H2O2投加量并不能将这部分有机物氧化.另外有研究[11-12]发现,H2O2投加量过高时,过量的H2O2在反应一开始就会将Fe2+氧化为Fe3+,使反应在 Fe3+催化下进行,Fe3+不仅会抑制·OH 的生成,还会消耗体系的H2O2;H2O2过量时,反应 H2O2+·OH→H2O+HO2的速度加快,部分 H2O2发生无效分解造成浪费,同时影响了氧化反应的进行.因此本试验 H2O2的最佳投加量为0.13mol/L.
2.1.2 H2O2/Fe2+(物质的量比)对处理效果的影响 在pH值为3.0,H2O2投加量为0.13mol/L,反应时间为1.0h条件下,考察 H2O2/Fe2+(物质的量比)对处理效果的影响,结果见图2.
由图2可知,在 H2O2/Fe2+(物质的量比)<20时,CODCr去除率随着H2O2/Fe2+(物质的量比)的增加而增加,当二者之比达到20时, CODCr从5619.7mg/L降至3614.3mg/L,去除率达到最大值35.7%.之后继续增大 H2O2/Fe2+(物质的量比),去除率开始下降.这是因为Fe2+浓度较低时,限制了自由基产生的数量和速度,使反应过程受到抑制,而浓度过高时,H2O2的分解加快,新生成的部分·OH来不及和有机物反应而与溶液中其他还原性物质(例如氯离子)发生反应,使 H2O2的利用率降低,氧化效果下降[13];此外,过多的Fe2+不仅会增加废水后续处理的难度,还可能与·OH 发生副 反 应,降 低 CODCr去 除 率[14].本 试 验H2O2/Fe2+(物质的量比)为20时,处理效果最好.
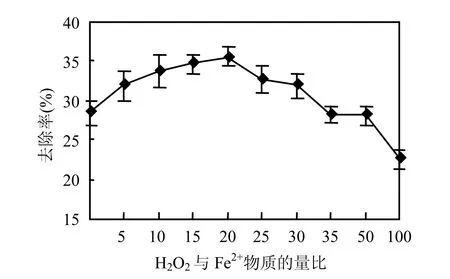
图2 不同H2O2与Fe2+物质的量比对CODCr去除率的影响Fig.2 Effects of H2O2 to Fe(II) molar ratio on CODCr removal rate using Fenton’s reagent oxidization method
2.1.3 pH值对处理效果的影响 在 H2O2/Fe2+(物质的量比)为20,H2O2投加量为0.13mol/L,反应时间为1.0h条件下,考察pH值对处理效果的影响,结果见图3.由图3可知,在pH值为3.0~5.0时,CODCr去除率维持在32%左右,以pH值为4.0最佳,CODCr从5619.7mg/L降至 3782.7mg/L,去除率为32.7%.pH值小于3.0或大于5.0时,CODCr去除率较低.Fenton试剂是在酸性条件下发生作用的[15-16],按照经典Fenton试剂反应理论[17], pH值升高不仅抑制了·OH 的产生,而且使溶液中的Fe2+以氢氧化物的形式沉淀而失去催化能力;pH值过低时,Fe3+不能被顺利还原为Fe2+, Fe2+、Fe3+的络合平衡体系受到影响,阻碍催化反应的进行,进而影响Fenton试剂的氧化能力.本试验pH值为3.0~5.0时,CODCr去除率相差不大,考虑到实际荧光增白剂生产废水的pH值在8.5~9.5之间,为了减小废水处理成本,确定pH5为最佳反应pH值.

图3 不同pH值对CODCr去除率的影响Fig.3 Effects of pH on CODCr removal rate using Fenton’s reagent oxidization method
2.1.4 反应时间对处理效果的影响 在pH 值为5.0,H2O2/Fe2+(物质的量比)为20,H2O2投加量为0.13mol/L条件下,考察反应时间对处理效果的影响,结果见图4.
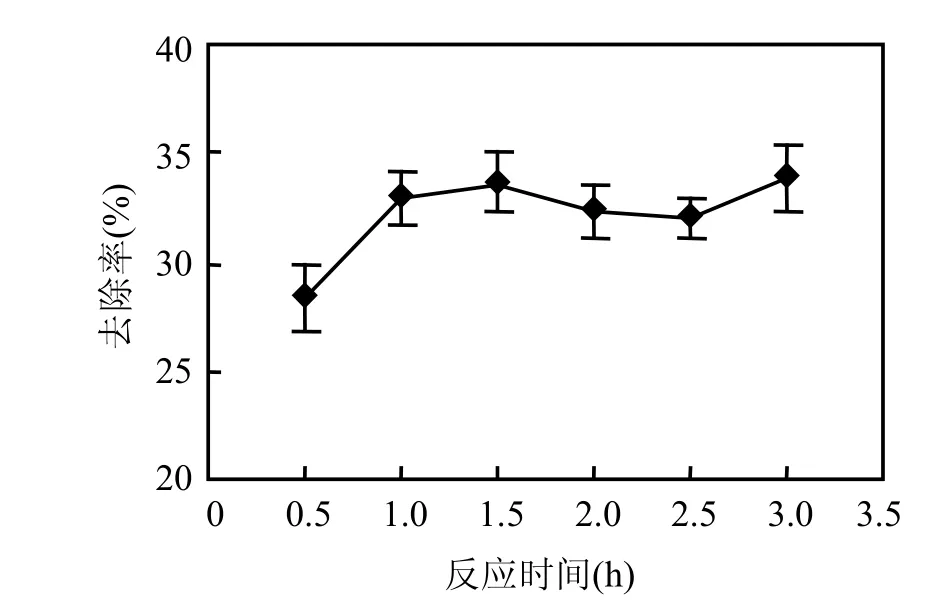
图4 不同反应时间对CODCr去除率的影响Fig.4 Effects of reaction time on CODCr removal rate using Fenton’s reagent oxidization method
由图4可知,CODCr去除率随着反应时间的增加而增加,当反应时间达到1.0h时,CODCr从5619.7mg/L降至3767.7mg/L,去除率为33.0%.之后继续增加反应时间,去除率基本保持不变.这是因为,反应初始,H2O2和Fe2+的浓度大,生成的·OH的量和速度较快,CODCr去除率随时间的延长而增大.当反应到一定时间之后,随着反应消耗,H2O2和Fe2+的浓度减小,同时废水有机污染物浓度逐渐降低,以及双氧水的自行分解,都不利于反应的进行,从而导致了 CODCr去除率趋于稳定[18].从经济和效果上考虑,本试验确定最佳反应时间为1.0h.
2.2 O3氧化处理
2.2.1 反应时间对处理效果的影响 在原水pH9.2条件下持续通入O3,于不同时间取样,考察反应时间对处理效果的影响,结果见图5.
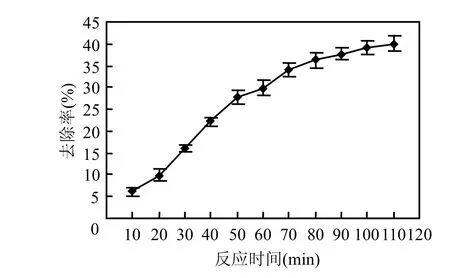
图5 不同反应时间对CODCr去除率的影响Fig.5 Effects of reaction time on CODCr removal rate using ozone oxidization method
由图5可知,CODCr去除率随着反应时间的增加迅速增加,当反应 70min时,CODCr从5619.7mg/L降至3705.3mg/L,去除率为34.1%,之后继续进行反应,去除率增加幅度开始变小.这可能是因为在开始阶段,废水中存在着大量的有机物,通入O3后迅速被氧化,随着反应的进行,易被O3氧化的物质浓度逐渐变小,另外 O3氧化还可能生成某些仍是CODCr的组成部分,但不易被O3氧化的中间物质[19],因此随着反应时间的增加,CODCr去除率曲线逐渐变的平缓.考虑到处理成本,本试验确定最佳反应时间为70min.
2.2.2 pH值对处理效果的影响 图6为在反应时间为70min条件下,pH值对处理效果的影响.由图6可知,在pH值为6.0~12.0时,废水的CODCr去除率维持在 35.5%~36.7%之间,因此pH 值对O3氧化处理荧光增白剂生产废水的影响作用并不明显.
有资料证明[20],O3氧化反应与废水的pH值有关,在碱性时,以·OH 氧化为主,在酸性时,以臭氧氧化为主.但是,O3的溶解度却随着pH值的升高而降低,从而会造成传质推动力的降低[21].本试验结果表明,废水pH值对处理效果的影响并不明显,这是因为虽然随着pH值的升高,O3分解产生的·OH量增大,有利于废水CODCr的去除,但是由于O3溶解度的降低,2种效应相互抵消,导致最终CODCr去除率相差不大,另外这还可能与废水成分的差异有关.本试验结果表明pH值对荧光增白剂生产废水处理效果的影响可以忽略.
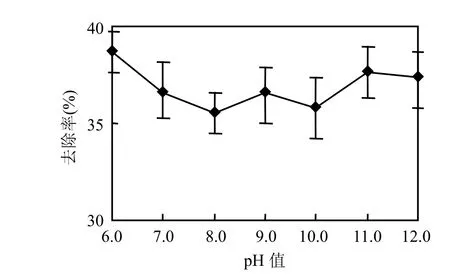
图6 不同pH值对CODCr去除率的影响Fig.6 Effects of pH on CODCr removal rate using ozone oxidization method
2.3 曝气铁炭微电解处理
2.3.1 铁炭质量比对处理效果的影响 在pH值为3.0,反应时间为4.0h条件下,考察铁炭质量比对处理效果的影响,结果见图7.

图7 不同铁炭质量比对CODCr去除率的影响Fig.7 Effects of iron to carbon weight ratio on CODCr removal rate using aerate ferric-carbon microelectrolysis method
由图7可知,CODCr去除率随着铁炭质量比的增加而增加,当铁炭质量比达到1时,CODCr从5619.7mg/L降至2598.9mg/L,去除率达到最大值53.8%,之后继续增大铁炭质量比,去除率开始下降.这是因为增加 Fe,Fe2+量会随之增加,使反应产生的新生态氢和·OH 数量增加,有利于废水CODCr的去除,但当Fe的投量过高时,Fe2+的生成速率过快,使溶液中瞬间积存大量的Fe2+,可能与·OH 发生反应:Fe2++·OH→Fe3++OH-,消耗·OH,使CODCr的去除率下降[22].另外,过多Fe2+会影响CODCr,并对后续处理造成影响,同时也浪费铁.因此,根据试验结果,应选择的铁炭质量比为1.
2.3.2 反应时间对处理效果的影响 在pH 值为3.0,铁炭质量比为1条件下,考察反应时间对处理效果的影响,结果见图8.
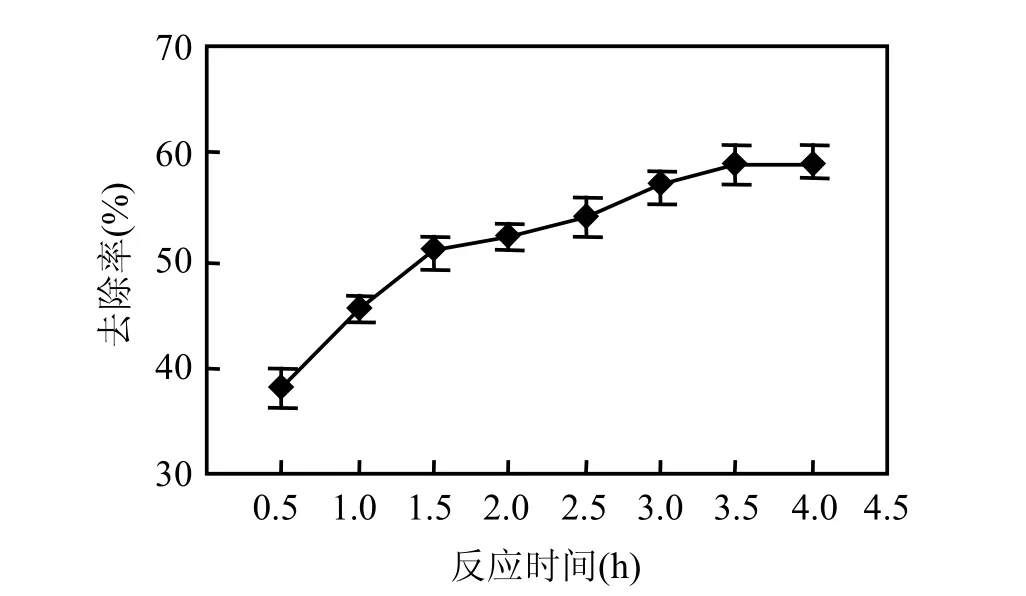
图8 不同反应时间对CODCr去除率的影响Fig.8 Effects of reaction time on CODCr removal rate using aerate ferric-carbon micro-electrolysis method
由图8可知,CODCr去除率随着反应时间的增加而增加,当反应到2.0h时,CODCr从5619.7mg/L降至2689.9mg/L,去除率为52.1%,之后继续进行反应,去除率增加缓慢.这是因为随着反应时间的增加,[H+]逐渐降低,[Fe2+]增加,系统在 Fe2+作用下产生新生态氢和·OH 速率加快,故处理效果逐步提高.2.0h后,由于 H+离子不断反应生成H2和H2O[22],使溶液pH值升高至5.0~6.0,偏离了其最佳pH值范围,使得反应速率减小,因此本试验确定反应时间为2.0h.
2.3.3 pH值对处理效果的影响 在铁炭质量比为1,反应时间为2.0h条件下,考察pH值对处理效果的影响,结果见图9.
由图9可知,废水在酸性范围内,处理效果较好,pH值为2.5时去除率最高,CODCr从5619.7mg/L降至2458.9mg/L,去除率为56.4%,之后继续增大pH值,去除率出现下降趋势.这是因为[H+]越大,产生新生态氢量越大,使得 CODCr的去除效果较好,而[H+]较低或者废水为碱性时,不利于新生态氢的产生,CODCr去除效率降低.图 9还表明pH值低于2.5时,处理效果反而下降,这一方面是因为酸度太大,铁屑会与酸反应直接生成H2,影响处理效果;另一方面,H+的浓度过高时,不利于Fe2+水解为具有较强吸附能力的Fe(OH)2[23],导致CODCr去除率降低;另外,pH值过低,产生的铁泥越多,增加了副产品的处理费用.因此本试验确定最佳pH值为2.5.
2.4 3种预处理方法的比较
在各自最佳反应条件下采用 3种处理方法对荧光增白剂生产废水进行了处理,试验结果见表1.

图9 不同pH值对CODCr去除率的影响Fig.9 Effects of pH on CODCr removal rate using aerate ferric-carbon micro-electrolysis method

表1 Fenton试剂氧化、O3氧化、曝气铁炭微电解法处理结果比较Table 1 Comparison of treatment efficiencies of Fenton’s reagent oxidization, ozone oxidization and aerate ferric-carbon micro-electrolysis method
由表1可知,经3种方法处理后,废水的可生化性均有明显提高,BOD5/CODCr均达到了 0.45以上;处理后废水的CODCr差别较大,其中曝气铁炭微电解法的效果最好,CODCr去除率可以达到57.1%,明显高于其他2种方法.
从反应机理上来看,Fenton试剂氧化法利用了·OH 的强氧化与 Fe3+的混凝双重功能对废水进行了处理,O3氧化主要利用·OH或O3的强氧化作用对废水中的有机物进行氧化,而在曝气铁炭微电解体系中,由于比常规的铁炭微电解处理增加了曝气设施,使得废水处理过程在新生态氢和·OH氧化、Fe3+混凝等多种因素共同作用下进行.本实验 3种方法对荧光增白剂生产废水CODCr的去除效果顺序为:曝气铁炭微电解法>Fenton试剂氧化法>O3氧化法,这与其反应机理是密切相关的.
从处理成本上看,在曝气铁炭微电解处理中,所用的原材料是废铁屑和活性炭,其中活性炭作为阴极不被消耗,在实际运行中只需补充废铁屑,就可以长时间保持较好的去除率,同时还可以达到“以废治废”的效果,调节pH 值也只需用工业硫酸或废酸即可,这样不但废水处理效果好,而且成本比较低.Fenton试剂法不但需要调节pH值,还需要消耗价格较高的H2O2和FeSO4·7H2O,O3氧化法中的O3的制备成本也比较高,所以综合比较处理效果和处理成本,认为曝气铁炭微电解是处理荧光增白剂生产废水最合适的预处理方法.
3 结论
3.1 Fenton试剂氧化法处理荧光增白剂生产废水的最佳反应条件是H2O2投加量为0.13mol/L,H2O2/Fe2+(物质的量比)为20,反应pH 值为5.0,反应时间为1.0h,在最佳条件下CODCr去除率可达39.9%,BOD5/CODCr达到0.51.
3.2 O3氧化法处理荧光增白剂生产废水的最佳反应条件确定为O3反应时间为70min,即O3通入量为2.51g/L,在原水pH值条件下(pH值为9.2)反应即可,CODCr去除率可达36.7%,BOD5/CODCr达到0.47.
3.3 曝气铁炭微电解法处理荧光增白剂生产废水的最佳反应条件是铁炭质量比为 1,反应时间2.0h,反应pH值为2.5,CODCr去除率可达57.1%,BOD5/CODCr达到0.45.
3.4 3种处理方法以曝气铁炭微电解法效果最好,且处理成本最低,并且还可以达到“以废治废”的效果.
[1]章一丹,徐灏龙,谢 娟,等.催化铁内电解混凝生物膜法处理荧光增白剂生产废水 [J]. 江苏环境科技, 2007,20(2):33-34.
[2]Kohler A, Hellweg S, Escher Bl, et al. Organic pollutant removal versus toxicity reduction in industrial wastewater Treatment: the example of wastewater from fluorescent whitening agent production [J]. Environmental Science and Technology, 2006,40(10):3395-3401.
[3]谢 成,晏 波,韦朝海,等.焦化废水Fenton氧化预处理过程中主要有机污染物的去除 [J]. 环境科学学报, 2007,27(7):1101- 1106.
[4]Deng Y, Englehardt J D. Treatment of landfill leachate by the Fenton process [J]. Water Research, 2006,(40):1308-1319.
[5]高蓉菁,夏明芳,尹协东,等.臭氧氧化法处理印染废水 [J]. 污染防治技术, 2003,16(4):68-70.
[6]Medeiros D R, Pires E C, Mohseni M. Ozone oxidation of pulp and paper wastewater and its impact on molecular weight distribution of organic matter [J]. Ozone-Science and Engineering,2008,30(1):105-110.
[7]杨家村.铁碳微电解—生化法处理医药废水 [J]. 环境卫生工程, 2006,14(3):56-57.
[8]褚衍洋,徐迪民.铁促电解法处理垃圾渗滤液中有机污染物 [J].中国环境科学, 2007,27(1):80-83.
[9]李艳华,杨凤林,张捍民,等.内电解-Fenton氧化-膜生物反应器处理腈纶废水 [J]. 中国环境科学, 2008,28(3):220-224.
[10]国家环境保护总局水和废水监测分析方法编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.
[11]Lee H, Shoda M. Removal of COD and color from livestock wastewater by the Fenton method [J]. Journal of Hazardous Materials, 2008,153(3):1314-1319.
[12]李 锋,柳艳修,宋 华,等.Fenton试剂预处理丙烯腈废水的研究 [J]. 工业安全与环保, 2007,33(1):21-23.
[13]张娴娴,尹光志,李东伟.Fenton试剂催化氧化法处理焦化废水的实验研究 [J]. 矿业安全与环保, 2005,32(2):12-15.
[14]王罗春,闻人勤,丁桓如.Fenton试剂处理难降解有机废水及其应用 [J]. 环境保护科学, 2001,27(3):11-14.
[15]唐文伟,曾新平,胡中华.芬顿试剂和湿式过氧化氢氧化法处理乳化液废水研究 [J]. 环境科学学报, 2006,26(8):1265-1270.
[16]田森林,莫 虹,蒋 蕾,等.Fenton试剂液相氧化法净化含 H2S的气体 [J]. 中国环境科学, 2008,28(11):1052-1056
[17]陈传好,谢 波,任 源,等.Fenton试剂处理废水中各影响因子的作用机制 [J]. 环境科学, 2000,21(5):15-18.
[18]徐 颖,陈 磊,周俊晓.Fenton氧化-生化组合工艺处理燃料中间体废水 [J]. 环境工程学报, 2007,1(4):57-60.
[19]阳立平.臭氧氧化法处理高浓度苯酚废水 [J]. 资源开发与市场, 2005,21(2):86-88.
[20]Philip C S, et al. Assessing ozonstion research needs in water treatment [J]. Am Water Works Assoc, 1990,82(10):512-520.
[21]张 晖,程 江,杨卓如,等.水中对硝基酚的臭氧化研究 [J]. 化工学报, 1996,47(4):488-494.
[22]张树艳,程丽华,曹为祥.铁炭微电解处理农药废水的研究 [J].化学工程师, 2004,108(9):35-37.
[23]李再兴,杨景亮,罗人明,等.铁炭内电解-厌氧-好氧工艺处理阿维菌素废水的试验研究 [J]. 环境污染治理技术与设备,2002,3(4):5-8.
