三个新的玉米SnRK2基因的鉴定和特征分析
2009-01-15李利斌刘开昌李现刚
李利斌 刘开昌 李现刚
摘 要:利用比较基因组学的方法从玉米的基因组中鉴定出三个新的SnRK2基因,并对这三个基因的外显子-内含子结构、蛋白基序、遗传进化以及上游顺式调控元件进行了分析,为进一步研究它们在玉米逆境应答中的功能和利用它们进行玉米分子育种奠定了基础。
关键词:玉米;SnRK2基因;比较基因组学;特征分析
中图分类号:Q785 文献标识号:A 文章编号:1001-4942(2009)12-0007-05
植物在生长发育过程中经常遇到不良的环境条件如干旱、盐胁迫、低温或高温的影响。为了生存,植物进化出复杂的生理和遗传机制来感受外部刺激并对逆境做出响应[24]。阐明植物逆境胁迫的抗性机制和提高作物在各种胁迫条件下的抗性水平是各国科学家研究的主要目标。已有研究表明,植物SNF1相关蛋白激酶家族基因参与了植物的多种逆境响应和生长发育过程[2~4,6,7,9,14,21,23,25]。根据核酸和蛋白序列相似性,植物中的SNF1相关蛋白激酶基因分为三个家族:SnRK1、SnRK2和SnRK3[12]。其中,SnRK1和动物中AMPK基因同源,主要参与碳代谢和能量代谢;SnRK2和SnRK3为植物特有,主要参与对环境因素如干旱和盐胁迫等的应答过程。越来越多的研究表明,SnRK2家族基因在植物脱落酸(Abscisic acid, ABA)信号转导、渗透胁迫响应、气孔开闭、矿质营养吸收以及生长发育过程中具有重要作用。例如,拟南芥AtSnRK2.6/OST1可以和ABI(ABA不敏感型突变体)互作来整合ABA和渗透胁迫的信号,正向调节气孔关闭[1,19,26]。最近研究发现AtOST1在拟南芥中对于防止细菌从气孔的入侵是必需的[18]。对AtSnRK2.10的研究显示,它能够磷酸化拟南芥和水稻中的脱水素蛋白,而且可以和磷脂酸结合调控逆境反应[22]。而AtSnRK2.8/AtSnRK2C与代谢有关,而且在缺钾条件下下调表达,植株生长明显下降,而过量表达AtSnRK2.8可显著增强拟南芥植株在干旱胁迫下的抗性和生长[18,20]。衣藻的SnRK2.1和拟南芥的AtSnRK2.3在调节硫饥饿条件下的基因表达和代谢反应起到重要作用[11,13],而且AtSnRK2.2和AtSnRK2.3在种子萌发、根系生长及幼苗生长过程中ABA信号转导方面具有重要功能[7]。而AtSnRK2.9在缺磷条件下诱导表达,突变体研究表明AtSnRK2.9对拟南芥生物量和种子产量形成具有重要作用[10]。蚕豆的AAPK基因可以通过磷酸化RNA结合蛋白AIPK1来调节脱水素基因的表达和逆境响应[16,17]。麦类的PKABA1与 ABA的信号转导有关[11],小麦的W55a参与多种逆境应答[23]。研究还发现,SnRK2家族不同成员对ABA和渗透胁迫的响应有所不同,它们在胁迫条件下可以被磷酸化和激活,并优先磷酸化bZIP类的转录激活子,如拟南芥中的AREB1和水稻的TRAB1/ABFs,从而调节它们的活性和下游基因的表达[5, 8,15]。另外,活化的SnRK2蛋白可以自身磷酸化,而且在ABA和渗透胁迫条件下SnRK2被磷酸化的机制有所不同[4,14]。
玉米是目前世界上第一大作物,我国第二大作物。人们围绕玉米的抗旱生理和遗传机制及品种抗旱性改良做了大量的研究工作。尽管SnRK2基因在植物渗透胁迫反应和ABA信号转导过程中具有重要功能,但关于玉米SnRK2基因的研究很不充分[27,28]。通过生物信息学分析,本试验鉴定出三个新的玉米SnRK2基因,对它们的基因结构、蛋白基序、启动子区的顺式作用元件进行了预测和分析,并对它们与拟南芥和水稻的SnRK2基因进行了系统进化分析,为进一步研究这些基因在玉米中的功能奠定了基础。
1 材料与方法
用已克隆的水稻SnRK2基因序列搜索各类公共数据库,寻找玉米的SnRK2序列,通过NCBIblastX进行序列比对和在MaizeGDB中进行EST搜索比对,确定玉米SnRK2基因及其编码序列。利用Mega 4.1对这些基因及拟南芥和水稻的SnRK2基因进行系统进化分析,拟南芥和水稻的SnRK2基因序列号见参考文献[14]。利用PlantsP Feature Scan对玉米SnRK2基因编码的蛋白进行结构预测和分析。利用Maizesequence中的结果和SnRK2基因所在玉米基因组克隆BAC的信息对它们进行染色体定位。通过SnRK2编码区和基因组序列的比对来显示基因外显子和内含子的结构组成。根据编码区序列和其所在BAC的序列得到各个SnRK2基因起始密码子ATG上游2 000 bp的启动子区及上游序列。利用PLANTCARE对启动子区的顺式反应元件进行预测分析。
2 结果与分析
2.1 玉米SnRK2新基因的鉴定和特征分析
通过独立的序列搜索和分析,作者在玉米基因组中找到三个SnRK2基因,分别位于基因组克隆AC207670、AC197912和AC214763中。根据它们所在基因组克隆的定位信息,确认这三个基因为新的SnRK2基因,与王国英研究组报道的11个玉米SnRK2基因和邹华文等报道的ZmSPK1不同[27,28]。序列分析发现ZmSPK1与王国英研究组报道的ZmSnRK2.6一致。为统一起见,作者将这三个新基因分别命名为ZmSnRK2.12、ZmSnRK2.13和ZmSnRK2.14。它们在染色体上的分布和序列结构特征见表1和图1。这三个基因分别位于玉米的5号或4号染色体上,分别含有5个或8个内含子。序列分析发现在ZmSnRK2.14的第六和第七个外显子之间存在一个8 460 bp的内含子,这个内含子包含一个5 000 bp左右与水稻的多聚蛋白类似的转座子序列。在GenBank中, 它们都有相应的cDNA序列,说明这些基因都是可表达的基因。
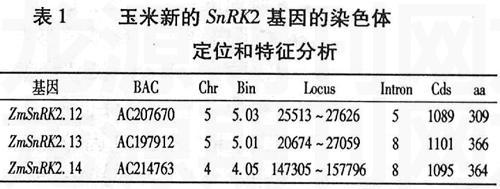
蛋白结构域预测分析发现(见表2),玉米的这三个基因预测编码的蛋白都含有激酶结构域、ATP-结合区、丝氨酸/苏氨酸蛋白激酶活性位点和三个潜在的豆蔻酰化位点。另外,ZmSnRK2.12和ZmSnRK2.13具有天冬氨酸富含区,而ZmSnRK2.12还具有一个跨膜结构域。这说明三个新的玉米SnRK2蛋白具有ser/thr蛋白激酶的结构特征,可能被豆蔻酰化修饰调节。

2.2 玉米SnRK2新基因的序列比对和系统进化分析
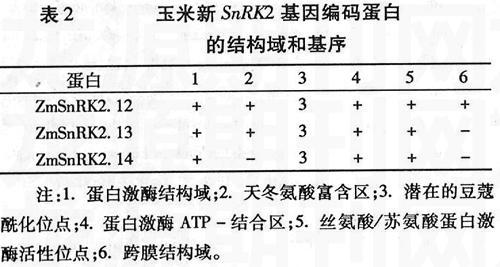
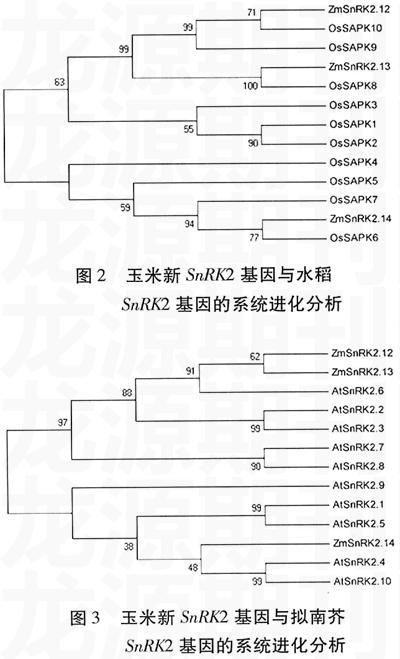
将三个玉米SnRK2新基因与水稻、拟南芥的SnRK2基因进行了系统进化分析和序列比对。结果(图2、3)表明,ZmSnRK2.12/OsSAPK10、ZmSnRK2.13/OsSAPK8、ZmSnRK2.14/OsSAPK6可能为直系同源基因,它们编码的蛋白激酶结构域的序列一致性分别为96.50%、94.19%、98.05%。已有研究表明,OsSAPK6可通过磷酸化ABF类转录因子来调节对ABA的应答[5],而OsSAPK8和OsSAPK10的表达受ABA和渗透胁迫调节,而且可被磷酸化调节[14]。另外,三个玉米SnRK2新基因与拟南芥SnRK2的进化分析表明,ZmSnRK2.12/AtSnRK2.6、ZmSnRK2.13/AtSnRK2.6、ZmSnRK2.14/AtSnRK2.4、ZmSnRK2.14/AtSnRK2.10可能为直系同源基因, 它们编码的蛋白激酶结构域的序列一致性分别为91.83%、 90.70%、 87.94%、 86.77%。AtSnRK2.6在调节气孔运动和ABA信号转导过程中具有重要功能,而且能够通过磷酸化ABF类转录因子来行使功能[1,19,26],防止细菌从气孔入侵拟南芥[18]。对AtSnRK2.10的研究显示,它能够磷酸化拟南芥中的脱水素蛋白,还可与磷脂酸结合调控胁迫应答反应[22]。根据进化分析和水稻、拟南芥SnRK2基因功能研究的结果,推测玉米的SnRK2.12具有与AtSnRK2.6和OsSAPK10类似的功能,SnRK2.13与AtSnRK2.6和OsSAPK8的功能相似,而SnRK2.14与OsSAPK6和拟南芥的AtSnRK2.4/AtSnRK2.10功能相似。
2.3 玉米SnRK2新基因的顺式反应元件预测
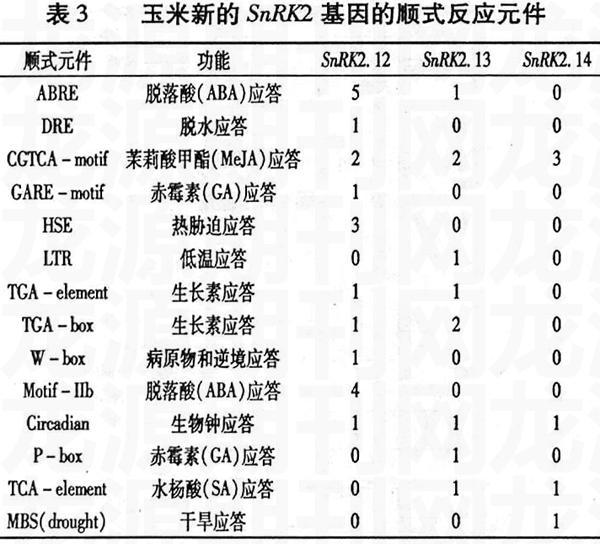
高等植物基因的表达主要是顺式反应元件和反式作用因子相互作用的结果。分析基因启动子序列中顺式反应元件的类型可以为研究基因的功能提供一定线索。本研究在得到三个玉米新基因的基因组序列后,对起始密码子ATG上游2 000 bp序列所包含的顺式元件进行了预测分析。 结果(表3)表明, 3个玉米SnRK2新基因启动子区存在多个不同逆境和激素应答顺式作用元件: SnRK2.12拥有脱落酸应答元件ABRE和Motif-IIb、脱水应答元件DRE、热胁迫应答元件HSE、茉莉酸甲酯(MeJA)应答元件CGTCA-motif、赤霉素(GA)应答元件GARE-motif、生长素应答元件TGA-element和TGA-box、生物钟应答元件以及病原物和逆境应答元件W-box; SnRK2.13拥有脱落酸应答元件ABRE、茉莉酸甲酯应答元件、低温应答元件、生长素应答元件、生物钟应答元件、赤霉素应答元件P-box、水杨酸应答元件; 而SnRK2.14的顺式元件较少,仅存在茉莉酸甲酯应答元件、生物钟应答元件、水杨酸应答元件、干旱应答元件MBS和生物钟应答元件。这说明三个玉米SnRK2新基因可能参与多种逆境和激素信号的应答,在植物逆境响应过程中具有重要功能,值得深入探讨。
3 小结
本研究利用比较基因组学的方法,从玉米基因组中鉴定出三个新的SnRK2基因。序列相关信息分析表明,它们不同于以前报道的玉米SnRK2基因。这样在玉米的基因组中至少存在14个SnRK2基因,而在水稻的基因组中目前确认有10个SnRK2基因。这可能与玉米拥有较大的基因组有关。进化和顺式元件分析表明, 这三个新的玉米SnRK2基因可能在ABA信号转导和逆境应答过程中具有重要功能。它们的表达调控、在基因网络中的位置和功能,以及在玉米抗逆分子育种中的应用值得进一步研究。
参 考 文 献:
[1] Belin C, Franco P, Bourbouss C, et al. Identification of features regulating OST1 kinase activity and OST1 function in guard cells[J]. Plant Physiology, 2006, 141:1316-1327.
[2] Boudsocq M,Laurière C. Osmotic signaling in plants. Multiple pathways mediated by emerging kinase families[J]. Plant Physiology, 2005,138: 1185-1194.
[3] Boudsocq M, Barbier-Brygoo H, Laurière C. Identification of nine sucrose nonfermenting 1-related protein kinases 2 ctivated by hyperosmotic and saline stresses in Arabidopsis thaliana[J]. J. Biol.Chem., 2004, 279: 41758-41766.
[4] Boudsocq M, Droillard M, Barbier-Brygoo H,et al.Different phosphorylation mechanisms are involved in the activation of sucrose non-fermenting 1 related protein kinases 2 by osmotic stresses and abscisic acid[J]. Plant Mol. Biol.,2007,63: 491-503.
[5] Chae M J, Lee J, Nam N, et al. A rice dehydration-inducible SNF1-related 2 phosphorylates an abscisic acid responsive factor and associates with ABA signaling[J].Plant Mol. Biol.,2007,63:151-169.
[6] Diédhiou C J, Popova O V, Dietz K,et al. The SNF1-type serine/threonine protein kinase SAPK4 regulates stress-responsive gene expression in rice[J]. BMC Plant Biology, 2008, 8: 49-61.
[7] Fujii H, Verslues P E,Zhu J K. Identification of two protein kinases required for abscisic acid regulation of seed germination, root growth, and gene expression in Arabidopsis[J].The Plant Cell, 2007, 19: 485-494.
[8] Furihata T, Maruyama K, Fujita Y, et al. Abscisic acid-dependent multisite phosphorylation regulates the activity of a transcription activator AREB1[J]. Proc. Natl. Acad. Sci. USA, 2006, 103: 1988-1993.
[9] Gonzalez-Ballester D, Pollock S, Pootakham W,et al. The central role of a SNRK2 kinase in sulfur deprivation responses[J]. Plant Physiology,2008, 147(1): 216-227.
[10]Hétu M F. Effect of nutritional status on phenotypic characteristics of Arabidopsis and alfalfa in relation to the expression of AtSnRK2.9[D].Canada:Queen's University,2007.
[11]Holappa L D, Walker-Simmons M K, Ho T H D,et al. A Triticum tauschii protein kinase related to wheat PKABA1 is associated with ABA signaling and is distributed between the nucleus and cytosol[J]. Journal of Cereal Science, 2005, 41:333-346. [12]Hrabak E M, Chan C W, Gribskov M,et al. The Arabidopsis CDPK-SnRK superfamily of protein kinases[J].Plant Physiol., 2003, 132: 666-680.
[13]Kimura T, Shibagaki N, Ohkama-Ohtsu N,et al. Arabidopsis SNRK2.3 protein kinase is involved in the regulation of sulfur-responsive gene expression and O-acetyl-l-serine accumulation under limited sulfur supply[J]. Soil Science & Plant Nutrition, 2006, 52 (2) : 211-220.
[14]Kobayashi Y, Yamamoto S, Minami H,et al. Differential activation of rice sucrose nonfermenting 1-related protein kinase2 family by hyperosmotic stress and abscisic acid[J]. Plant Cell, 2004, 16:1163-1177.
[15]Kobayashi Y, Murata M, Minami H,et al. Abscisic acid-activated SNRK2 protein kinases function in the gene-regulation pathway of ABA signal transduction by phosphorylating ABA response element-binding factors[J]. Plant J., 2005, 44: 939-949.
[16]Li J, Wang X Q, Watson M B,et al. Regulation of abscisic acid-induced stomatal closure and anion channels by guard cell AAPK kinase[J]. Science, 2000, 287: 300-303.
[17]Li J, Kinoshita T, Pandey S, et al. Modulation of an RNA-binding protein by abscisic-acid-activated protein kinase[J]. Nature, 2002, 418: 793-797.
[18]Melotto M, Underwood W, Koczan J,et al. Plant stomata function in innate immunity against bacterial invasion[J]. Cell, 2006, 126(5): 969- 980.
[19]Mustilli A C, Merlot S, Vavasseur A,et al. Arabidopsis OST1 protein kinase mediates the regulation of stomatal aperture by abscisic acid and acts upstream of reactive oxygen species production[J]. Plant Cell, 2002, 14: 3089-3099.
[20]Shin R, Alvarez S, Burch A Y,et al. Phosphoproteomic identification of targets of the Arabidopsis sucrose nonfermenting-like kinase SnRK2.8 reveals a connection to metabolic processe[J]. PNAS,2007, 104(15): 6460-6465.
[21]UmezawaT, Yoshida R, Maruyama M,et al. SRK2C, a SNF1-related protein kinase 2, improves drought tolerance by controlling stress-responsive gene expression in Arabidopsis thaliana[J]. PNAS,2004, 101(49): 17306-17311.
[22]Vlad F, Turk B , Peynot P,et al. A versatile strategy to define the phosphorylation preferences of plant protein kinases and screen for putative substrates[J]. Plant Journal,2008, 55(1):104-117.
[23]Xu Z S, Liu L, Ni Z Y,et al. W55a encodes a novel protein kinase that is involved in multiple stress responses[J]. Journal of Integrative Plant Biology, 2009, 51(1): 58-66.
[24]Yamaguchi-Shinozaki K, Shinozaki K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J]. Annu. Rev. Plant Biol.,2006, 57: 781-803.
[25]Yoshida R, Hobo T, Ichimura K,et al. ABA-activated SnRK2 protein kinase is required for dehydration stress signaling in Arabidopsis[J]. Plant Cell Physiol.,2002, 43: 1473-1483.
[26]Yoshida R, Umezawa T, Mizoguchi T,et al. The regulatory domain of SRK2E/OST1/SnRK2.6 interacts with ABI1 and integrates abscisic acid (ABA) and osmotic stress signals controlling stomatal closure in Arabidopsis[J]. J. Biol. Chem., 2006, 281: 5310-5318.
[27]Zou H, Zhang X, Zhao J R,et al. Cloning and characterization of maize ZmSPK1,a homologue to nonfermenting1-related protein kinase2[J]. African Journal of Biotechnology, 2006, 5(6): 490-496.
[28]Huai J, Wang M, He J,et al. Cloning and characterization of the SnRK2 gene family from Zea mays[J]. Plant Cell Report, 2008, 27: 1861-1868.
